| |
| Med Sci (Paris). 38(8-9): 648–650. doi: 10.1051/medsci/2022096.Les lymphocytes T régulateurs favorisent l’inflammation pulmonaire par une reprogrammation dépendante de Notch4 Amandine Selle1,2 and Mehdi Benamar1,2* 1Division of immunology, Boston Children’s Hospital
,
Boston
,
Massachusetts
,
États-Unis
.
2Department of pediatrics, Harvard Medical School
,
Boston
,
Massachusetts
,
États-Unis
.
MeSH keywords: Humains, Pneumopathie infectieuse, Récepteur Notch4, Récepteurs Notch, Lymphocytes T régulateurs, génétique |
Les maladies pulmonaires inflammatoires, comme l’asthme allergique ou les infections virales telles que la grippe ou la COVID-19 (
coronavirus disease 2019
), peuvent entraîner des complications chroniques graves, et mener, dans certains cas, au décès du patient [
1
]. Mieux comprendre les mécanismes et les acteurs cellulaires impliqués dans ces processus est donc un enjeu de santé publique majeur. Les lymphocytes T régulateurs (Treg) jouent un rôle clé [
2
]. Cette sous-population des lymphocytes T CD4
+
exprime le facteur de transcription FOXP3 (
forkhead box P3
) et la chaîne a du récepteur de l’IL(interleukine)-2. Les Treg contribuent à l’homéostasie immunitaire en instaurant une tolérance envers les auto-antigènes et les antigènes exogènes, comme ceux exprimés par le microbiote et les antigènes environnementaux. De plus, les lymphocytes Treg contrôlent la majorité des réponses immunitaires afin de limiter les dommages collatéraux induit par l’inflammation [
3
]. Les lymphocytes Treg peuvent être subdivisés en deux sous-populations : les lymphocytes Treg naturels, qui se développent dans le thymus, et les lymphocytes Treg induits, qui se différencient à partir de lymphocytes T CD4
+
FOXP3
−
conventionnels dans les organes lymphoïdes secondaires et dans d’autres organes comme le poumon et l’intestin. Au cours de leur différenciation, les lymphocytes Treg induits acquièrent le facteur de transcription Foxp3, permettant ainsi leur maturation et l’acquisition de fonctions régulatrices grâce à l’expression de différents marqueurs (PD-1, CTLA-4 et ICOS), ainsi que la sécrétion de cytokines anti-inflammatoires comme l’IL-10, l’IL-35 et le TGF-β (
transforming growth factor
β) [
4
]. Les lymphocytes Treg, naturels et induits, sont impliqués dans différents mécanismes de tolérance immunitaire. En effet, les lymphocytes Treg induits induisent une tolérance immunitaire envers les antigènes exogènes, tandis que les lymphocytes Treg naturels induisent une tolérance immunitaire envers les auto-antigènes. Les résultats de nombreuses études ont montré que les lymphocytes Treg présentent un certain degré de plasticité. En effet, ils peuvent, en plus de l’expression de FOXP3, être reprogrammés et sécréter des cytokines pro-inflammatoires spécifiques des différentes sous-populations de lymphocytes T effecteurs, comme l’interféron-g (lymphocytes Th1), l’IL-4, l’IL-5, l’IL-13 (lymphocytes Th2) ou l’IL-17 (lymphocytes Th17). Cependant, les mécanismes de reprogrammation ne sont pas encore complètement élucidés [
5
]. La famille des protéines Notch étant impliquée dans les processus de différenciation des lymphocytes T [
6
], nous avons donc cherché à comprendre le rôle éventuel des protéines de cette famille (Notch1-4) dans la dérégulation et la plasticité des lymphocytes Treg lors de l’exacerbation de l’inflammation des voies respiratoires.
|
L’inflammation pulmonaire induit l’expression de Notch4 par les lymphocytes T régulateurs
L’étude de la voie Notch dans les lymphocytes Treg a commencé après la mise en évidence d’une augmentation spécifique de l’expression de Notch4, corrélée à la sévérité de la maladie, par les lymphocytes Treg de patients asthmatiques [
7
] ou infectés par le SARS-CoV-2 (
severe acute respiratory syndrome coronavirus 2
) [
8
]. Pour tenter de comprendre le rôle des lymphocytes Treg Notch4
+
dans ces deux maladies, nous avons eu recours à un modèle murin d’asthme allergique et à un modèle murin d’infection par le virus de la grippe H1N1. En analysant des souris mutantes privées de Notch4 dans les lymphocytes Treg (souris
Foxp3
YFPCre
-
Notch4
fl/fl
), nous avons montré l’absence d’inflammation pulmonaire dans ces deux modèles. Ce résultat confirme le rôle critique des lymphocytes Treg Notch4
+
dans l’inflammation pulmonaire.
|
La déstabilisation des lymphocytes T régulateurs par l’expression de Notch4 promeut l’inflammation pulmonaire
Pour tenter de comprendre l’effet protecteur de l’absence de Notch4 sur les lymphocytes Treg, nous avons analysé les mécanismes moléculaires associés, et nous avons montré qu’ils différaient selon la maladie. L’étude du transcriptome des lymphocytes Treg déficients en Notch4 dans le cadre de l’inflammation associée à l’asthme allergique a mis en évidence une augmentation des voies de signalisation Hippo et b-caténine/Wnt. Nous avons découvert que la voie Hippo contrôle l’équilibre Treg/T
H
17 et la stabilité des lymphocytes Treg. En effet, nous avons montré que les lymphocytes Treg se déstabilisent durant l’inflammation associée à l’asthme à la suite d’une déméthylation de la région TSDR (
regulatory T-cell–specific demethylated region
) de
Foxp3
par un mécanisme dépendant de la voie de signalisation Hippo et plus spécifiquement des protéines YAP (
yes-associated protein
) et TAZ (ou WWTR1
, WW domain-containing transcription regulator 1
). Cette déstabilisation est associée à une augmentation de la sécrétion d’IL-17 par ces lymphocytes Treg. La voie b-caténine/Wnt, quant à elle, stimule la production de l’IL-4, de l’IL-13 et de GDF-15 (
growth differentiation factor 15
). La protéine GDF-15 appartient à la superfamille du TGF-β (
transforming growth factor
b), et sa fonction n’est pas encore totalement identifiée, mais on sait qu’elle peut jouer un rôle pro-inflammatoire ou anti-inflammatoire [
9
]. Nous avons montré que la protéine GDF-15 produite par les lymphocytes Treg contrôle la sécrétion de cytokines par les cellules lymphoïdes innées de type 2 (ILC2), et que ce mécanisme promeut l’inflammation associée à l’asthme [
7
]
(
Figure 1
)
.
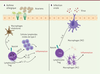 | Figure 1.
Rôle de l’expression de Notch4 par les lymphocytes T régulateurs dans l’inflammation pulmonaire associée à l’asthme ou à une infection virale. A.
L’induction d’un asthme allergique chez la souris provoque une activation des macrophages alvéolaires qui vont à leur tour promouvoir l’expression de Notch4 par les lymphocytes T régulateurs
via
une augmentation de production d’IL-6. Notch4 active les voies de signalisation Wnt/b-caténine et Hippo, qui induisent l’augmentation de production de cytokines pro-inflammatoires.
B.
L’infection virale induit la production d’IL-6, qui promeut l’expression de Notch4 par les lymphocytes T régulateurs. Cette expression va inhiber la production d’amphiréguline (Areg), ce qui promeut la polarisation des macrophages vers un état pro-inflammatoire et inhibe la réparation tissulaire.
|
Par ailleurs, nous avons également montré que l’expression de Notch4 par les lymphocytes Treg promeut l’inflammation pulmonaire induite par une infection virale : en effet, elle promeut la polarisation des macrophages vers un état pro-inflammatoire (M1) et inhibe la production d’amphiréguline, une protéine indispensable pour la réparation tissulaire des poumons infectés [
10
]
(
Figure 1
)
. L’ensemble de ces résultats indique que l’expression de Notch4 par les lymphocytes Treg induit leur déstabilisation et promeut l’inflammation pulmonaire [
8
].
|
Notch4, une cible thérapeutique pertinente contre l’inflammation pulmonaire chez l’homme
Nous avons découvert l’existence de mécanismes similaires chez l’homme. En effet, l’analyse de lymphocytes Treg circulants chez des patients asthmatiques a montré une augmentation de la voie b-caténine/Wnt, de la voie Hippo et de la production de GDF-15, corrélée avec la sévérité de la maladie. De plus, l’infection par le virus SARS-CoV-2 s’accompagne d’une diminution de la production d’amphiréguline, également corrélée avec la sévérité de la maladie et avec l’augmentation de l’expression de Notch4 par les lymphocytes Treg. L’ensemble de ces résultats suggère un fort potentiel thérapeutique de l’inhibition de Notch4 dans les maladies inflammatoires pulmonaires. Pour le prouver, nous avons produit des anticorps bloquant la protéine Notch4 humaine et nous avons montré, dans un modèle préclinique de souris humanisées (NOD-
Prkdc
scid
Il2rg
tmiwjl
/Sz), que l’utilisation de ces anticorps protège les souris contre l’inflammation pulmonaire induite par le virus de la grippe H1N1 [
8
].
|
Mehdi Benamar est co-inventeur à l’origine de la demande de brevet provisoire US 63/038,186 « Methods and compositions for treating coronavirus infectious disease ».
Amandine Selle déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Moldoveanu
B
,
Otmishi
P
,
Jani
P
,
et al.
Inflammatory mechanisms in the lung.
.
J Inflamm Res.
2009;
;
2
:
:1.
–
11
.
2.
Noval Rivas
M
,
Chatila
TA
.
Regulatory T cells in allergic diseases.
.
J Allergy Clin Immunol.
2016;
;
138
:
:639.
–
52
.
3.
Benoist
C
,
Mathis
D
.
Treg cells, life history, and diversity.
.
Cold Spring Harb Perspect Biol.
2012;
;
4
:
:a007021.
.
4.
Bilate
AM
,
Lafaille
JJ
.
Induced CD4
+
Foxp3
+
regulatory T cells in immune tolerance
.
.
Annu Rev Immunol.
2012;
;
30
:
:733.
–
758
.
5.
Sawant
DV
,
Vignali
DA
.
Once a Treg, always a Treg?
.
Immunol Rev.
2014;
;
259
:
:173.
–
191
.
6.
Amsen
D
,
Helbig
C
,
Backer
RA
.
Notch in T cell differentiation: All things considered.
.
Trends Immunol.
2015;
;
36
:
:802.
–
814
.
7.
Harb
H
,
Stephen-Victor
E
,
Crestani
E
,
et al.
A regulatory T cell Notch4-GDF15 axis licenses tissue inflammation in asthma.
.
Nat Immunol.
2020;
;
21
:
:1359.
–
70
.
8.
Harb
H
,
Benamar
M
,
Lai
PS
,
et al.
Notch4 signaling limits regulatory T-cell-mediated tissue repair and promotes severe lung inflammation in viral infections.
.
Immunity.
2021;
;
54
:
:1186.
–
99 e7
.
9.
Emmerson
PJ
,
Duffin
KL
,
Chintharlapalli
S
,
Wu
X
.
GDF15 and growth control.
.
Front Physiol.
2018;
;
9
:
:1712.
.
10.
Arpaia
N
,
Green
JA
,
Moltedo
B
,
et al.
A distinct function of regulatory T cells in tissue protection.
.
Cell.
2015;
;
162
:
:1078.
–
1089
.
|