| |
| Med Sci (Paris). 38(8-9): 640–642. doi: 10.1051/medsci/2022093.Infection chronique par le virus de l’hépatite C Les lymphocytes T épuisés persistent et signent après le traitement Pierre Tonnerre1* 1Université Paris Cité, Inserm, Immunologie humaine, physiopathologie et immunothérapie (HIPI)
,
Paris
,
France MeSH keywords: Maladie du greffon contre l'hôte, Hepacivirus, Hépatite C, Humains, Infection à long terme |
La mémoire immunitaire constitue un avantage certain dans la lutte contre les microorganismes pathogènes [
1
]. Après une infection aiguë ou une vaccination, des lymphocytes T mémoires subsistent pendant des années, voire des décennies [
1
,
2
]. Ils garantissent une réponse plus rapide et efficace en cas de nouvelle rencontre avec l’antigène contre lequel ils sont dirigés. À l’inverse, en cas de persistance de l’antigène lors d’une infection chronique ou d’un cancer, les lymphocytes T développent un phénotype dysfonctionnel, « épuisé », rendant impossible la différenciation en cellules mémoires [
3
]. Les lymphocytes T CD8
+
épuisés (T
EP
) sont caractérisés par une diminution graduelle des fonctions effectrices, en particulier la production de cytokines pro-inflammatoires : IFN (interféron)-γ, TNF-a (
tumor necrosis factor
a), IL (interleukine)-2. Celle-ci est associée à une expression accrue des récepteurs inhibiteurs (PD-1 [
programmed cell death 1
], CTLA-4 [
cytolytic T-lymphocyte-associated protein 4
], TIGIT [
T cell immunoreceptor with Ig and ITIM domains
], Tim-3 [
T-cell immunoglobulin and mucin containing protein-3
]), une activité métabolique altérée, un potentiel prolifératif diminué, et un programme épigénétique et transcriptionnel remodelé par le facteur de transcription TOX [
3
,
4
]. Revigorer les lymphocytes T
EP
constitue un enjeu majeur dans la lutte contre le cancer et les infections chroniques. Les immunothérapies utilisant des inhibiteurs de points de contrôle immunitaire, en particulier les anticorps anti-PD-1 et anti-CTLA-4, ont révolutionné le traitement du cancer. Cependant, de nombreux patients n’y répondent pas ou n’y répondent que transitoirement [
5
]. Il est donc essentiel de progresser dans la compréhension des mécanismes moléculaires et cellulaires de l’épuisement fonctionnel des T
EP
pour pouvoir développer des immunothérapies plus efficaces.
La persistance de l’antigène étant un élément clé dans la mise en place des mécanismes d’épuisement des lymphocytes T, il était légitime de se demander si un arrêt de la stimulation antigénique chronique permettrait la différenciation mémoire et la récupération fonctionnelle des lymphocytes T
EP.
Cette question simple, mais qui jusqu’ici se prêtait difficilement à une approche expérimentale, vient de faire l’objet de plusieurs études dont les résultats ont été publiés dans la revue
Nature Immunology
. Trois de ces études ont analysé les changements phénotypiques, fonctionnels, transcriptionnels et épigénétiques des lymphocytes T
EP
avant et après traitement de l’infection chronique par le virus de l’hépatite C (VHC) [
6
-
8
], tandis que la quatrième a utilisé un modèle murin d’infection par le virus de la chorioméningite lymphocytaire (LCMV) [
9
]. Ces travaux ont révélé l’existence d’altérations moléculaires qui empêchent la récupération fonctionnelle des lymphocytes T
EP
. Cependant, les résultats obtenus suggèrent qu’une intervention thérapeutique précoce pourrait empêcher un déficit fonctionnel irréversible de ces lymphocytes.
|
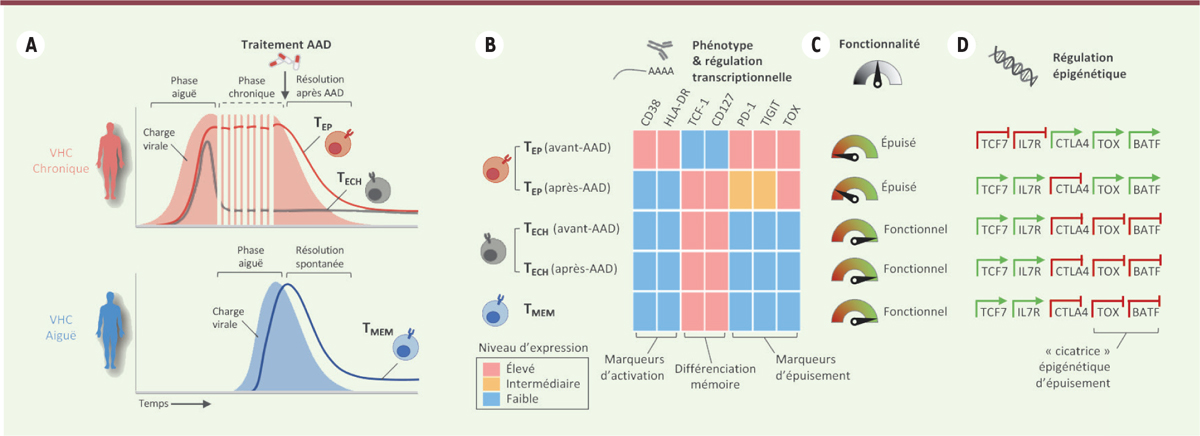
Histoire naturelle et traitement de l’infection chronique par le virus de l’hépatite C
Lors d’une infection par le VHC, environ 25 % des patients parviennent à éliminer naturellement le virus dans un délai de six mois et produisent des lymphocytes T mémoires fonctionnels (T
MEM
), mais la majorité des patients développent une infection chronique. Dans ce cas, une partie des lymphocytes T spécifiques du virus s’épuise du fait de la stimulation antigénique chronique (T
EP
), alors qu’une autre partie de ces lymphocytes n’est plus en mesure de reconnaître le virus après que celui-ci a muté,
in situ
. Cet échappement viral est couramment observé au cours de la première année d’une infection chronique par le VHC, conduisant à un sous-ensemble « échappé » de lymphocytes T CD8
+
(T
ECH
), spécifiques du VHC, mais avec une reconnaissance partielle ou annihilée des épitopes mutés [
10
]. L’infection par le VHC est à ce jour la seule infection virale chronique dont il est possible de guérir complètement grâce à des médicaments antiviraux à action directe qui bloquent la réplication du virus et permettent son élimination complète [
11
]
(
Figure 1A
)
. Il a donc été possible de suivre le devenir des lymphocytes T
EP
, épuisés par des décennies de stimulation antigénique chronique, avant et après traitement de l’infection par les antiviraux et l’arrêt rapide de la stimulation antigénique en une à deux semaines de traitement.
 | Figure 1.
L’infection chronique par le virus de l’hépatite C (VHC) comme modèle humain pour l’étude des lymphocytes T épuisés et mémoires. A.
Histoire naturelle et traitement de l’infection chronique par le VHC. T
EP
: lymphocytes T épuisés ; T
ECH
: lymphocytes T « échappés » ; T
MEM
: lymphocytes T mémoires.
B.
Signatures transcriptionnelle et phénotypique des différentes populations de lymphocytes T, avant et après le traitement de l’infection par des médicaments antiviraux à action directe (AAD).
C.
Représentation schématique des niveaux de fonctionnalité des lymphocytes T après stimulation antigénique.
D.
Remodelage épigénétique des différentes populations de lymphocytes T, avant et après traitement par AAD.
|
|
Différenciation mémoire des lymphocytes TEP après traitement de l’infection chronique par le VHC avec des antiviraux à action directe
Après la guérison thérapeutique de l’infection chronique par le VHC, les lymphocytes T
EP
spécifiques des antigènes viraux subissent d’importants changements transcriptionnels et phénotypiques. Ces modifications sont caractérisées par une perte d’expression des marqueurs d’activation des lymphocytes T (CD38 et HLA[
human leukocyte antigen
]-DR) et l’expression de molécules associées à la différenciation mémoire, telles que TCF-1 (
T cell factor-1
), CD127 et CCR7 (
CC-chemokine receptor 7
) [
6
,
7
]. Les niveaux d’expression de ces protéines sont semblables à ceux des lymphocytes mémoires T
MEM
ou T
ECH
, à l’exception de CCR7 qui n’est pas exprimé par les lymphocytes T
MEM
, suggérant l’existence de deux trajectoires mémoires distinctes [
7
]
(
Figure 1B
)
. Surtout, l’arrêt de la stimulation antigénique chronique s’accompagne d’une diminution de l’expression de multiples récepteurs inhibiteurs tels que PD-1, TIGIT, 2B4, CTLA-4 et plusieurs autres. Cependant, l’expression du facteur de transcription TOX par les lymphocytes T
EP
reste forte même après traitement par les antiviraux à action directe [
6
-
8
]
(
Figure 1B
)
. Ces résultats ont été confirmés dans un modèle murin d’infection par le LCMV (
lymphocytic choriomeningitis virus
) [
9
]. Ensemble, ces données suggèrent que l’élimination de l’antigène induit une différenciation mémoire des lymphocytes T
EP
concomitante d’une réduction partielle des mécanismes d’épuisement. Encore fallait-il savoir si ce phénotype particulier est associé à un rétablissement fonctionnel de ces lymphocytes.
|
Persistance d’un état d’épuisement fonctionnel des lymphocytes TEP après le traitement de l’hépatite virale chronique
Pour évaluer la réponse fonctionnelle des différentes populations de lymphocytes T, ceux-ci ont été stimulés
ex vivo
par des peptides viraux dédiés. La production de cytokines (IFN-γ, TNF-a, IL-2) et la dégranulation (CD107a), traduisant la capacité des lymphocytes T à produire une réponse cytotoxique, ont été mesurées. Après stimulation, un très faible niveau de réponse est observé pour les lymphocytes T
EP
avant traitement, en accord avec leur état d’épuisement. En comparaison, les lymphocytes T
ECH
provenant des mêmes patients en situation d’infection chronique ont un niveau de réponse élevé, équivalent à celui des lymphocytes T
MEM
(
Figure 1C
)
. Ces résultats confirment que la durée de la stimulation antigénique est un facteur déterminant dans la mise en place des mécanismes d’épuisement des lymphocytes T. Ils suggèrent également que l’inflammation chronique, inhérente à l’infection chronique par le VHC et à laquelle ont été exposés les lymphocytes T
ECH
pendant plusieurs années, a un impact limité sur l’épuisement fonctionnel des lymphocytes T. Cependant, après le traitement antiviral et malgré les changements phénotypiques et transcriptionnels décrits précédemment, les capacités fonctionnelles des lymphocytes T
EP
demeurent très altérées : certains de ces patients ont été suivis pendant plusieurs années sans qu’aucune amélioration fonctionnelle n’ait été observée. Ces résultats évoquent la persistance des mécanismes d’épuisement des lymphocytes T
EP
au-delà de l’arrêt de la stimulation antigénique chronique et malgré une différenciation apparente en lymphocytes T mémoires.
|
Une signature épigénétique des lymphocytes TEP caractéristique d’un état d’épuisement
Pour comprendre les mécanismes moléculaires associés à l’absence de récupération fonctionnelle des lymphocytes T
EP
après le traitement antiviral, deux études ont cartographié le remodelage épigénétique des lymphocytes T avant et après l’arrêt de la stimulation antigenique [
8
,
9
]. Après élimination de l’antigène, des zones de la chromatine accessibles à l’action de la transposase Tn5 – utilisée ici pour détecter les régions de l’ADN transcriptionnellement actives – apparaissent à proximité des gènes
TCF-7
et
IL7R
, en accord avec la différenciation mémoire des lymphocytes T
EP
. D’autres sites d’accessibilité de la chromatine ne sont plus détectables, notamment autour du gène codant le récepteur inhibiteur CTLA-4. Néanmoins, de nombreuses régions d’accessibilité restent inchangées. En particulier, des sites d’hyperaccessibilité ont été mis en évidence autour des gènes impliqués dans la régulation des mécanismes d’épuisement, tels que
TOX
et
BATF (
Figure 1D
)
. Ces mêmes sites ne sont pas accessibles dans les lymphocytes T
ECH
et T
MEM
fonctionnels. Ces résultats indiquent que les lymphocytes T
EP
conservent des « cicatrices » épigénétiques d’un état d’épuisement, même longtemps après l’arrêt de la stimulation antigénique chronique.
|
Les travaux présentés ici ont évalué les capacités intrinsèques des lymphocytes T
EP
à donner naissance à une réponse mémoire fonctionnelle après la suppression de la stimulation antigénique chronique. Les résultats obtenus montrent l’existence d’une différenciation mémoire après l’arrêt de la stimulation antigénique, mais qui ne permet pas la réacquisition des fonctions effectrices perdues. Ce nouveau statut de « cellules mémoires non opérationnelles » est marqué par la présence de « cicatrices » épigénétiques et transcriptionnelles durables. Les lymphocytes T
ECH
, qui n’ont plus été soumis à la stimulation antigénique depuis la phase aiguë de l’infection, ont, quant à eux, conservé une forte capacité de réponse, ce qui suggère qu’une intervention thérapeutique précoce pourrait prévenir la perte fonctionnelle des lymphocytes T
EP
. Néanmoins, il est important de noter que les lymphocytes T
ECH
ont adopté une trajectoire mémoire différente de celle des lymphocytes T
MEM
générés après la résolution spontanée de l’infection par le VHC. Il conviendra d’analyser le rôle du microenvironnement hépatique et de l’inflammation chronique sur les trajectoires phénotypiques et fonctionnelles de ces lymphocytes, et en particulier le devenir de ces cellules en cas de réinfection. Une meilleure compréhension de ces mécanismes est une condition préalable pour le développement de nouvelles thérapies impliquant une reprogrammation fonctionnelle pérenne des lymphocytes T
EP
.
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Kaech
SM
,
Wherry
EJ
,
Ahmed
R
.
Effector and memory T-cell differentiation: implications for vaccine development.
.
Nat Rev Immunol.
2002;
;
2
:
:251.
–
262
.
2.
Akondy
RS
,
Fitch
M
,
Edupuganti
S
,
et al.
Origin and differentiation of human memory CD8 T cells after vaccination.
.
Nature.
2017;
;
552
:
:362.
–
367
.
3.
Wherry
EJ
.
T cell exhaustion.
.
Nat Immunol.
2011;
;
12
:
:492.
–
499
.
4.
Blank
CU
,
Haining
WN
,
Held
W
,
et al.
Defining “T cell exhaustion”.
.
Nat Rev Immunol.
2019;
;
19
:
:665.
–
674
.
5.
Hegde
PS
,
Chen
DS
.
Top 10 challenges in cancerimmunotherapy.
.
Immunity.
2020;
;
52
:
:17.
–
35
.
6.
Hensel
N
,
Gu
Z
, Sagar,
et al.
Memory-like HCV-specific CD8
+
T cells retain a molecular scar after cure of chronic HCV infection
.
.
Nat Immunol.
2021;
;
22
:
:229.
–
39
.
7.
Tonnerre
P
,
Wolski
D
,
Subudhi
S
,
et al.
Differentiation of exhausted CD8
+
T cells after termination of chronic antigen stimulation stops short of achieving functional T cell memory
.
.
Nat Immunol.
2021;
;
22
:
:1030.
–
41
.
8.
Yates
KB
,
Tonnerre
P
,
Martin
GE
,
et al.
Epigenetic scars of CD8
+
T cell exhaustion persist after cure of chronic infection in humans
.
.
Nat Immunol.
2021;
;
22
:
:1020.
–
9
.
9.
Abdel-Hakeem
MS
,
Manne
S
,
Beltra
J-C
,
et al.
Epigenetic scarring of exhausted T cells hinders memory differentiation upon eliminating chronic antigenic stimulation.
.
Nat Immunol.
2021;
;
22
:
:1008.
–
19
.
10.
Lauer
GM
.
Immune responses to hepatitis C virus (HCV) infection and the prospects for an effective HCV vaccine or immunotherapies.
.
J Infect Dis.
2013;
;
207
:
:S712.
.
11.
Carrat
F
,
Fontaine
H
,
Dorival
C
,
et al.
Clinical outcomes in patients with chronic hepatitis C after direct-acting antiviral treatment: a prospective cohort study.
.
Lancet.
2019;
;
393
:
:1453.
–
1464
.
|