| |
| Med Sci (Paris). 38(8-9): 637–639. doi: 10.1051/medsci/2022092.Récepteur nicotinique de l’acétylcholine et bronchopneumopathie chronique obstructive Valérian Dormoy,1* Stéphanie Pons,2 Philippe Gosset,3 and Uwe Maskos2** 1Université de Reims Champagne-Ardenne, Inserm, P3Cell UMR-S1250, SFR CAP-SANTE
,
Reims
,
France
.
2Institut Pasteur de Paris, Université Paris Cité, Neurobiologie intégrative des systèmes cholinergiques
,
CNRS UMR 3571
,
Paris
,
France
.
3Université de Lille, CNRS UMR8204, Inserm U1019, CHRU Lille, Institut Pasteur Lille, Centre d’infection et d’immunité de Lille
,
Lille
,
France
.
MeSH keywords: Membrane cellulaire, Humains, Broncho-pneumopathie chronique obstructive, Récepteurs nicotiniques, génétique |
La bronchopneumopathie chronique obstructive (BPCO) touche 5 à 10 % de la population adulte, et se place désormais sur le podium en termes de mortalité et de morbidité mondiales [
1
,
2
]. Cette maladie respiratoire, qui affecte environ 4 millions de personnes en France et est responsable de 18 000 décès par an, représente donc un problème majeur de santé publique.
La BPCO est caractérisée par l’existence d’un trouble ventilatoire obstructif, qui se traduit par une réduction progressive et irréversible du volume expiratoire maximal par seconde (VEMS) [
2
]. La maladie résulte, à long terme, de l’inhalation de substances nocives par le tabagisme, l’exposition professionnelle à des poussières ou certains produits chimiques, ou encore la pollution de l’air. Le tabagisme est de loin la cause principale de BPCO [
1
,
3
] : 80 % des patients européens souffrant de BPCO sont des fumeurs ou d’anciens fumeurs. Cependant, bien que les fumeurs présentent une diminution du VEMS plus rapide que les non-fumeurs, seuls 30 % des fumeurs vont développer une BPCO, ce qui suggère l’existence d’une susceptibilité individuelle non encore élucidée. La maladie peut d’ailleurs également survenir en l’absence de facteur causal évident [
4
]. La caractérisation d’une prédisposition génétique à la BPCO pourrait contribuer à la compréhension des mécanismes moléculaires impliqués dans la maladie, ainsi qu’à l’élaboration d’une stratégie préventive ou curative fondée sur le ou les facteurs de risque génétiques identifiés [
5
,
6
].
Des études pangénomiques d’association ont permis d’identifier des polymorphismes nucléotidiques associés à la BPCO, mais aussi à la dépendance à la nicotine et au cancer bronchique, et notamment le variant rs16969968 du gène
CHRNA5
(α5SNP) codant la sous-unité α5 des récepteurs nicotiniques de l’acétylcholine (nAChR). Ce variant est très fréquent dans la population générale puisqu’il est présent chez 15 % des personnes à l’état homozygote et chez 45 % à l’état hétérozygote.
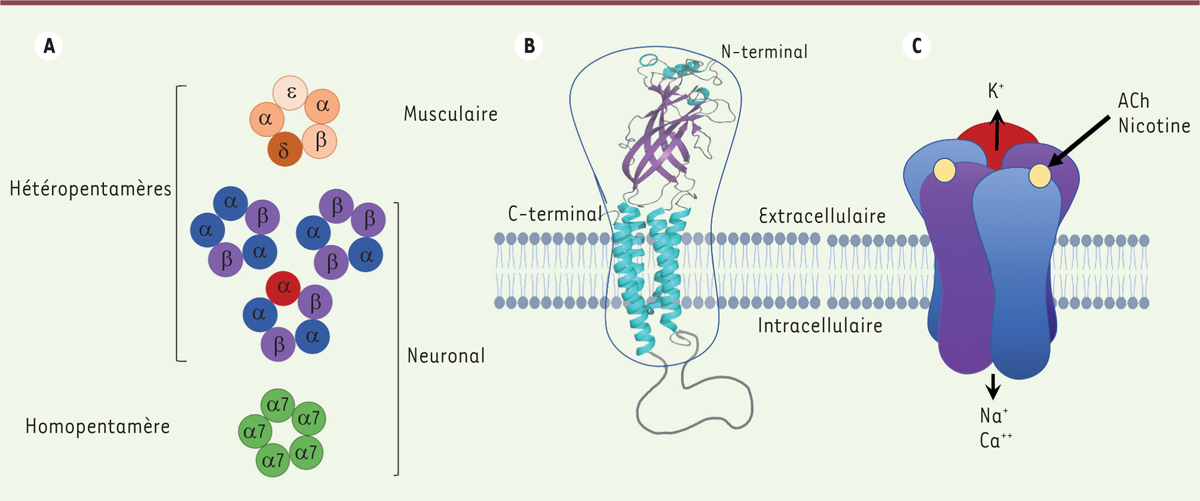
Les nAChR sont des protéines transmembranaires composées de 5 sous-unités organisées autour d’un pore central. Il existe 17 sous-unités (10 sous-unités α, 4 sous-unités β, et g, d et e) qui s’assemblent entre elles pour former des hétéropentamères α/β ou des homopentamères (α7). Ces récepteurs-canaux sont présents dans la plupart des cellules du corps humain. Ils sont activés par l’acétylcholine, leur ligand endogène, mais aussi par la nicotine chez les fumeurs. La fixation du ligand entraîne l’ouverture du canal cationique et un flux d’ions Na
+
et Ca
2+
du milieu extracellulaire vers le cytoplasme
(
Figure 1
)
. La dépolarisation membranaire qui en résulte entraîne par exemple la contraction de la cellule musculaire, ou la libération de neurotransmetteurs par les neurones du cerveau. Les récepteurs nicotiniques neuronaux sont notamment responsables de l’addiction au tabac, qui implique le circuit dopaminergique de la récompense [
7
]. Nous avions précédemment décrit l’expression des différentes sous-unités des récepteurs nicotiniques dans le poumon humain [
8
]. Par des approches complémentaires
in vitro
,
ex vivo
, et
in vivo
chez la souris, nous venons de mettre en évidence le rôle du variant α5SNP dans le développement de lésions pulmonaires similaires à celles observées chez les patients présentant une BPCO [
9
]. Nous avons d’abord analysé le remodelage épithélial et l’inflammation sur des prélèvements humains de polyposes permettant notamment l’isolement de cellules épithéliales respiratoires. Le variant α5SNP était associé à une hyperplasie de cellules sécrétrices de mucus et une augmentation du recrutement des cellules inflammatoires.
 | Figure 1.
Structure et assemblage des récepteurs nicotiniques de l’acétylcholine. A.
Représentation des différents assemblages de sous-unités nicotiniques.
B.
Représentation schématique d’une sous-unité de récepteur nicotinique avec ses quatre hélices intra-membranaires, son domaine extracellulaire N-terminal, son extrémité C-terminale et son long domaine intracellulaire.
C.
Modèle d’assemblage des pentamères avec les sites de liaison de ligands, comme l’acétylcholine (ACh) ou la nicotine, et l’ouverture du canal cationique après activation du récepteur par le ligand.
|
|
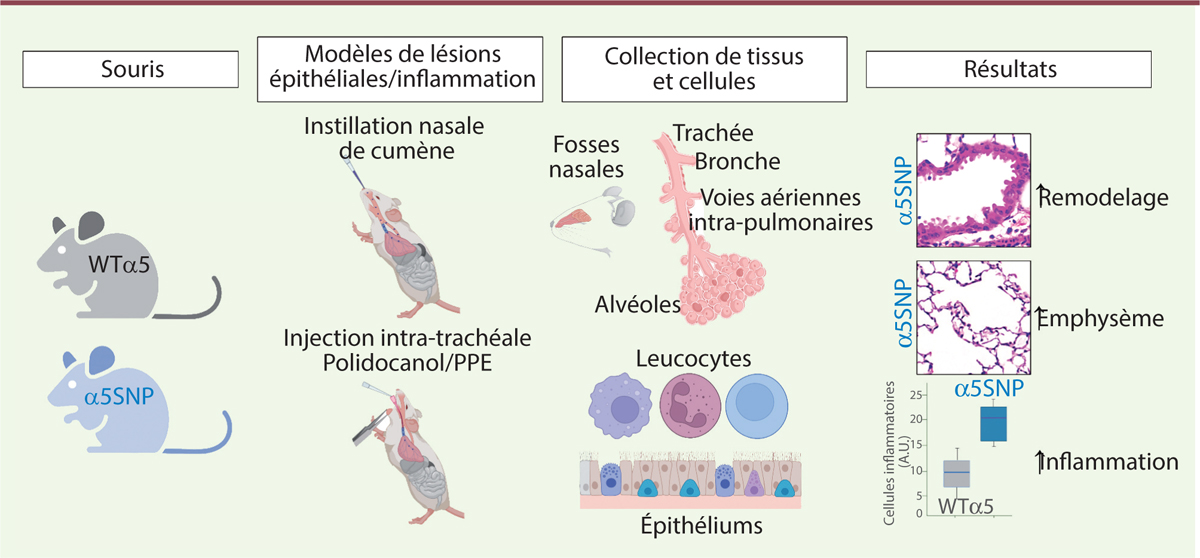
Des modèles murins pour mettre en évidence le phénotype pulmonaire induit par le variant génétique α5SNP
Nous avons créé une souris « humanisée » porteuse de la mutation α5SNP (souris α5SNP), par recombinaison homologue dans les cellules souches embryonnaires
(
Figure 2
)
, et avons découvert que l’épithélium des voies respiratoires de ces souris était spontanément remodelé, avec une hyperplasie des cellules caliciformes dans l’épithélium respiratoire nasal ainsi que dans les bronches extra-lobulaires. Cette augmentation du nombre de cellules productrices de mucus était accompagnée d’une diminution du nombre des cellules Club, connues pour leurs propriétés anti-inflammatoires, dans les voies respiratoires aussi bien proximales que distales.
 | Figure 2.
Schéma des approches expérimentales
(figure adaptée de [
9
] et créée avec BioRender).
|
Il convient par ailleurs de noter que les souris α5SNP âgées ont développé spontanément un emphysème, conséquence de la destruction progressive des alvéoles pulmonaires, alors qu’une augmentation significative du nombre des cellules inflammatoires, en particulier des macrophages, était apparue dès l’âge de 24 semaines. Nous avons rendu encore plus apparente la composante inflammatoire associée à ce modèle murin par une instillation intranasale de polidocanol pour induire des lésions locales des voies respiratoires suivies d’une inflammation et d’une cicatrisation, une condition similaire aux lésions initiales observées dans la BPCO humaine. Le recrutement de cellules inflammatoires était augmenté chez les souris α5SNP, comme en témoignait la présence des granulocytes éosinophiles, des granulocytes neutrophiles et des macrophages, absents chez les souris témoins. De plus, nous avons majoré expérimentalement la composante emphysémateuse par l’instillation intra-trachéale d’élastase pancréatique porcine, qui a entraîné une destruction alvéolaire plus rapide et plus importante chez les souris α5SNP comparativement aux souris témoins. Pour se rapprocher du contexte de développement de la BPCO et préciser le rôle du variant α5SNP dans les lésions pulmonaires, nous avons soumis des souris à un stress oxydant à l’aide d’hydroperoxyde de cumène. Nous avons alors observé une augmentation significative de l’emphysème et de l’inflammation chez les souris α5SNP par rapport aux souris témoins. Chez les souris α5SNP, l’augmentation de la hauteur de l’épithélium à la jonction bronchiolo-alvéolaire était corrélée à la sévérité de l’emphysème. Ces lésions étaient associées à des modifications des courbes pression-volume, témoignant d’une altération de la fonction respiratoire caractéristique de l’emphysème. |
Mécanismes moléculaires impliqués dans les effets cellulaires du variant α5SNP
Nous avons analysé les propriétés fonctionnelles des récepteurs nAChR contenant ce variant de la sous-unité α5, dans lequel l’acide aspartique (D) en position 398 est remplacé par une asparagine (N) (D398N chez l’homme, D397N chez la souris) : ce changement concerne un acide aminé situé dans un site hautement conservé de la boucle intracellulaire de la sous-unité. Les récepteurs contenant la sous-unité α5 présentent la perméabilité aux ions Ca
2+
la plus élevée parmi les nAChR hétéropentamériques. Or la concentration intracellulaire du Ca
2+
contrôle de nombreux processus tels que la plasticité, la croissance, la migration et la survie des cellules. Nous avons établi un système de culture de cellules épithéliales basales triées, et analysé leurs réponses à certains stimulus. Les cellules issues de souris α5SNP présentaient une diminution de l’entrée d’ions Ca
2+
lors de la stimulation du récepteur avec son agoniste endogène (acétylcholine) ou avec la nicotine. Par ailleurs, la vitesse de prolifération des cellules basales α5SNP était supérieure à celle des cellules témoins. De plus, cette prolifération était réduite en présence d’inhibiteurs de l’adénylate cyclase (AC) ou des protéines kinases A et C (PKA/C) ou RAF, qui sont des éléments clés des cascades de signalisation intra-cellulaire contrôlant la transcription des gènes impliqués dans la multiplication cellulaire.
Nous avons également cherché à comprendre les mécanismes responsables de la modulation de la prolifération cellulaire et de l’augmentation de la production de cytokines pro-inflammatoires
in vivo
. Nous avons mis en évidence le rôle crucial du TNF-α (
tumor necrosis factor
α) lors de la cicatrisation. Nous avons établi un modèle de lésion mécanique
in vitro
sur des cellules basales en culture. Lors de la migration des cellules dans la zone lésée, le nombre de transcrits codant le TNF-α n’était augmenté que dans les cellules α5SNP. De plus, l’augmentation était moindre en présence d’inhibiteurs de l’AC et de la PKC, suggérant que les mêmes voies de signalisation sont impliquées dans l’hyper-prolifération de ces cellules et dans leur sur-expression de cytokines inflammatoires. Seules quelques AC sont exprimées dans les cellules basales des voies respiratoires, AC3 étant la plus abondante et la seule à présenter une activité accrue lors d’une réduction de la concentration intracellulaire de Ca
2+
. Nos résultats suggèrent que AC3 est inhibée par la concentration intracellulaire élevée de Ca
2+
dans les cellules basales des souris témoins. Notons que AC3 était activée dans les cellules basales des souris α5SNP, dans lesquelles nous avons montré que l’influx de Ca
2+
était diminué. Par conséquent, nos résultats indiquent que l’activation de AC3 et l’augmentation de la concentration d’AMPc qui en découle pourraient orchestrer les voies de signalisation intracellulaires impliquées dans la production de TNF-α.
|
Cette étude apporte de nouveaux éléments contribuant à la physiopathologie moléculaire de la BPCO, en absence de la composante inflammatoire liée à l’exposition à la fumée de cigarette. L’étape suivante sera la mise en évidence expérimentale de l’implication du variant α5SNP dans le remodelage et l’inflammation pulmonaires sur des prélèvements d’épithélium bronchique de patients présentant une BPCO, et la caractérisation de l’altération potentielle de la réponse pulmonaire suite à une exposition chronique à la fumée de cigarette dans les modèles murins que nous utilisons. L’enjeu biomédical est de tester des modulateurs des récepteurs nicotiniques de l’acétylcholine pour tenter d’atténuer les symptômes respiratoires de la BPCO, et de parvenir à une prise en charge personnalisée des individus souffrant de cette maladie, selon leur génotype. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Naghavi
M
,
Abajobir
AA
,
Abbafati
C
,
et al.
Global, regional, and national age-sex specific mortality for 264 causes of death, 1980–2016: a systematic analysis for the Global Burden of Disease Study 2016.
.
Lancet.
2017;
;
390
:
:1151.
–
1210
.
2.
Rabe
KF
,
Watz
H
.
Chronic obstructive pulmonary disease.
.
Lancet.
2017;
;
389
:
:1931.
–
1940
.
3.
Stockley
RA
,
Mannino
D
,
Barnes
PJ
.
Burden and pathogenesis of chronic obstructive pulmonary disease.
.
Proc Am Thorac Soc.
2009;
;
6
:
:524.
–
526
.
4.
Behrendt
CE
.
Mild and moderate-to-severe COPD in nonsmokers.
.
Chest.
2005;
;
128
:
:1239.
–
1244
.
5.
Soler Artigas
M
,
Wain
LV
,
Repapi
E
,
et al.
Effect of five genetic variants associated with lung function on the risk of chronic obstructive lung disease, and their joint effects on lung function.
.
Am J Respir Crit Care Med.
2011;
;
184
:
:786.
–
95
.
6.
Castaldi
PJ
,
Cho
MH
,
Litonjua
AA
,
et al.
The association of genome-wide significant spirometric loci with chronic obstructive pulmonary disease susceptibility.
.
Am J Respir Cell Mol Biol.
2011;
;
45
:
:1147.
–
1153
.
7.
Icick
R
,
Forget
B
,
Cloëz-Tayarani
I
,
et al.
Genetic susceptibility to nicotine addiction: Advances and shortcomings in our understanding of the CHRNA5/A3/B4 gene cluster contribution.
.
Neuropharmacology.
2020;
;
177
:
:108234.
.
8.
Diabasana
Z
,
Perotin
J-M
,
Belgacemi
R
,
et al.
Nicotinic receptor subunits atlas in the adult human lung.
.
Int J Mol Sci.
2020;
;
21
:
:7446.
.
9.
Routhier
J
,
Pons
S
,
Freidja
ML
,
et al.
An innate contribution of human nicotinic receptor polymorphisms to COPD-like lesions.
.
Nat Commun.
2021;
;
12
:
:6384.
.
|