| |
| Med Sci (Paris). 38(8-9): 634–636. doi: 10.1051/medsci/2022091.
Les canaux calciques Ca
v
1.4 dans la physiopathologie du psoriasis
Une nouvelle cible thérapeutique Lucette Pelletier1 and Magali Savignac1* 1Institut toulousain des maladies infectieuses et inflammatoires (Infinity), Inserm UMR1291, CNRS UMR5051, université Paul Sabatier Toulouse III
,
Toulouse
,
France MeSH keywords: Canaux calciques de type L, Canaux calciques de type T, Humains, Psoriasis, traitement médicamenteux |
Le psoriasis est une maladie inflammatoire chronique de la peau, à forte charge émotionnelle, et qui affecte 2 à 3 % de la population mondiale. Elle est fréquemment associée à des comorbidités, comme l’arthrite ou les maladies cardio-métaboliques. Les lésions cutanées se présentent sous la forme de plaques érythémato-squameuses. Elles sont caractérisées par une hyper-prolifération des kératinocytes, une desquamation accélérée et désordonnée et une infiltration de cellules inflammatoires [
1
]. Le psoriasis résulte du dialogue anormal entre les cellules de l’immunité innée et celles de l’immunité adaptative, dans lequel les lymphocytes Th17 jouent un rôle important. L’expression du facteur de transcription RORgt définit le lignage de ces lymphocytes, qui produisent des interleukines (IL) inflammatoires, dont l’IL-17. Il a été proposé que la mort cellulaire et la libération de l’ADN et de produits anti-microbiens, tels que la cathélicidine LL37, dans la peau lésée de patients psoriasiques activent localement les cellules dendritiques plasmacytoïdes ou les kératinocytes, entraînant la production d’interféron (IFN) de type I et la maturation des cellules dendritiques. Les cellules dendritiques activées migrent vers les ganglions lymphatiques drainant le territoire cutané correspondant, où elles induisent,
via
la sécrétion d’IL-12 et surtout d’IL-23, la différenciation de lymphocytes T CD4
+
auto-réactifs en lymphocytes Th17 producteurs d’IL-17, d’IL-22, d’interféron gamma (IFN-g) et de facteur de nécrose tumorale α (TNF-α) [
1
]. Les lymphocytes Th17 sont alors recrutés dans la peau, et produisent les cytokines inflammatoires qui induisent la prolifération des kératinocytes, favorisant une boucle de rétroaction positive entre les cellules épithéliales et immunitaires, ce qui entretient l’inflammation [
1
]. Cibler chacune de ces cytokines (TNF-α, IL-23, IL-17), qui sont des acteurs clés de la pathogenèse du psoriasis [
2
], avec des anticorps neutralisants a un effet protecteur contre le psoriasis [
3
-
5
]. Cependant, ces traitements présentent des inconvénients en termes de coût, de voie d’administration et d’effets indésirables potentiels. D’où l’intérêt de développer de nouvelles thérapies visant à réduire la production de l’ensemble de ces cytokines dans le psoriasis.
En décryptant les singularités de la signalisation dépendante du calcium qui contrôle la production des cytokines après engagement du récepteur des lymphocytes T, nous avons mis en évidence l’expression sélective des membres de la famille des canaux calciques Ca
v
1 dans différentes populations de lymphocytes T [
6
-
8
] (
→
).
(→) Voir le Repères de V. Robert
et al
.,
m/s
n° 8-9, août-septembre 2012, page 773
Ces canaux sont composés d’une sous-unité α1 formant le pore (quatre gènes,
CACNA1S
,
CACNA1C
,
CACNA1D
et
CACNA1F,
codent respectivement la sous-unité α1 des canaux Ca
v
1.1 à Ca
v
1.4), et de sous-unités auxiliaires β et α2-δ (chacune codée par quatre gènes) [
9
]. Ca
v
1.4 est le seul de ces canaux à être exprimé dans les lymphocytes Th17 du sang. Il est présent dans les lymphocytes T CD4
+
naïfs, et disparaît lors de l’activation et de la différenciation des lymphocytes T humains effecteurs, sauf dans les lymphocytes Th17 [
7
]. Nous avons mis en évidence la présence des canaux Ca
v
1.4 dans la membrane plasmique des lymphocytes T infiltrant la peau lésée des patients atteints de psoriasis, et avons démontré leur rôle dans la production locale de cytokines [
10
].
|
Le canal Cav1.4 est impliqué dans la production des cytokines inflammatoires par les lymphocytes T infiltrant la peau lésée psoriasique
Nous avons montré que l’expression du gène codant le canal calcique Ca
v
1.4 (
CACNA1F
) est augmentée dans la peau lésée d’individus présentant un psorasis par rapport à la peau non lésée ou à celle d’individus atteints de dermatite atopique. L’expression de
CACNA1F
est corrélée avec celle des gènes codant les cytokines IL-17A, IFN-g et IL-26, qui est augmentée dans les peaux psoriasiques. Nous avons détecté l’ARN messager de
CACNA1F
et la protéine Ca
v
1.4 dans les lymphocytes T présents dans les biopsies de peaux psoriasiques [
10
].
Après purification des lymphocytes T résidents, nous avons montré que le canal Ca
v
1.4 contrôle la production des cytokines. En effet, l’ajout de nicardipine, un inhibiteur des canaux calciques Ca
v
1, réduit la production des cytokines (IL-17A et F, IL-22, IFN-g, TNF-α et CSF2) induite par l’engagement du récepteur des lymphocytes T. Nous avons ensuite confirmé le rôle de Ca
v
1.4 dans la production d’IL-17A et d’IL-22 en inhibant partiellement son expression à l’aide d’ARN en épingle à cheveux (
short hairpin RNA
, shRNA) spécifiques, ce qui a entraîné une réduction de la production de ces interleukines par les lymphocytes T après engagement de leur récepteur [
10
]. Les canaux Ca
v
1 contribuent à la production optimale des cytokines dans les lymphocytes Th17 activés en contrôlant des voies de signalisation impliquées dans la transcription des gènes de toutes ces cytokines inflammatoires, dont la voie de signalisation calcique. En effet, la nicardipine réduit fortement l’augmentation de la concentration intracellulaire d’ions calcium ([Ca
2+
]
i
) induite par la stimulation du récepteur des lymphocytes T (TCR). Nous avons enregistré les évènements calciques élémentaires - probablement dus à l’activation d’un canal calcique ou d’un groupe de canaux calciques de la membrane plasmique - par la technique d’imagerie par microscopie à fluorescence à réflexion interne totale (TIRFM), qui permet de détecter les changements rapides de [Ca
2+
]
i
au voisinage de la membrane plasmique. Au repos, les lymphocytes Th17 montrent peu d’évènements calciques élémentaires, mais leur nombre augmente très rapidement (entre 2 et 10 secondes) après leur stimulation par activation du TCR. L’ajout de nicardipine, non seulement diminue le nombre d’évènements calciques élémentaires spontanés dans les lymphocytes Th17 au repos, mais aussi s’oppose à leur augmentation lorsque ces cellules sont stimulées [
10
]. Ainsi, la présence de canaux Ca
v
1 permet un influx précoce de Ca
2+
dans les lymphocytes Th17 après engagement du TCR, avant même l’augmentation de [Ca
2+
]
i
.
Cet influx de calcium dépendant des canaux Ca
v
1, qui se produit dans les lymphocytes Th17 quelques secondes seulement après l’engagement du TCR, est important pour que ces lymphocytes soient fortement activés : l’inhibition de ce flux par la nicardipine diminue l’engagement des voies de transduction du signal d’activation en aval du récepteur
(
Figure 1A
)
. Il est concevable que les évènements calciques élémentaires impliquant le canal Ca
v
1.4 modifient localement l’environnement cellulaire à proximité de la synapse immunitaire
1
, peut-être par un réarrangement du cytosquelette permettant l’assemblage optimal des protéines impliquées dans la transduction du signal induit par l’activation du TCR.
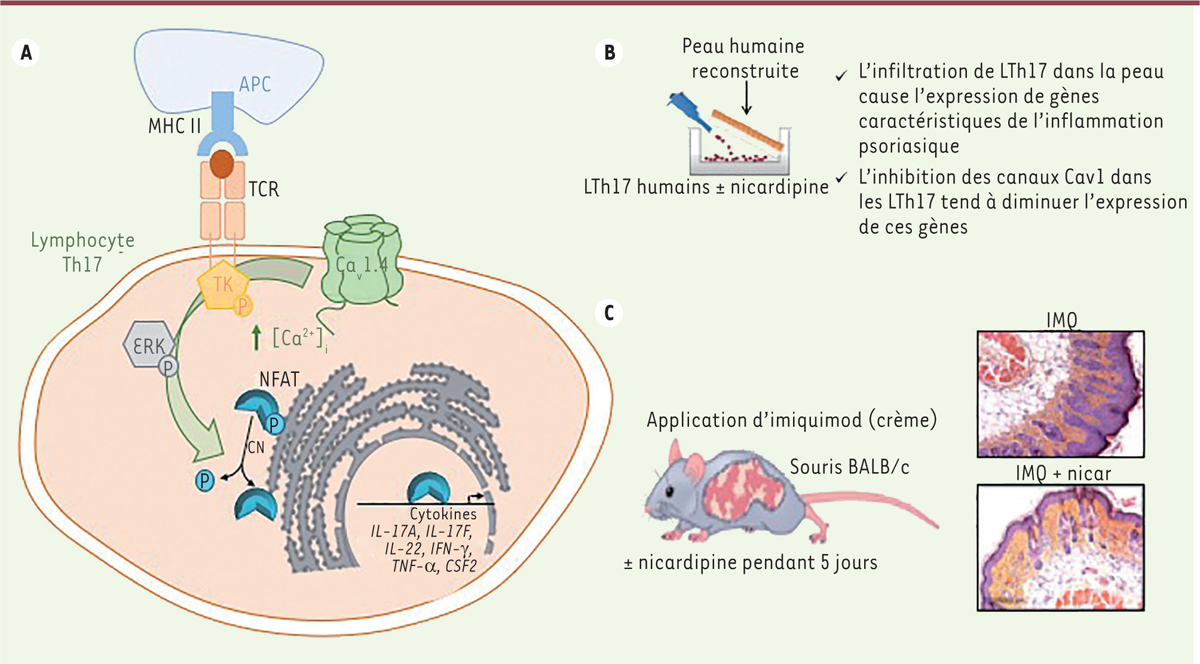
 | Figure 1.
Psoriasis et canaux calciques Cav1.4 des lymphocytes Th17. A.
Les lymphocytes Th17 (LTh17) du sang, ainsi que les LT qui infiltrent la peau lésée de patients présentant un psoriasis, expriment les canaux calciques Ca
v
1.4. L’influx d’ions calcium à travers ces canaux, qui se produit quelques secondes après l’engagement du récepteur des lymphocytes T (
T cell receptor
, TCR) au contact d’une cellule présentatrice d’antigène (
antigen-presenting cell
, APC) a des répercussions sur les voies de signalisation en aval du TCR. En effet, la phosphorylation, induite par le TCR, des tyrosine kinases (TK) et des MAP kinases comme ERK2, est diminuée par la nicardipine, un inhibiteur des canaux calciques Ca
v
1. La translocation nucléaire du facteur de transcription NFATc2 (
nuclear factor of activated T-cells
), qui résulte d’une augmentation de la concentration cytoplasmique des ions calcium ([Ca
2+
]
i
), est, elle aussi, inhibée par la nicardipine. Ces résultats suggèrent que les canaux Ca
v
1 contrôlent une entrée précoce d’ions Ca
2+
dans la cellule, qui est essentielle pour l’activation complète des LTh17 après engagement du TCR et pour la production des cytokines inflammatoires.
B..
L’inhibition des canaux calciques dans les LTh17 diminue l’expression de gènes caractéristiques de l’inflammation psoriasique dans un modèle de peau reconstruite.
C.
L’administration de nicardipine (nicar) diminue l’inflammation induite par l’application cutanée d’imiquimod (IMQ) chez des souris BALB/c. MHC : complexe majeur d’histocompatibilité.
|
|
Ciblage thérapeutique du canal Cav1.4 dans des modèles de psoriasis
Nous avons établi un modèle de reconstruction de peau en trois dimensions, dans lequel l’infiltration de lymphocytes Th17 humains activés induit l’expression des marqueurs inflammatoires du psoriasis par les kératinocytes. L’ajout de nicardipine, qui inhibe les canaux Ca
v
1, dans le milieu de culture des lymphocytes Th17, avant leur transfert sous les peaux reconstruites, n’empêche pas les lymphocytes de migrer dans ces peaux et ne modifie pas l’aspect de l’épiderme, mais il réduit la sécrétion d’IL-17A et d’IL-22 dans le milieu de culture. De plus, il diminue l’expression des gènes associés au psoriasis (
KRT16
,
PI3
et
DEFB4
, codant respectivement la cytokératine 16, l’élafine et la β-défensine 2) induite par l’infiltration des lymphocytes Th17, comme le fait l’ajout de cyclosporine A, un immunosuppresseur
(
Figure 1B
)
.
Nous avons confirmé le rôle des canaux calciques Ca
v
1 dans un modèle murin de psoriasis induit par l’imiquimod, un ligand de TLR7/8 (
Toll-like receptor 7/8
) et un puissant activateur immunitaire. L’application topique d’imiquimod provoque, chez la souris, une inflammation dermique qui rappelle le psoriasis. L’administration de nicardipine aux souris réduit considérablement l’inflammation et l’épaississement de la peau dans ce modèle
(
Figure 1C
)
.
Ce résultat ouvre une nouvelle perspective thérapeutique contre le psoriasis : le développement de médicaments inhibant les canaux calciques Ca
v
1.4. L’inhibition des canaux Ca
v
1 par la nicardipine n’a certes qu’un effet suppresseur partiel sur la production des cytokines par les lymphocytes Th17, mais cet effet concerne toutes les cytokines testées qui agissent en synergie en créant une boucle d’amplification de la réponse inflammatoire dans le psoriasis [
11
].
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été financé par des subventions de l’Inserm et des Laboratoires Pierre Fabre.
|
Footnotes |
1.
Armstrong
AW
,
Read
C
.
Pathophysiology, clinical presentation, and treatment of psoriasis: A review.
.
Jama.
2020;
;
323
:
:1945.
–
60
.
2.
Nash
P
.
Inhibition of interleukins 17A and 17F in psoriatic arthritis.
.
Lancet.
2020;
;
395
:
:395.
–
6
.
3.
Reich
K
,
Papp
KA
,
Blauvelt
A
,
et al.
Bimekizumab versus ustekinumab for the treatment of moderate to severe plaque psoriasis (BE VIVID): efficacy and safety from a 52-week, multicentre, double-blind, active comparator and placebo controlled phase 3 trial.
.
Lancet.
2021;
;
397
:
:487.
–
98
.
4.
Girolomoni
G
,
Strohal
R
,
Puig
L
,
et al.
The role of IL-23 and the IL-23/T
H
17 immune axis in the pathogenesis and treatment of psoriasis
.
.
J Eur Acad Dermatol Venereol.
2017;
;
31
:
:1616.
–
1626
.
5.
Krueger
JG
,
Fretzin
S
,
Suárez-Fariñas
M
,
et al.
IL-17A is essential for cell activation and inflammatory gene circuits in subjects with psoriasis.
.
J Allergy Clin Immunol.
2012;
;
130
:
:145.
–
54.e9
.
6.
Giang
N
,
Mars
M
,
Moreau
M
,
et al.
Separation of the Ca
V
1.2-Ca
V
1.3 calcium channel duo prevents type 2 allergic airway inflammation
.
.
Allergy.
2022;
;
77
:
:525.
–
39
.
7.
Robert
V
,
Triffaux
E
,
Paulet
PE
,
et al.
Protein kinase C-dependent activation of Ca
V
1.2 channels selectively controls human TH2-lymphocyte functions
.
.
J Allergy Clin Immunol.
2014;
;
133
:
:1175.
–
1183
.
8.
Robert
V
,
Triffaux
E
,
Savignac
M
,
Pelletier
L
.
La signalisation calcique dans les lymphocytes T.
.
Med Sci (Paris).
2012;
;
28
:
:773.
–
779
.
9.
Catterall
WA
.
Structure and regulation of voltage-gated Ca
2+
channels
.
.
Annu Rev Cell Dev Biol.
2000;
;
16
:
:521.
–
555
.
10.
Mars
M
,
Neant
I
,
Leclerc
C
, et al.
Ca
v
1.4 calcium channels control cytokine production by human peripheral T
H
17 cells and psoriatic skin-infiltrating T cells
.
.
J Allergy Clin Immunol.
2022;
;
149
:
:1348.
–
57
.
11.
Menter
A
,
Gelfand
JM
,
Connor
C
,
et al.
Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management of psoriasis with systemic nonbiologic therapies.
.
J Am Acad Dermatol.
2020;
;
82
:
:1445.
–
86
.
|