| |
| Med Sci (Paris). 38(8-9): 631–634. doi: 10.1051/medsci/2022090.
Les vaisseaux HEV et l’entrée des lymphocytes dans les tumeurs pendant l’immunothérapie
*
Lucas Blanchard1 and Jean-Philippe Girard1** 1Institut de pharmacologie et de biologie structurale, IPBS, université de Toulouse, CNRS, UPS
,
Toulouse
,
France MeSH keywords: Humains, Immunothérapie, Noeuds lymphatiques, Lymphocytes, Tumeurs, effets indésirables, thérapie |
L’immunothérapie anti-cancéreuse fondée sur l’usage d’anticorps bloquant les points de contrôle immunitaire CTLA-4 (
cytotoxic T-lymphocyte-associated protein 4
) et PD-1 (
programmed cell death protein 1
) a révolutionné la prise en charge du cancer par ses résultats spectaculaires chez certains patients [
1
] (
→
).
(→) Voir la Synthèse de M. Duois
et al
., m/s n° 12, décembe 2019, page 937
Elle a aussi considérablement changé notre vision du traitement du cancer puisqu’elle n’agit pas directement sur les cellules cancéreuses, mais sur les lymphocytes, des cellules immunitaires capables de reconnaître et d’éliminer les cellules cancéreuses. Cependant, ces traitements ne sont efficaces que chez une partie des patients, et leur efficacité varie selon les types de cancer. Mieux comprendre comment ils agissent, et d’une manière plus générale, mieux définir les mécanismes de l’immunité anti-tumorale, pourrait permettre à plus de patients de bénéficier de ces traitements remarquables.
La migration des lymphocytes vers la tumeur est une étape essentielle de la réponse immunitaire anti-tumorale car elle permet aux lymphocytes activés en périphérie d’entrer en contact avec les cellules cancéreuses et de les éliminer. Cependant, le processus de recrutement des lymphocytes du sang vers la tumeur est mal connu, et les vaisseaux tumoraux impliqués ne sont pas encore identifiés. Le mécanisme de recrutement le mieux défini à ce jour reste celui des lymphocytes naïfs à travers la paroi des vaisseaux HEV (
high endothelial venule
) des ganglions lymphatiques [
2
]. Les vaisseaux HEV sont des vaisseaux sanguins spécialisés dans le recrutement des lymphocytes, et dont la paroi est tapissée de cellules endothéliales hautement différenciées. Ces cellules ont une morphologie particulière, dite cuboïdale, et produisent en grande quantité des enzymes dédiées à la synthèse des molécules responsables de la capture des lymphocytes circulant dans le sang [
3
], parmi lesquelles des glycoprotéines sulfatées reconnues par la sélectine-L (CD62L) des lymphocytes et par l’anticorps MECA-79, un marqueur spécifique des vaisseaux HEV.
En condition physiologique, les vaisseaux HEV sont présents uniquement dans les ganglions lymphatiques et les autres organes lymphoïdes secondaires. Cependant, des vaisseaux sanguins disposant de caractéristiques similaires à celles des vaisseaux HEV et reconnus par l’anticorps MECA-79 peuvent être induits dans les tissus non lymphoïdes lors d’inflammations chroniques ou de cancers. Il y a une dizaine d’années, nous avons ainsi découvert que la présence de vaisseaux HEV dans la tumeur est associée à son infiltration par des lymphocytes et à des paramètres cliniques favorables chez les patients atteints de cancer du sein ou de mélanome [
4
,
5
]. Récemment, nous avons montré que les vaisseaux HEV des tumeurs constituent les portes d’entrée majeures des lymphocytes au cours de l’immunité anti-tumorale spontanée et de l’immunothérapie anti-cancéreuse [
6
]. Nous présentons ici les résultats de plus de dix ans de travaux de recherche qui ont permis de lever le voile sur les mécanismes contrôlant l’entrée des lymphocytes dans les tumeurs.
|
L’impact bénéfique des vaisseaux HEV des tumeurs
En cancérologie, les vaisseaux sanguins tumoraux sont globalement associés à un mauvais pronostic car ils favorisent la croissance de la tumeur. La découverte de vaisseaux sanguins présentant des caractéristiques similaires aux vaisseaux HEV a permis d’introduire l’idée que certains vaisseaux tumoraux ont en réalité un effet bénéfique en participant à l’immunité anti-tumorale [
4
]. Chez l’homme, les vaisseaux HEV de tumeurs sont systématiquement associés à des amas de lymphocytes. Deux grandes études rétrospectives réalisées sur des patients atteints de cancer du sein et de mélanome ont révélé que la densité en vaisseaux HEV des tumeurs est effectivement corrélée avec la densité intra-tumorale de lymphocytes T et de lymphocytes B [
4
,
5
]. En accord avec l’impact positif de la présence des lymphocytes dans les tumeurs, la forte densité en vaisseaux HEV est aussi associée à une meilleure survie globale des patientes atteintes d’un cancer du sein [
4
]. Depuis, plusieurs études ont confirmé ces résultats dans une grande variété de cancers [
7
].
Ainsi, ces premières découvertes ont fourni la preuve que les vaisseaux HEV de tumeurs ont un impact bénéfique sur l’immunité anti-tumorale, et ont suggéré que ces vaisseaux sanguins spécialisés pourraient servir de portes d’entrée pour les lymphocytes à l’intérieur des tumeurs. |
Le rôle des vaisseaux HEV des tumeurs dans l’immunité anti-tumorale et l’immunothérapie anti-cancéreuse
Si les études chez l’homme ont apporté des premiers éléments sur le rôle des vaisseaux HEV dans les tumeurs, le recours à des modèles animaux est resté indispensable pour définir leur fonction et caractériser leur identité moléculaire. C’est pourquoi nous avons étudié des modèles de tumeur murine dans lesquels des vaisseaux HEV se développent. Dans un premier temps, nous avons isolé les cellules endothéliales tapissant les vaisseaux HEV de tumeurs afin d’analyser leur transcriptome et de le comparer à celui des cellules endothéliales des vaisseaux HEV de ganglions lymphatiques [
6
,
8
]. Ces expériences nous ont appris que les vaisseaux HEV des tumeurs sont immatures par comparaison aux vaisseaux HEV des ganglions, mais qu’ils sont en revanche bien plus enflammés. En particulier, ils expriment fortement la P-sélectine (CD62P) qui est requise pour le recrutement des lymphocytes activés dans les tissus en cours d’inflammation [
9
]. En réalisant des transferts adoptifs de lymphocytes, nous avons déterminé que les vaisseaux HEV de tumeurs sont non seulement associés au recrutement de lymphocytes naïfs, mais aussi à celui de lymphocytes activés, alors que les vaisseaux HEV de ganglions sont associés uniquement au recrutement de lymphocytes naïfs [
6
].
Nous nous sommes ensuite interrogés sur le rôle des vaisseaux HEV des tumeurs au cours de l’immunothérapie anti-cancéreuse avec des anticorps bloquant CTLA-4 et PD-1 (
immune checkpoint blockade
, ICB). Dans trois modèles de tumeur différents, nous avons constaté que l’effet anti-tumoral de l’ICB est associé à une augmentation de la proportion des vaisseaux HEV dans les tumeurs [
6
]. Grâce à un dispositif de microscopie intravitale, nous sommes parvenus à visualiser directement le recrutement de lymphocytes à travers les vaisseaux HEV
(
Figure 1
)
et à analyser la contribution de ces vaisseaux particuliers par rapport aux autres vaisseaux de la tumeur. Le résultat est sans appel : les vaisseaux HEV constituent les sites d’entrée quasi exclusifs des lymphocytes dans l’arbre vasculaire tumoral [
6
]. Ces résultats d’imagerie intravitale ont été obtenus non seulement en utilisant des tumeurs traitées par ICB, mais aussi en utilisant des tumeurs non traitées, démontrant le rôle essentiel des vaisseaux HEV des tumeurs pour le recrutement des lymphocytes, même en dehors de toute immunothérapie.
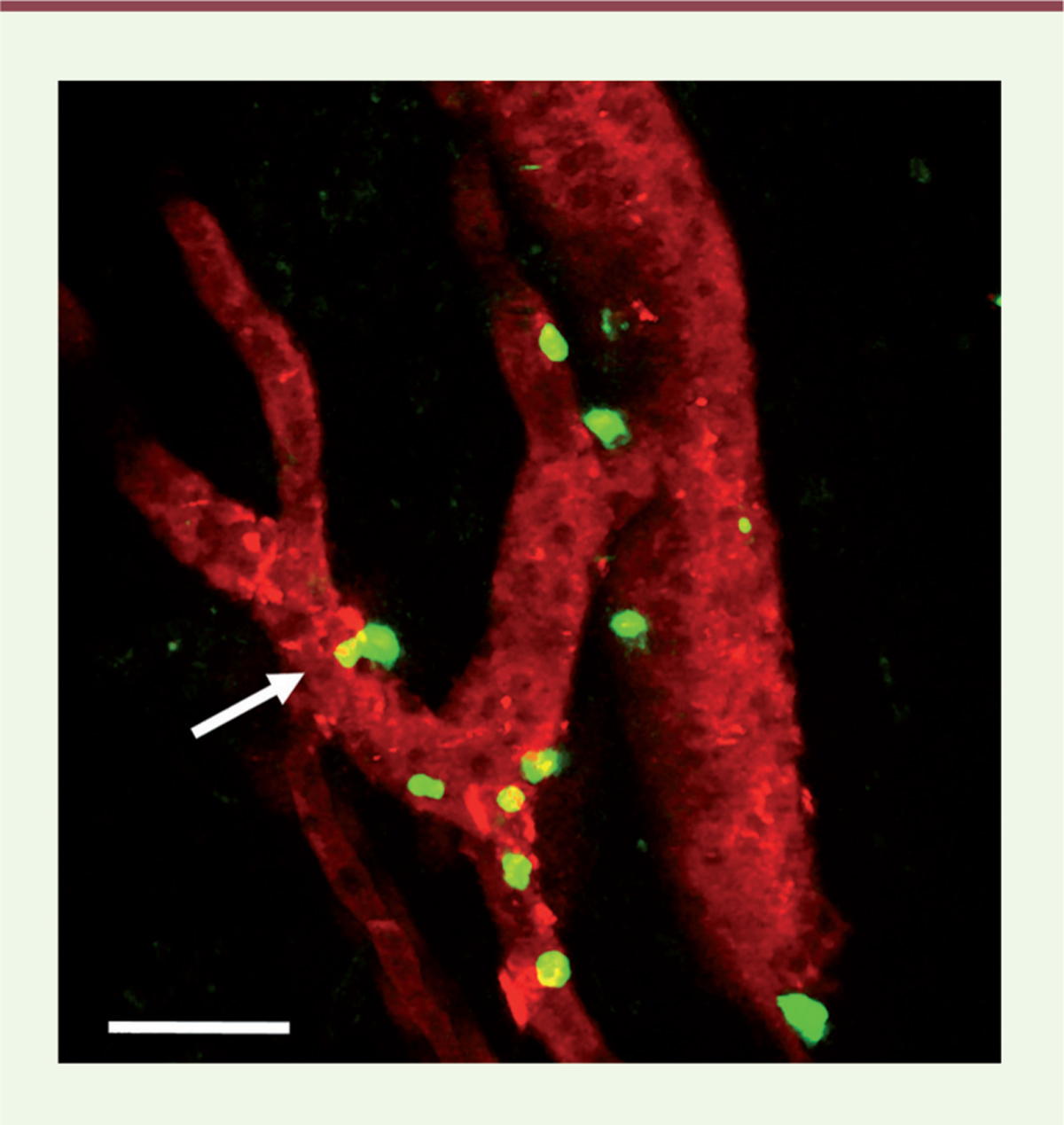
 | Figure 1.
Transmigration d’un lymphocyte à travers un vaisseau HEV (high endothelial venule) de tumeur.
Visualisation, en microscopie biphotonique, de lymphocytes (en vert) en train de transmigrer à travers un vaisseau HEV de tumeur (en rouge) au cours de l’immunothérapie anti-cancéreuse. La flèche blanche indique un lymphocyte qui quitte la circulation sanguine pour entrer dans la tumeur (en noir). Image adaptée de [
6
]. Barre d’échelle : 50 mm.
|
En définitive, les études fonctionnelles réalisées chez la souris nous ont permis d’établir le rôle des vaisseaux HEV de tumeurs dans l’immunité anti-tumorale spontanée et au cours de l’immunothérapie anti-cancéreuse
(
Figure 2
)
. Elles ont aussi renforcé les perspectives thérapeutiques sur la modulation des vaisseaux HEV de tumeurs.
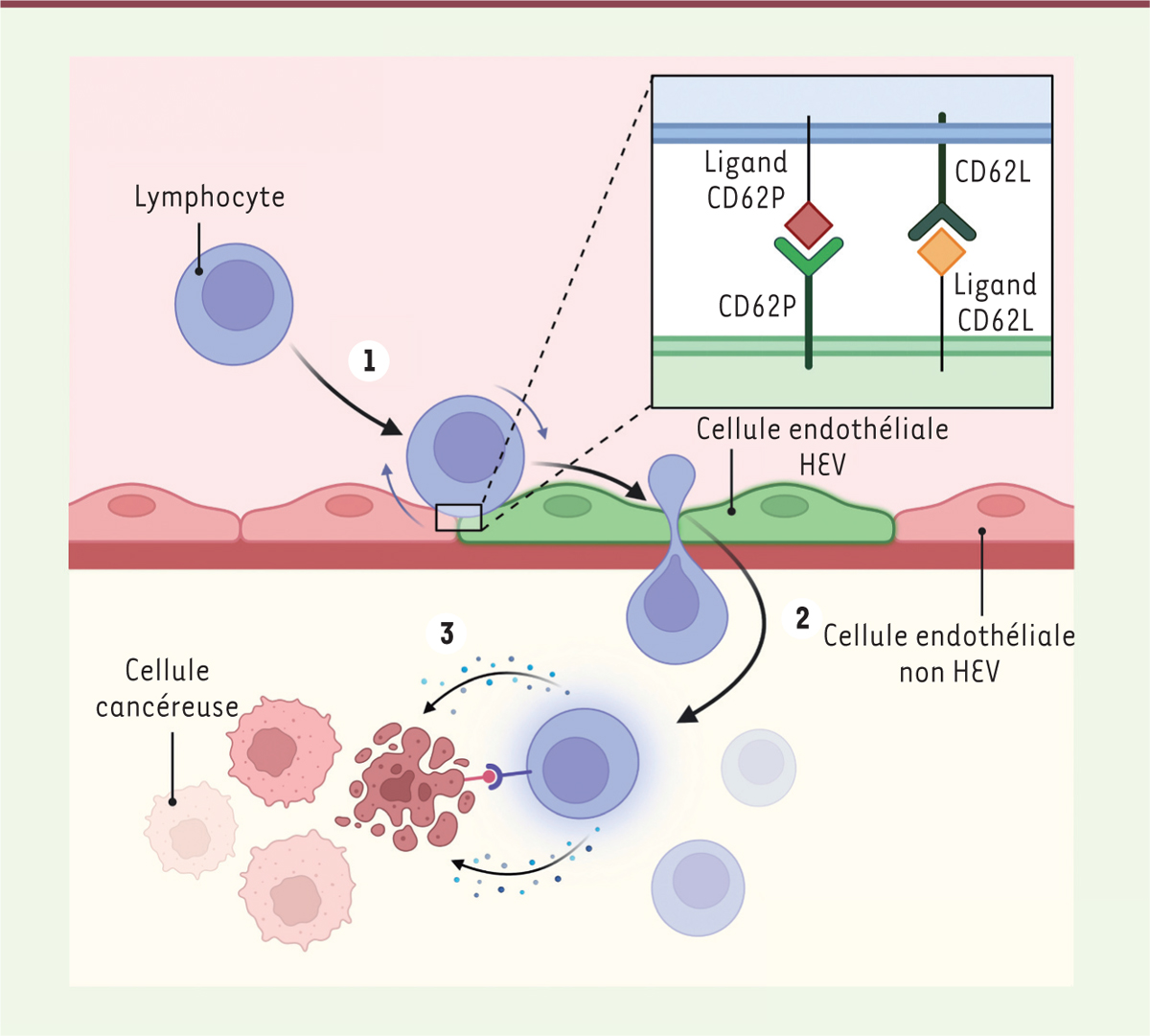
 | Figure 2.
Recrutement des lymphocytes dans les tumeurs. 1.
En condition normale ou au cours de l’immunothérapie anti-cancéreuse, les lymphocytes circulant dans le sang interagissent préférentiellement avec les cellules endothéliales qui tapissent la paroi des vaisseaux HEV de tumeurs. Cette interaction est dépendante de la P-sélectine (CD62P) et des ligands de la sélectine-L (CD62L ; ces ligands sont également reconnus par l’anticorps spécifique MECA-79) qui sont présents à la surface de ces cellules endothéliales.
2.
Après une phase de roulement sur les cellules endothéliales, les lymphocytes finissent par adhérer fermement à l’endothélium des vaisseaux HEV et par transmigrer entre les cellules endothéliales.
3.
Une fois à l’intérieur de la tumeur, les lymphocytes entrent en contact avec les cellules tumorales et les éliminent, directement par cytolyse ou par la sécrétion de cytokines (image créée avec BioRender.com).
|
|
L’exploitation des vaisseaux HEV des tumeurs pour l’immunothérapie anti-cancéreuse
Malgré des résultats remarquables chez certains patients, l’immunothérapie anti-cancéreuse n’est pas efficace chez la totalité d’entre eux et peut aussi avoir des effets toxiques graves [
1
]. Développer de nouvelles stratégies pour améliorer l’efficacité de ces traitements et identifier des biomarqueurs prédictifs de la réponse constituent des enjeux oncologiques majeurs. Puisque les vaisseaux HEV des tumeurs sont impliqués dans la réponse à l’immunothérapie anti-cancéreuse, nous nous sommes demandés si leur modulation pouvait améliorer l’efficacité de l’ICB. Pour cela, nous avons testé l’effet d’un anticorps activant le récepteur LTβR (
lymphotoxin
β
receptor
), un récepteur impliqué dans le développement et la maturation des vaisseaux HEV des ganglions lymphatiques [
3
]. Comme nous l’avions espéré, ce traitement a augmenté la quantité et la maturation des vaisseaux HEV dans les tumeurs, et cela a été associé à un meilleur effet anti-tumoral de l’ICB [
6
]. Enfin, nous avons testé la valeur prédictive de la présence de vaisseaux HEV dans les tumeurs sur un groupe de patients présentant un mélanome métastatique et traités avec des anticorps bloquant CTLA-4 et PD-1. Cette analyse a révélé que les patients dont les lésions tumorales sont enrichies en vaisseaux HEV ont une meilleure réponse à l’immunothérapie et une meilleure survie globale [
6
].
|
Ainsi, nous avons identifié un acteur essentiel du recrutement des lymphocytes dans les tumeurs lors des réponses immunitaires anti-tumorales : les vaisseaux HEV des tumeurs. De plus, nous apportons des informations inédites sur les caractéristiques moléculaires et fonctionnelles de ces vaisseaux particuliers. Nos résultats suggèrent que la modulation thérapeutique des vaisseaux HEV des tumeurs pourrait améliorer l’efficacité des immunothérapies anti-cancéreuses. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Dubois
M
,
Ardin
C
,
André
F
,
et al.
L’immunothérapie, une révolution en oncologie : revue de l’efficacité des inhibiteurs de points de contrôle immunitaire.
.
Med Sci (Paris).
2019;
;
35
:
:937.
–
945
.
2.
Girard
JP
,
Moussion
C
,
Forster
R
.
HEVs, lymphatics and homeostatic immune cell trafficking in lymph nodes.
.
Nat Rev Immunol.
2012;
;
12
:
:762.
–
773
.
3.
Moussion
C
,
Girard
JP
.
Dendritic cells control lymphocyte entry to lymph nodes through high endothelial venules.
.
Nature.
2011;
;
479
:
:542.
–
546
.
4.
Martinet
L
,
Garrido
I
,
Filleron
T
,
et al.
Human solid tumors contain high endothelial venules: association with T- and B-lymphocyte infiltration and favorable prognosis in breast cancer.
.
Cancer Res.
2011;
;
71
:
:5678.
–
5687
.
5.
Martinet
L
,
Le Guellec
S
,
Filleron
T
,
et al.
High endothelial venules (HEVs) in human melanoma lesions: major gateways for tumor-infiltrating lymphocytes.
.
OncoImmunology.
2012;
;
1
:
:829.
–
839
.
6.
Asrir
A
,
Tardiveau
C
,
Coudert
J
,
et al.
Tumor-associated high endothelial venules mediate lymphocyte entry into tumors and predict response to PD-1 plus CTLA-4 combination immunotherapy.
.
Cancer Cell.
2022;
;
40
:
:1.
–
17
.
7.
Blanchard
L
,
Girard
JP
.
High endothelial venules (HEVs) in immunity, inflammation and cancer.
.
Angiogenesis.
2021;
;
24
:
:719.
–
53
.
8.
Veerman
K
,
Tardiveau
C
,
Martins
F
,
et al.
Single-cell analysis reveals heterogeneity of high endothelial venules and different regulation of genes controlling lymphocyte entry to lymph nodes.
.
Cell Rep.
2019;
;
26
:
:3116.
–
3131
.
9.
Ley
K
,
Kansas
GS
.
Selectins in T-cell recruitment to non-lymphoid tissues and sites of inflammation.
.
Nat Rev Immunol.
2004;
;
4
:
:325.
–
336
.
|