| |
| Med Sci (Paris). 38(8-9): 627–629. doi: 10.1051/medsci/2022088.La connectivité non synaptique et synaptique des neurones produisant la dopamine Charles Ducrot1* and Louis-Éric Trudeau1** 1Département de pharmacologie et physiologie, Département de neurosciences, faculté de médecine, université de Montréal
,
Montréal, Québec
,
Canada MeSH keywords: Neurones dopaminergiques, Humains, Synapses, Transmission synaptique, physiologie |
La neurotransmission dans le système nerveux central implique principalement les synapses, des régions de contact entre deux neurones où peuvent agir divers neurotransmetteurs. Le délai entre le potentiel d’action présynaptique et l’activation des récepteurs postsynaptiques par le neurotransmetteur est de l’ordre de 1 ms. Cette cinétique rapide est due à la proximité des éléments présynaptiques et postsynaptiques, qui sont séparés par une fente synaptique dont la taille varie de 20 à 40 nm. La libération d’un neurotransmetteur dans la fente synaptique est déclenchée par l’influx d’ions calcium dans la terminaison axonale, provoquant un changement de conformation du senseur calcique synaptotagmine-1 en association avec un complexe de protéines appelé SNARE (
soluble N-éthylmaleimide-sensitive-factor attachment protein receptor
). L’amarrage et la fusion des vésicules synaptiques contenant le neurotransmetteur à la membrane plasmique se produit à des emplacements spécialisés appelés zones actives, en présence de protéines d’échafaudage telles que Bassoon ou RIM1/2 (
Rab3-interacting molecules
). Le processus de formation des synapses, encore mal connu, implique des protéines « trans-synaptiques » ancrées dans la membrane présynaptique, comme les neurexines, ou dans la membrane postsynaptique, comme les neuroligines [
1
], et dont l’interaction permet d’unir ces deux membranes. Depuis plusieurs décennies, la grande majorité des études portant sur les mécanismes moléculaires de la neurotransmission et de la synaptogénèse ont été effectuées sur des neurones glutamatergiques et GABAergiques, des populations de neurones qui utilisent des messagers chimiques à action rapide et dont la connectivité est quasi exclusivement synaptique. En revanche, on sait peu de choses de la connectivité des neurones du cerveau dont le rôle est principalement modulateur, tels que les neurones utilisant comme neurotransmetteur la dopamine, la sérotonine ou la noradrénaline.
|
Les terminaisons axonales des neurones dopaminergiques sont majoritairement non synaptiques
La découverte du rôle de neurotransmetteur de la dopamine par le Suédois Arvid Carlsson remonte à la fin des années 1950 [
2
]. Les neurones dopaminergiques dont les corps cellulaires sont localisés dans l’aire tegmentaire ventrale et la substance noire compacte projettent leurs axones respectivement vers le striatum ventral et le striatum dorsal [
3
]. Ces neurones sont impliqués dans de nombreuses fonctions cérébrales, telles que la motivation ou le contrôle de la motricité volontaire. Une atteinte du système dopaminergique est associée à différentes maladies neurologiques : schizophrénie, maladie de Parkinson, toxicomanie [
4
-
6
] (
→
).
(→) Voir la Synthèse de D. Thibault
et al
.,
m/s
n° 2, février 2010, page 165, et la Nouvelle de N. Giguère et L.E. Trudeau,
m/s
n° 4, avril 2016, page 342
Les neurones produisant la dopamine ont les caractéristiques suivantes : 1) Ils possèdent une arborisation axonale particulièrement développée (les neurones dopaminergiques de la substance noire formeraient jusqu’à 1,5 million de terminaisons axonales dans le cerveau humain) [
5
,
6
] ; 2) Les nombreuses terminaisons axonales qu’ils établissent ne sont que peu fréquemment retrouvées en apposition avec un élément postsynaptique, ce qui a conduit à proposer le concept de « neurotransmission diffuse » ; 3) Ils ont la capacité de libérer, en plus de la dopamine, d’autres neurotransmetteurs tels que le glutamate ou le GABA [
7
,
8
].
Nous avons cherché à déterminer si le mode de connectivité peu synaptique des neurones dopaminergiques découlait d’un programme développemental intrinsèque [
9
]. Dans un système expérimental où les neurones dopaminergiques issus de l’aire tegmentaire ventrale et de la substance noire de cerveaux de souris ont été co-cultivés avec des neurones GABAergiques provenant respectivement du striatum ventral et du striatum dorsal, nous avons montré que les terminaisons axonales dopaminergiques sont, comme dans le cerveau intact, très rarement en apposition directe avec un élément postsynaptique. Dans cette étude, les domaines postsynaptiques étaient identifiés par la présence de protéines d’échafaudage telles que PSD95 (
post-synaptic density 95
), présente aux synapses excitatrices, ou la géphyrine, présente aux synapses inhibitrices. Nous avons également observé que les terminaisons axonales des neurones dopaminergiques étaient rarement en interaction directe avec des domaines postsynaptiques identifiés par la présence de récepteurs de la dopamine de type D2 : environ 80 % des terminaisons axonales des neurones dopaminergiques se situaient à distance des domaines postsynaptiques des neurones du striatum. Le contraste était frappant en comparant la connectivité des neurones dopaminergiques avec celle de neurones d’autres régions du cerveau, tels que les neurones corticaux libérant du glutamate, dont environ 80 % des terminaisons axonales étaient en apposition avec la protéine d’échafaudage PSD95, ou les neurones du striatum libérant du GABA, dont environ 70 % des terminaisons axonales étaient en apposition avec un domaine postsynaptique contenant la géphyrine
(
Figure 1
)
.
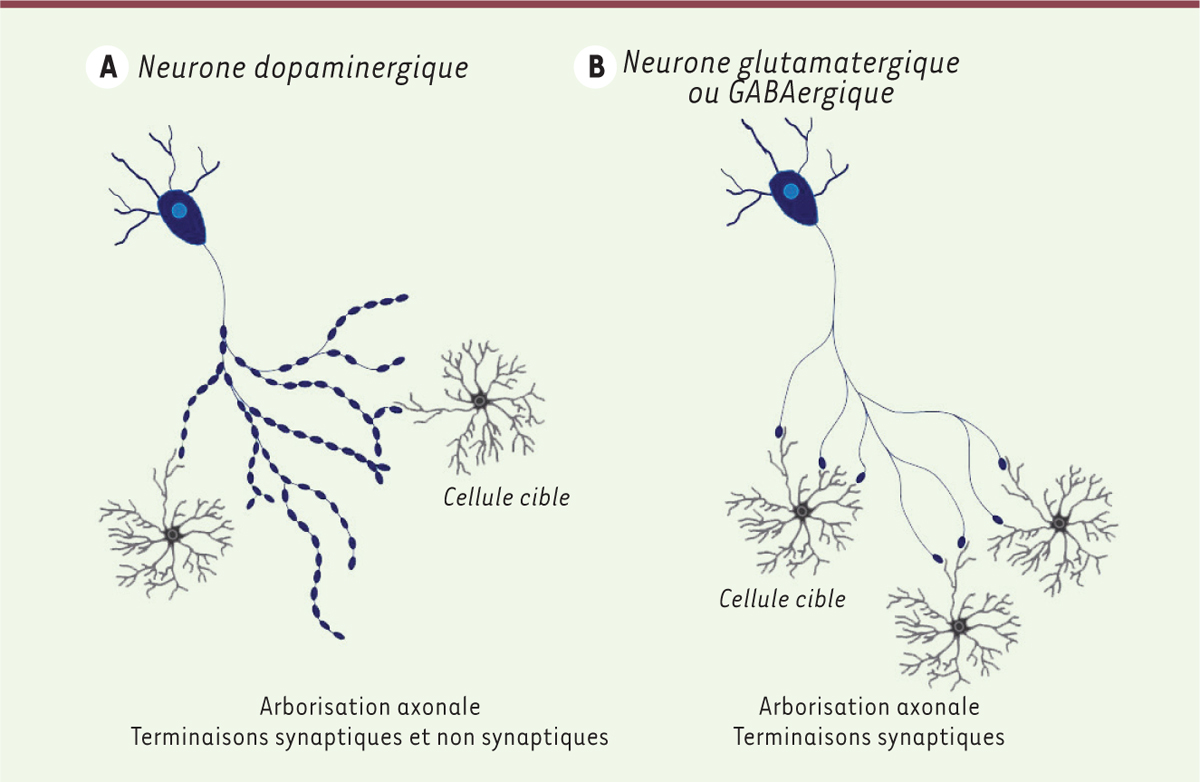
 | Figure 1.
Représentation schématique de la connectivité axonale des neurones produisant la dopamine en comparaison avec les neurones glutamatergiques et GABAergiques. A.
Schéma d’un neurone dopaminergique avec son arborisation axonale dotée d’un très grand nombre de sites de libération de la dopamine (schématisés par des structures ovales bleues), dont seulement une minorité est synaptique, c’est-à-dire en contact avec une cellule cible.
B.
Schéma d’un neurone glutamatergique avec une arborisation axonale contenant un nombre limité de terminaisons axonales, mais dont la majorité est synaptique. Cette caractéristique concerne aussi les neurones GABAergiques.
|
|
Hétérogénéité moléculaire, mais homogénéité fonctionnelle des terminaisons axonales dopaminergiques
Nous avons également voulu déterminer si la composition moléculaire des terminaisons synaptiques des neurones produisant la dopamine était différente de celle de leurs terminaisons non synaptiques. Nous avons constaté que Bassoon, une protéine de la zone active, est préférentiellement présente dans les terminaisons dopaminergiques qui sont en apposition ou à proximité d’une cellule cible (soit dans environ 30 % des terminaisons), tandis que cette protéine est peu ou pas présente dans les terminaisons situées à distance d’autres cellules. En comparaison, la majorité des terminaisons axonales des neurones glutamatergiques (plus de 80 %) et des neurones GABAergiques (environ 65 %) contiennent la protéine Bassoon. Compte tenu du fait que cette protéine est l’une des premières protéines exportées vers les terminaisons axonales lors de la synaptogenèse [
10
], ces résultats suggèrent que la séquence d’évènements moléculaires qui mène à l’établissement de terminaisons axonales synaptiques et non synaptiques est différente. Néanmoins, la machinerie moléculaire impliquée dans la sécrétion des neurotransmetteurs par exocytose semble similaire dans les deux cas. En particulier, le senseur calcique synaptotagmine-1, impliqué dans l’exocytose, est présent dans la grande majorité (environ 80 %) des terminaisons axonales des neurones dopaminergiques, qu’elles soient synaptiques ou non synaptiques. Cette proportion est semblable à celle précédemment rapportée pour les terminaisons axonales des neurones glutamatergiques et GABAergiques. Par ailleurs, des expériences réalisées avec la sonde fluorescente FM1-43, permettant de mesurer l’endocytose et l’exocytose dans les terminaisons axonales, ont révélé que la majorité (environ 70 %) des varicosités axonales des neurones dopaminergiques ont un cycle vésiculaire actif, sans aucune différence entre les terminaisons synaptiques et non synaptiques.
|
Rôle de la neurexine-1 dans la formation des synapses dopaminergiques
De nombreuses études ont montré le rôle important des protéines d’adhérence trans-synaptiques neurexines et neuroligines dans l’assemblage et la plasticité fonctionnelle des synapses. Trois gènes codent les neurexines 1, 2 et 3, sous le contrôle de deux promoteurs (α et β), donnant lieu respectivement aux formes longues et courtes de ces protéines [
1
]. Serait-il possible qu’une expression limitée des neurexines explique en partie le fait que les neurones dopaminergiques forment des contacts synaptiques si peu nombreux par rapport au nombre élevé de leurs terminaisons axonales ? Pour tester cette hypothèse, nous avons surexprimé la neurexine-1α, une isoforme impliquée dans la formation des synapses excitatrices, dans les neurones dopaminergiques à l’aide d’un vecteur viral (lentivirus). Bien que la surexpression de la neurexine-1α ne transforme pas les neurones dopaminergiques en neurones préférentiellement synaptiques, cette manipulation a permis à ces neurones d’établir deux fois plus de terminaisons axonales colocalisées avec la protéine d’échafaudage PSD95 ou la géphyrine. Ce résultat suggère que des protéines d’adhérence trans-synaptiques telles que la neurexine 1α peuvent induire la formation, par les neurones dopaminergiques, de nouveau contacts synaptiques, excitateurs et inhibiteurs, avec des domaines postsynaptiques déjà existants.
|
Ces résultats fournissent la preuve la plus directe à ce jour que les neurones dopaminergiques sont programmés pour développer une majorité de terminaisons axonales impliquées dans la neurotransmission diffuse. À terme, les découvertes sur la connectivité de ces neurones pourraient permettre de mieux comprendre pourquoi ils sont perturbés dans certaines maladies, comme la maladie de Parkinson. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Sudhof
TC
.
Synaptic neurexin complexes: A molecular code for the logic of neural circuits.
.
Cell.
2017;
;
171
:
:745.
–
769
.
2.
Carlsson
A
,
Falck
B
,
Hillarp
NA
.
Cellular localization of brain monoamines.
.
Acta Physiol Scand Suppl.
1962;
;
56
:
:1.
–
28
.
3.
Matsuda
W
,
Furuta
T
,
Nakamura
KC
,
et al.
Single nigrostriatal dopaminergic neurons form widely spread and highly dense axonal arborizations in the neostriatum.
.
J Neurosci.
2009;
;
29
:
:444.
–
453
.
4.
Thibault
D
,
Kortleven
C
,
Fasano
C
,
et al.
Découvertes récentes sur la fonction et la plasticité des voies dopaminergiques du cerveau.
.
Med Sci (Paris).
2010;
;
26
:
:165.
–
170
.
5.
Giguere
N
,
Trudeau
LE
.
La taille de l’axone est un facteur majeur influençant la dépense énergétique et la vulnérabilité des neurones dopaminergiques dans la maladie de Parkinson.
.
Med Sci (Paris).
2016;
;
32
:
:342.
–
344
.
6.
Pacelli
C
,
Giguere
N
,
Bourque
MJ
,
et al.
Elevated mitochondrial bioenergetics and axonal arborization size are key contributors to the vulnerability of dopamine neurons.
.
Curr Biol.
2015;
;
25
:
:2349.
–
2360
.
7.
Mendez
JA
,
Bourque
MJ
,
Dal Bo
G
,
et al.
Developmental and target-dependent regulation of vesicular glutamate transporter expression by dopamine neurons.
.
J Neurosci.
2008;
;
28
:
:6309.
–
6318
.
8.
Tritsch
NX
,
Ding
JB
,
Sabatini
BL
.
Dopaminergic neurons inhibit striatal output through non-canonical release of GABA.
.
Nature.
2012;
;
490
:
:262.
–
266
.
9.
Ducrot
C
,
Bourque
MJ
,
Delmas
CVL
,
et al.
Dopaminergic neurons establish a distinctive axonal arbor with a majority of non-synaptic terminals.
.
FASEB J.
2021;
;
35
:
:e21791.
.
10.
Krueger
SR
,
Kolar
A
,
Fitzsimonds
RM
.
The presynaptic release apparatus is functional in the absence of dendritic contact and highly mobile within isolated axons.
.
Neuron.
2003;
;
40
:
:945.
–
957
.
|