| |
| Med Sci (Paris). 38(6-7): 585–593. doi: 10.1051/medsci/2022085.Le transport mitochondrial Quel impact dans le cancer ? Morgane Morin,1,2 Hadia Moindjie,1,2,3,4 and Clara Nahmias1,2* 1Institut Gustave Roussy, Inserm U981
,
94800Villejuif
,
France 2LabEx LERMIT (Laboratoire d’excellence en recherche sur le médicament et l’innovation thérapeutique), université Paris-Saclay
,
92296Châtenay-Malabry
,
France 3Université Paris-Saclay, UVSQ (Université de Versailles-Saint-Quentin-en-Yvelines), INRAE, BREED (biologie de la reproduction, environnement, épigénétique et développement)
,
F-78350Jouy-en-Josas
,
France 4École nationale vétérinaire d’Alfort, BREED (biologie de la reproduction, environnement, epigénétique et développement)
,
F-94700Maisons-Alfort
,
France |
Vignette (© STORM Abbelight
®
).
En 1956, Otto Warburg, prix Nobel de physiologie ou médecine de 1931, publie dans
Science
, un article intitulé «
On the Origin of Cancer Cells
» dans lequel il montre que, durant la transformation tumorale, les cellules acquièrent la capacité de reprogrammer leur métabolisme énergétique
1
afin de survivre dans un environnement nouveau et souvent hostile [
1
]. Ces travaux ont ouvert la voie à de nombreuses études sur le métabolisme énergétique des cellules cancéreuses, qui figure parmi les «
Hallmarks of cancer
» publiés en 2011 par Douglas Hanahan et Robert A Weinberg [
2
]. Bien que l’effet Warburg - ou glycolyse aérobie au détriment de la mitochondrie - soit incontestable, de nombreux travaux plus récents ont replacé la plasticité et l’activité mitochondriales au centre de la reprogrammation métabolique des cellules tumorales [
3
] (
→
).
(→) Voir la Synthèse de M. Cordier-Bussat,
m/s
n° 8-9, août-septembre 2018, page 701
Connues depuis longtemps pour être les centrales énergétiques de la cellule, les mitochondries sont des organites dans lesquels se succèdent des réactions chimiques, au cours du cycle de Krebs et dans la chaîne de la respiration mitochondriale oxydative (OXPHOS), permettant la conversion d’énergie sous forme d’adénosine triphosphate (ATP). Dans l’OXPHOS, l’activité de la chaîne électronique génère en parallèle des espèces réactives de l’oxygène (ROS) qui sont utilisées pour éliminer les éléments vieillissants de la cellule (stress oxydant). Les mitochondries participent également à l’homéostasie du calcium cytosolique et à de nombreux processus physiologiques (prolifération, migration, mort cellulaire par apoptose) fréquemment altérés dans le cancer [
4
].
Au sein de la cellule, les mitochondries forment des réseaux hautement dynamiques, constamment remodelés par des événements de fusion et de fission. Alors que la fission permet la fragmentation d’une mitochondrie en deux mitochondries filles, la fusion permet de les réunir. Cette plasticité des mitochondries permet de réguler leur taille, leur forme et leur nombre, ainsi que de maintenir leur fonctionnalité par échanges, lors de la fusion, d’ADN mitochondrial (ADNmt), de protéines ou de lipides. Au-delà de cette dynamique par fusion/fission, un autre niveau de régulation du métabolisme énergétique est assuré par le trafic intracellulaire des mitochondries. Ce trafic permet de maintenir l’homéostasie cellulaire et de délivrer l’énergie de façon spatio-temporelle, aux sites et aux moments où la cellule le nécessite. Si l’importance de l’activité métabolique et de la dynamique de fusion/fission des mitochondries dans la carcinogenèse est aujourd’hui bien établie, l’étude de l’altération du transport mitochondrial au cours de la progression tumorale constitue un axe de recherche émergent.
En nous fondant sur les connaissances accumulées sur les cellules neuronales, nous présenterons dans cette revue les acteurs moléculaires qui contrôlent le transport des mitochondries dans les cellules cancéreuses
via
le cytosquelette de microtubules, la dérégulation de l’expression de ces acteurs dans les tumeurs de patients, ainsi que leur rôle dans la migration et la division cellulaire, deux processus étroitement associés à la formation de métastases et à la progression tumorale. Nous discuterons également l’impact du transport mitochondrial sur la réponse des cellules cancéreuses au stress induit par un microenvironnement hostile et par la chimiothérapie.
|
Transport des mitochondries : le paradigme des neurones Historiquement, le neurone est le premier modèle de cellules pour lequel a été décrit un transport intracellulaire de mitochondries. De par l’architecture et l’organisation complexe des réseaux neuronaux, les mitochondries parcourent en effet de longues distances dans les neurones, du soma où elles sont produites, jusqu’à la synapse, où elles apportent l’énergie nécessaire pour la libération des vésicules pré- et post-synaptiques. Le trafic mitochondrial est donc d’une importance capitale dans les neurones et sa dérégulation est, de fait, associée à différentes maladies neurodégénératives, telles que la sclérose latérale amyotrophique, la maladie de Huntington et la maladie de Charcot-Marie-Tooth. Les mitochondries se déplacent le long des cytosquelettes d’actine et de microtubules grâce à différents moteurs moléculaires parmi lesquels la myosine Myo19 qui assure le lien avec les filaments d’actine pour le transport des mitochondries à courte distance. Sur de plus longues distances, les kinésines de la famille KIF5 (kinésine-1), dont il existe trois isoformes (KIF5A, B, C), et le complexe dynéine-dynactine, permettent un transport bidirectionnel des mitochondries le long des microtubules, antérograde (vers le cortex cellulaire) par les kinésines, et rétrograde (vers le noyau) par le complexe dynéine-dynactine.
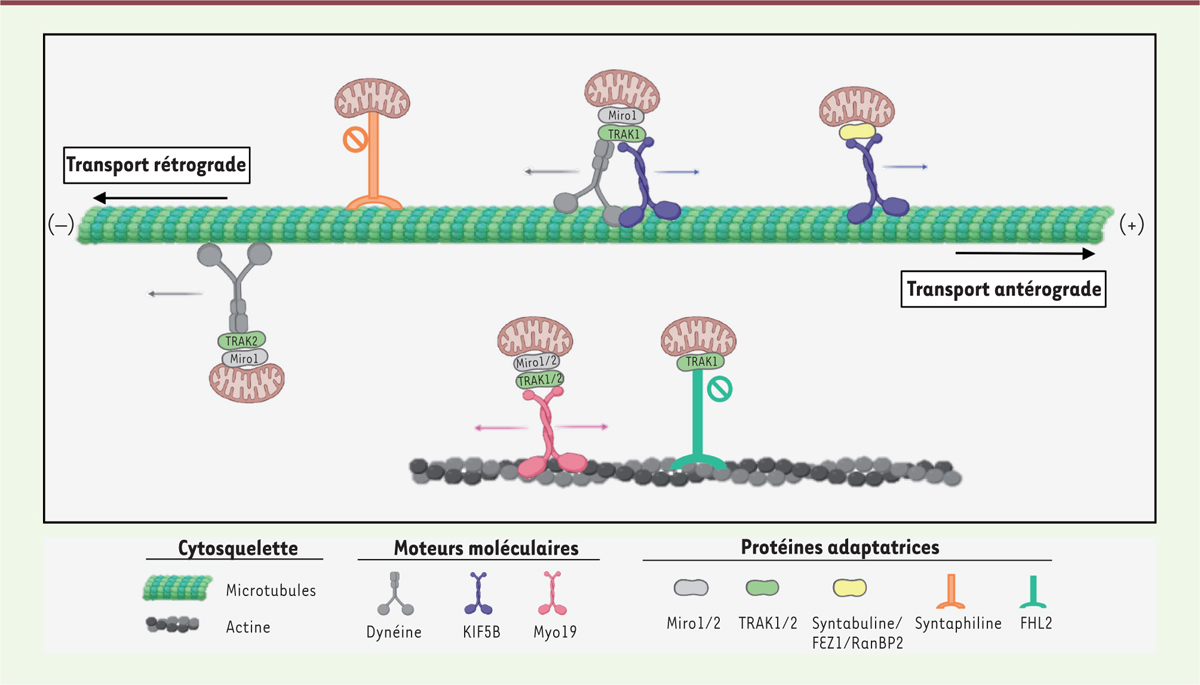
Dans les neurones, le transport des mitochondries le long des microtubules est principalement assuré par le complexe Miro/Milton, initialement identifié dans un crible génétique réalisé chez la drosophile. Les protéines Miro1 et Miro2 sont des Rho GTPases (ou petites GTPases) mitochondriales codées, chez l’homme, par les gènes
RHOT1 et RHOT2
. Elles sont ancrées dans la membrane externe de la mitochondrie par leur extrémité C-terminale [
5
,
6
]. Complexées aux protéines TRAK1/2 (
trafficking kinesin 1/2
) (Milton chez la drosophile), Miro 1 et 2 jouent un rôle d’adaptateurs entre la membrane des mitochondries et les microtubules de la cellule
(
Figure 1
)
. En interagissant avec les moteurs moléculaires, TRAK1/2 permettent le déplacement polarisé, antérograde ou rétrograde, des mitochondries sur les microtubules, soit en direction de leur extrémité plus (
via
les kinésines KIF5), ou en direction opposée, vers leur extrémité moins (
via
la dynéine) [
6
]. Initialement, il avait été montré que TRAK1 jouait un rôle majeur dans le transport antérograde des mitochondries dans les axones, en se liant à la fois à KIF5 et à la dynéine, tandis que TRAK2 assurait le transport rétrograde des mitochondries dans les dendrites,
via
une interaction exclusive avec la dynéine [
6
], soulignant les rôles non redondants des deux protéines TRAK neuronales. Cependant, des travaux plus récents ont révélé la capacité de TRAK2 à lier simultanément KIF5 et le complexe dynéine-dynactine, facilitant même l’interaction entre les deux moteurs moléculaires pour coordonner un transport bi-directionnel des mitochondries [
7
]
(
Figure 1
)
.
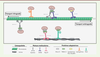 | Figure 1.
Mécanismes moléculaires impliqués dans le transport mitochondrial.
La kinésine KIF5B (en violet) et la dynéine (en gris) permettent un transport respectivement antérograde et rétrograde le long des microtubules, tandis que la myosine Myo19 (en rose) assure le lien avec les filaments d’actine. Ces déplacements nécessitent des protéines mitochondriales et des adaptateurs, dont les plus connus sont respectivement Miro et TRAK (en vert), mais aussi la syntabuline, FEZ1 ou RanBP2 (en jaune) qui, dans les neurones, relient directement les kinésines aux mitochondries (figure réalisée avec le logiciel BioRender).
|
À côté du couple Miro/TRAK, d’autres protéines participent également au transport des mitochondries le long des microtubules dans les neurones. C’est le cas de la syntabuline [
8
], de FEZ1 (
fasciculation and elongation zeta protein 1
) [
9
] et de RanBP2 (
RAN-binding protein 2
) [
10
], qui contrôlent le transport antérograde des mitochondries en s’associant aux kinésines de la famille KIF5. Les protéines associées aux microtubules (MAP7 pour
microtubule-associated protein 7
) contribuent également au transport mitochondrial en se liant à KIF5B [
11
]. La syntaphiline (SNPH), quant à elle, bloque le transport des mitochondries en les ancrant directement sur les microtubules [
12
]. Les mitochondries peuvent également être immobilisées dans un réseau de filaments d’actine,
via
l’interaction de TRAK1 avec la protéine FHL2 (
four and a half LIM domains protein 2
) [
13
].
Dans les cellules non neuronales, le transport mitochondrial est assuré également par les couples Miro/TRAK, mais chaque protéine a un rôle particulier et elles ne sont pas toujours interchangeables
(
Figure 1
)
. En effet, dans les fibroblastes embryonnaires de souris (MEF), TRAK2 - mais pas TRAK1 - guide un transport rétrograde qui implique Miro1 - mais pas Miro2 [
14
]. L’utilisation de MEF dont les gènes
RHOT1
et/ou
RHOT2
ont été invalidés a révélé que Miro1 est responsable de la majorité des transports le long des microtubules, tandis que Miro2 assure principalement le transport des mitochondries sur le cytosquelette d’actine
via
la protéine motrice Myo19. Les protéines Miro coordonneraient ainsi un dialogue entre actine et microtubules. Étonnament, dans les MEF n’exprimant plus Miro1 et Miro2, TRAK1 et TRAK2 restent capables de se lier à la membrane mitochondriale pour assurer un transport antérograde dépendant de la kinésine KIF5C, ce qui suggère l’existence d’autres partenaires mitochondriaux de TRAK1 et TRAK2 [
14
].
En raison de leur ancrage dans la membrane externe de la mitochondrie, les protéines Miro participent également à la régulation négative de la mobilité mitochondriale. D’une part, en fixant le calcium intracellulaire
via
ses deux domaines
EF-hand
2
, Miro change de conformation, ce qui diminue son interaction avec la kinésine KIF5B et induit une réduction du trafic mitochondrial [
15
]. D’autre part, en recrutant à la mitochondrie le couple constitué de la sérine/thréonine kinase PINK1 (
PTEN-induced putative kinase 1
) et de l’ubiquitine-protéine ligase cytosolique parkine, deux acteurs majeurs du contrôle de qualité mitochondrial, Miro1 contribue à sa propre dégradation par le protéasome, avec pour conséquence, une réduction du transport des mitochondries [
16
].
Les protéines Miro sont également impliquées dans la communication entre mitochondries et réticulum endoplasmique (RE) [
17
], favorisant l’entrée du calcium dans la mitochondrie, ce qui place les protéines Miro au centre du couplage entre homéostasie calcique et transport mitochondrial. Miro1 et Miro2 régulent non seulement les sites de contact entre mitochondries et RE mais aussi l’architecture des crêtes mitochondriales [
17
], ce qui souligne encore le rôle clé que jouent ces protéines dans plusieurs fonctions des mitochondries, au-delà de leur transport.
|
Transport mitochondrial, migration et métastases tumorales
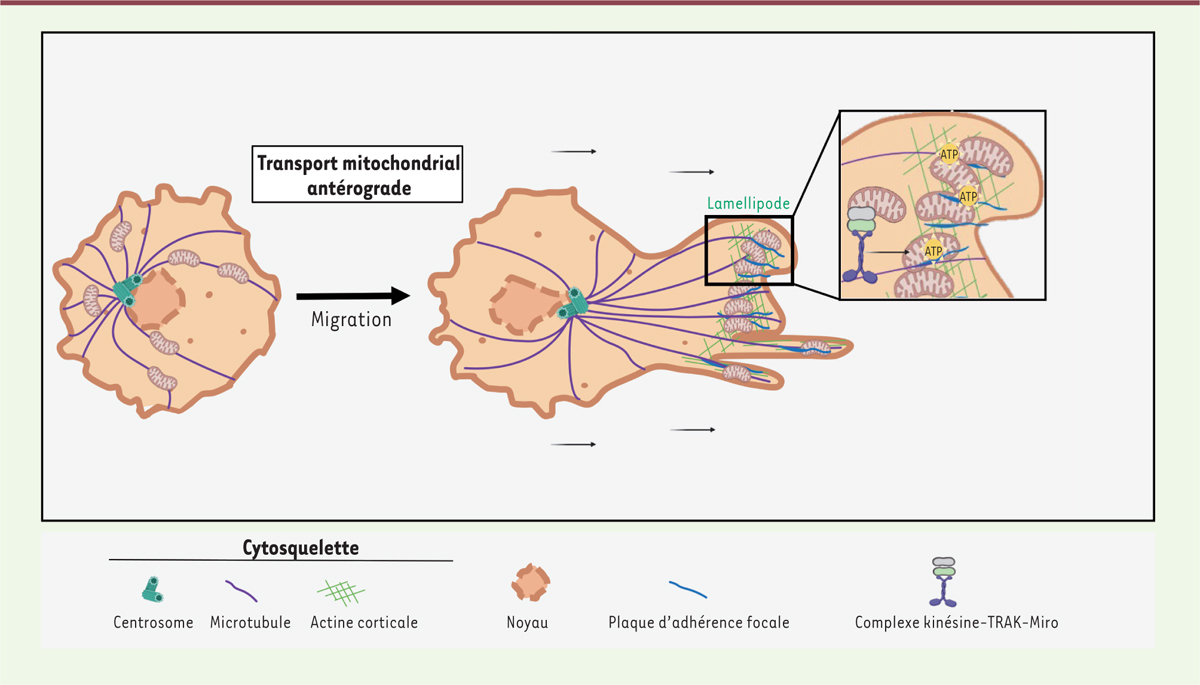
La capacité des cellules cancéreuses à migrer et à envahir les tissus environnants est une étape clé de la formation de métastases tumorales, source majeure de décès par cancer. Lorsqu’elles s’engagent dans un processus de migration, les cellules cancéreuses se polarisent et forment des lamellipodes qui indiquent la direction de leur mouvement. Les processus dynamiques d’adhérence qui se produisent alors au front de migration nécessitent un important apport d’énergie au cortex cellulaire. Cela se traduit par une redistribution des mitochondries de la zone périnucléaire vers la périphérie de la cellule. Par un transport antérograde le long des microtubules, les mitochondries envahissent les lamellipodes, permettant d’établir un gradient d’énergie, sous forme d’ATP, nécessaire à la formation de nouvelles adhérences focales qui permettront aux cellules de se mouvoir [
18
–
20
]
(
Figure 2
)
. Les mitochondries se retrouvent ainsi localisées et alignées au niveau des plaques d’adhérence. Cette étroite proximité contribue au renouvellement rapide des points d’adhérence focale, nécessaire à la motilité de la cellule [
12
].
 | Figure 2.
Transport antérograde des mitochondries dans les cellules en migration.
Par le biais des complexes moléculaires kinésine-TRAK-Miro, les mitochondries sont transportées vers les lamellipodes au front de migration des cellules tumorales pour fournir localement de l’énergie aux contacts focaux et mettre la cellule en mouvement (figure réalisée avec le logiciel BioRender).
|
Plusieurs études indiquent que les mitochondries fissionnées sont transportées plus rapidement vers les lamellipodes des cellules en migration [
12
,
19
], en particulier dans plusieurs modèles cellulaires de cancer du sein [
21
]. Dans un modèle de cellules isolées de cancer de l’ovaire, une augmentation des quantités d’ATP ainsi qu’une forte activité de la kinase AMPK (
AMP-activated protein kinase
) sont observées dans les lamellipodes au cours de la migration, indiquant une activité énergétique élevée liée à une accélération du transport mitochondrial et une redistribution des mitochondries au front de migration [
19
]. Dans plusieurs modèles de cellules cancéreuses, l’inhibition pharmacologique de la phosphorylation oxydative supprime le transport antérograde des mitochondries et réduit les capacités invasives des cellules tumorales ainsi que la formation de métastases hépatiques
in vivo
[
19
,
22
]. Cela souligne ainsi le lien entre activité énergétique mitochondriale et transport antérograde dans un contexte de métastases. Plus récemment, des approches microfluidiques ont permis l’analyse quantitative, à l’échelle de la cellule unique, des protrusions membranaires formées lors de la migration des cellules cancéreuses [
23
]. Ces travaux ont révélé la participation de la protéine DRP-1 (
dynamin-related protein 1
), un important régulateur de la fission mitochondriale, dans le trafic des mitochondries. Ils ont également montré que les mitochondries sont nombreuses, très actives et fragmentées dans les protrusions membranaires des cellules en migration [
23
]. Le transport antérograde des mitochondries pourrait donc être couplé à leur dynamique de fusion/fission et à leur activité bioénergétique dans les cellules qui migrent.
Dans les cellules en migration, le transport antérograde des mitochondries repose sur les mêmes acteurs moléculaires que ceux qui ont été décrits dans les cellules neuronales : Miro1/2, TRAK1/2 et KIF5B [
12
]. L’inhibition de l’expression de ces protéines dans les cellules tumorales se traduit par une diminution du transport antérograde mitochondrial et une réduction de la migration cellulaire, mais aussi des capacités invasives des cellules tumorales et de la formation de métastases
in vivo
[12, 19, 24]. La déplétion de la protéine d’ancrage SNPH, qui a pour effet d’immobiliser les mitochondries sur les microtubules, induit, en revanche, une augmentation de la vitesse et de la distance de déplacement des mitochondries. Celles-ci se redistribuent au niveau du cortex cellulaire, accélérant la dynamique des adhérences focales, de même que la motilité cellulaire et l’invasion tumorale [
12
]. L’existence d’un lien étroit entre transport mitochondrial et invasion tumorale est par ailleurs confortée par les travaux montrant l’interaction,
via
son extrémité C-terminale (fréquemment tronquée dans les cellules de cancer colorectal), du suppresseur de tumeurs APC (
adenomatous polyposis coli
) avec le complexe Miro/TRAK, facilitant le transport des mitochondries vers les plaques d’adhérence, ce qui favorise la migration des cellules [
25
]. Dans un modèle de cellules dérivées de cancer de la prostate (les cellules de la lignée PC3), l’oncogène Myc active la transcription de l’ensemble des gènes codant les protéines impliquées dans le transport des mitochondries (Miro1, Miro2, TRAK2, KIF5B), provoquant ainsi une augmentation de la motilité cellulaire, de l’invasion tumorale et de la formation de métastases
in vivo
[
26
].
|
Transport mitochondrial et mitose
Les cellules cancéreuses sont caractérisées par une prolifération incontrôlée, souvent associée à des anomalies de mitose à l’origine de la tumorigenèse. L’un des enjeux de la division cellulaire, au même titre que la ségrégation des chromosomes entre les deux cellules filles, est d’assurer une répartition égale du pool de mitochondries afin de conserver l’homéostasie cellulaire. La bonne distribution du nombre de mitochondries est importante. Les mitochondries ne sont en effet pas synthétisées
de novo
mais proviennent du pool existant dans la cellule mère. Un déséquilibre de répartition des mitochondries entre les cellules filles pourrait être source de différences dans le métabolisme bioénergétique au sein de la tumeur, et, à terme, induire une hétérogénéité intra-tumorale.
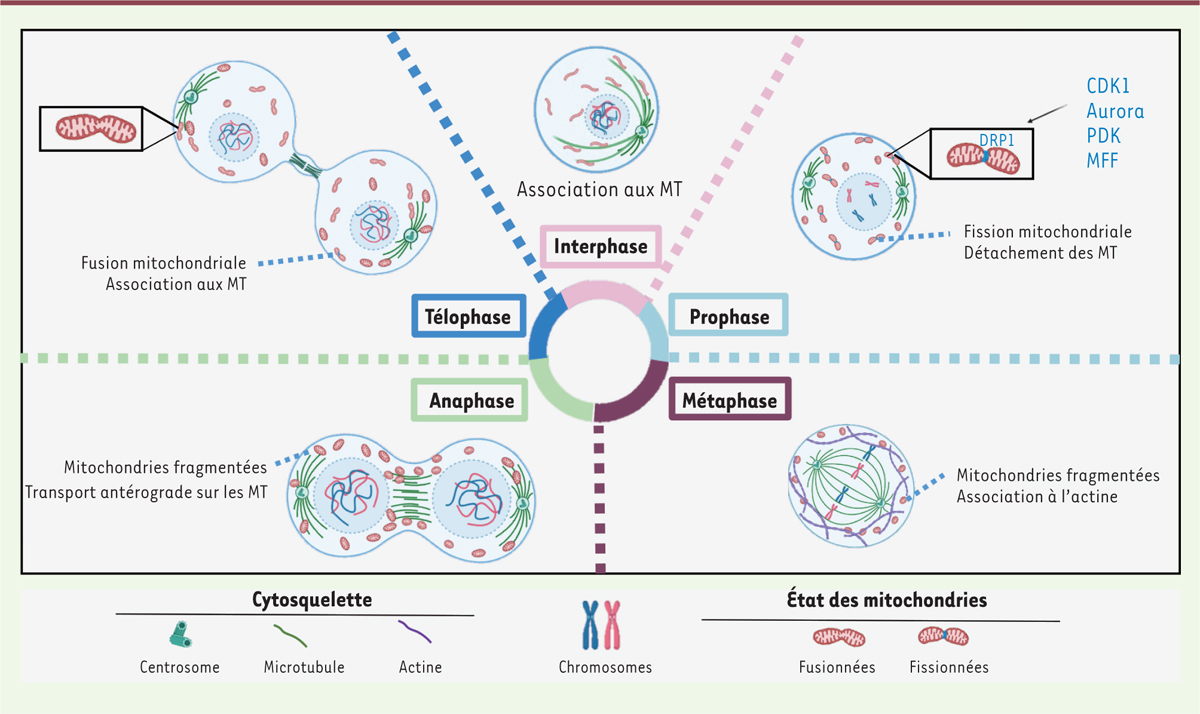
La ségrégation des mitochondries au cours de la division cellulaire met en jeu une régulation de leur dynamique [
27
] et des mécanismes successifs de diffusion passive [
28
,
29
] et de transport actif, impliquant une coordination des réseaux de microtubules et d’actine [14, 30, 31]
(
Figure 3
)
. Alors qu’en début de mitose, les mitochondries se redistribuent de façon passive et aléatoire au niveau du cortex cellulaire, à partir de l’anaphase, un transport antérograde mitochondrial se met en place. Les mitochondries sont alors transportées par Miro1 et KIF5B le long des microtubules astraux, vers l’anneau de constriction, qui nécessite une forte concentration en énergie pour préparer la cytokinèse [
32
]. En fin de cytokinèse, les mitochondries se répartissent à la périphérie des deux cellules filles, selon un nouveau mouvement antérograde, indépendant des moteurs moléculaires mais impliquant une interaction de Miro1 avec la protéine centromérique CENPF (
centromere protein F
) [
33
–
35
]. L’inhibition de l’expression de Miro1/2 et de CENPF a ainsi des effets délétères sur le déroulement de la division cellulaire [
33
].
 | Figure 3.
Dynamique du transport mitochondrial au cours du cycle cellulaire.
Dès l’entrée en mitose et jusqu’en métaphase, les mitochondries se détachent des microtubules (MT) par un mécanisme de
shedding
(relargage) et se redistribuent à proximité du cortex cellulaire où elles sont maintenues par un enchevêtrement de câbles d’actine sous-corticale. Au cours de l’anaphase, les mitochondries sont transportées vers l’anneau de constriction le long des microtubules astraux. Pendant la cytokinèse, un transport antérograde sur les microtubules permet la ségrégation des mitochondries dans les deux cellules-filles. La durée des différentes phases du cycle cellulaire n’est pas à l’échelle (figure réalisée avec le logiciel BioRender).
|
Dans les tissus tumoraux isolés de patients, on observe fréquemment une altération de l’expression de Miro1 [
36
] et de CENPF [
37
,
38
], mais aussi d’autres gènes codant les protéines participant au transport mitochondrial, telles que Miro2 [
39
], TRAK2 [
40
], la dynéine, [
41
–
43
], KIF5B [
44
] et SNPH [
12
]
(
Tableau I
)
. Dans plusieurs cancers, ces altérations d’expression sont associées à une augmentation de la croissance et de l’invasion tumorale,
in vitro
et
in vivo
, ainsi qu’à une plus grande agressivité des tumeurs et un mauvais pronostic clinique. Il est ainsi envisageable que ces protéines du transport mitochondrial puissent représenter de nouveaux biomarqueurs pronostiques de la survie des patients atteints de cancer.
Tableau I.
| Acteurs |
Gènes |
Cancers |
Expression |
Effets cellulaires |
Valeur pronostique |
Réf. |
| génique |
protéique |
In vitro
|
In vivo
|
|
CENPF
|
CENPF
|
Sein |
N/A
|
+
|
N/A |
Métastases osseuses |
OS (p < 0,0001)
RFS (p < 0,0001) |
[
37
]
|
| Pancréas |
+
|
+
|
Prolifération
Migration |
Croissance |
OS (p = 0,00133)
PFS (p = 0,0056) |
[
38
]
|
|
|
Dynéine
|
DYNC1I1
|
Estomac |
+
|
+
|
Prolifération
Migration |
Croissance
Métastases |
OS (p = 3,3 × 10
-14
)
|
[
41
]
|
|
DYNLT3
|
Ovaire |
N/A
|
+
|
Prolifération
Migration
Invasion |
N/A |
OS (p = 0,027)
DFS (p = 0,018) |
[
42
]
|
|
DYNLT1
|
Glioblastome |
N/A
|
+
|
Prolifération
Invasion |
N/A |
OS (p = 0,002)
DFS (p = 0,028) |
[
43
]
|
|
|
KIF5B
|
KIF5B
|
Sein |
+
|
N/A
|
Invasion |
Croissance |
DMFS (p = 5 × 10
-8
)
RFS (p = 1 × 10
-16
)
|
[
44
]
|
|
|
Miro1
|
RHOT1
|
Pancréas |
N/A
|
+
|
Prolifération
Migration |
N/A |
N/A |
[
36
]
|
|
|
Miro2
|
RHOT2
|
Prostate |
+
|
N/A
|
Prolifération |
Croissance |
DFS (p = 0,00042) |
[
39
]
|
|
|
TRAK2
|
TRAK2
|
Ostéosarcome |
– |
N/A
|
Prolifération
Migration
Invasion |
Invasion |
OS (p = 0,03) |
[
40
]
|
|
|
SNPH
|
SNPH
|
Côlon
Poumon |
N/A
|
– |
Migration
Invasion |
Progression
Métastases |
OS (p = 0,01)
OS (p = 0,003) |
[
12
]
|
Dérégulation de l’expression des acteurs du transport mitochondrial dans différents types de cancers.
Les signes + et – indiquent, respectivement, une augmentation et une diminution d’expression dans les tissus tumoraux. Les
p-values
des analyses de survie par Kaplan-Meier sont rapportées. OS : survie globale ; DFS : survie sans progression ; RFS : survie sans récidive ; DMFS : survie sans métastase à distance. N/A : non analysé. CENPF :
centromere protein F
; DYNC1I1 :
cytoplasmic dynein 1 intermediate chain 1
; DYNLT1/3 :
dynein light chain Tctex-type 1/3
; KIF5B :
kinesin family member 5B
; RHOT1/2 :
Ras homolog family member T1/2
; TRAK2 :
trafficking kinesin protein 2
; SNPH :
syntaphilin
.
|
|
Transport mitochondrial et stress des cellules cancéreuses
Les cellules cancéreuses sont en permanence exposées à des stress, qu’ils soient endogènes (dus aux altérations de l’ADN, y compris de l’ADNmt) ou exogènes (exposition au microenvironnement hostile, hypoxique, ou faible en ressources énergétiques, ou exposition à une chimiothérapie). Afin de survivre dans ces conditions, les cellules tumorales mettent en place des mécanismes de défense, dont la réponse rétrograde mitochondriale (RRM) et l’échange intercellulaire de mitochondries, deux processus impliquant le transport des mitochondries le long des microtubules et associés à la survie des cellules
(
Figure 4
)
.
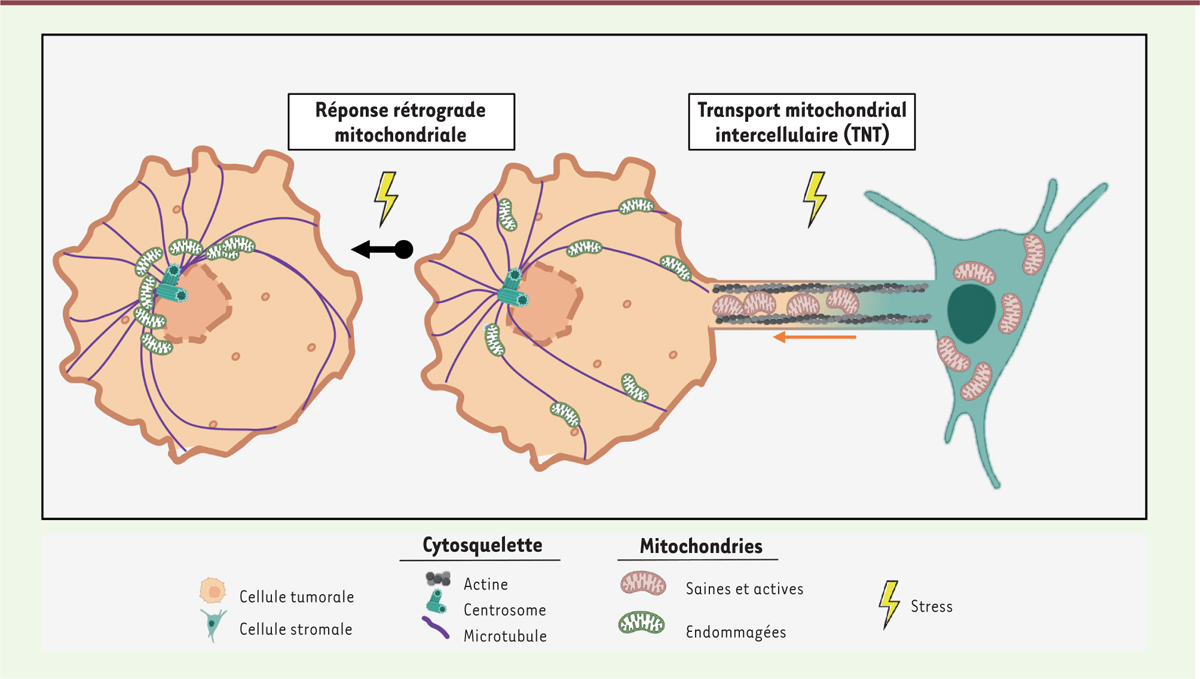
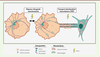 | Figure 4.
Transport mitochondrial lors de la réponse aux stress.
Partie gauche : les mitochondries sont acheminées vers le noyau par un mécanisme de réponse rétrograde mitochondriale (RRM) induite par l’hypoxie ou la chimiothérapie. Partie droite : les mitochondries saines d’une cellule stromale sont acquises par une cellule tumorale par transport intercellulaire
via
une structure de type tunnel nanotube (TNT) (figure réalisée avec le logiciel BioRender).
|
La RRM est un processus au cours duquel les mitochondries endommagées par le stress sont acheminées, par un transport rétrograde, vers le noyau de la cellule avec lequel elles pourront physiquement s’associer et « rétro-communiquer » [
45
]. Cela repose sur le déclenchement de voies de signalisation qui sont induites par les ROS, le calcium, l’ATP, ou par des oncométabolites, tels que le 2-hydroxybutyrate, le fumarate et le succinate, qui pilotent la transcription de gènes nucléaires nécessaires à la restauration des fonctions mitochondriales [
45
]. Dans des cellules en hypoxie, par exemple, la redistribution périnucléaire des mitochondries induit la production de ROS dans le noyau, ce qui favorise l’activation du facteur de transcription HIF1α (
hypoxia-inducible factor 1-alpha
) et donc la transcription de ses gènes cibles qui sont impliqués dans la survie cellulaire et le métabolisme mitochondrial [
46
,
47
]. Dans ces conditions d’hypoxie, le transport rétrograde de mitochondries implique Miro1 et la dynéine [
46
]. Il peut néanmoins être régulé par d’autres acteurs (pour revue, voir [
47
]). Le stress produit par la chimiothérapie est également à l’origine d’une redistribution du réseau de mitochondries autour du noyau. L’exposition de cellules tumorales à une chimiothérapie comme le Taxol® (paclitaxel), qui stabilise les microtubules, bloquant le mécanisme de la mitose, altère le flux mitochondrial [
19
] avec, pour conséquence, une redistribution périnucléaire des mitochondries similaire à celle que l’on observe en l’absence de Miro1 [
48
], et dont les mécanismes restent à préciser.
Le transport intercellulaire de mitochondries est un autre mécanisme de réponse au stress. Dans ce processus, les cellules tumorales dialoguent avec les cellules de leur microenvironnement afin d’acquérir un stock de mitochondries saines et actives. Ces nouvelles mitochondries permettront aux cellules de relancer leur machinerie métabolique, de s’expandre dans un milieu hostile, et même de résister aux thérapies. Pour cela, les cellules tumorales créent des contacts directs avec des cellules saines, en particulier les cellules stromales, et « absorbent » leurs mitochondries. Les cellules tumorales augmentent ainsi leur nombre de mitochondries saines et donc leur production d’ATP [
49
].
Les mitochondries circulent d’une cellule à l’autre en utilisant des ponts cytoplasmiques, par un mécanisme actif dans lequel Miro1 [
50
] transporte les mitochondries le long des microtubules [
51
,
52
]. Dans les cellules tumorales, un des principaux mécanismes impliqués dans ce type de transfert mitochondrial est la constitution de nanotubes formant des tunnels (TNT, pour
tunneling nanotubes
), des nanostructures composées de filaments d’actine partagés entre les deux cellules [
53
]. Comme des filopodes, les TNT s’étendent en formant des protubérances à partir de la membrane plasmique de la cellule donneuse qui se connectent à celles de la cellule receveuse. Dans plusieurs modèles de cancers, l’hypoxie et la chimiothérapie sont connues pour être à l’origine de la formation de ces nanotubes qui favorisent la progression tumorale et la résistance aux traitements [
53
]. Ainsi créés, les tunnels permettront aux mitochondries saines de rejoindre la cellule tumorale, comme cela est observé dans le cas de cultures primaires de cellules de cancer du larynx [
54
]. Le transfert de mitochondries de cellules saines à des cellules tumorales avait été observé avec des lignées de cellules de cancer du sein, que ce transfert rendait résistantes aux molécules utilisées en chimiothérapie [
55
]. Le transport intercellulaire de mitochondries peut également s’opérer
via
d’autres mécanismes, en particulier l’échange de vésicules extracellulaires, l’extrusion mitochondriale, ou les jonctions communicantes [
56
]. Cependant, le transport mitochondrial par les TNT reste le mécanisme le plus fréquent [
52
,
53
].
|
Futures directions : cibler le transport mitochondrial pour limiter la progression du cancer ? Alors que la reprogrammation du métabolisme mitochondrial dans les cellules cancéreuses n’est plus à démontrer, la régulation spatio-temporelle de l’activité bioénergétique, qui implique le transport des mitochondries dans la cellule pour délivrer l’ATP au bon endroit et au bon moment, reste un axe de recherche en plein développement. Les acteurs de ce transport dans les cellules cancéreuses sont similaires à ceux qui avaient été identifiés dans les neurones. Ils reposent sur les protéines mitochondriales Miro1/2, les adaptateurs TRAK1/2, et les moteurs moléculaires KIF5, dynéine et Myo19. La dérégulation de l’expression de la plupart de ces acteurs, dans les tissus tumoraux de patients, est associée à une forte progression tumorale et métastatique ainsi qu’à un mauvais pronostic clinique, ce qui souligne encore l’importance du transport mitochondrial dans la progression tumorale.
Dans l’optique d’une médecine personnalisée en oncologie, il apparaît important d’évaluer le rôle potentiel des protéines du transport mitochondrial, seules ou en combinaison, comme biomarqueurs pronostiques de la survie des patients. Notons que les protéines Miro et les moteurs moléculaires, doués d’activité enzymatique, pourraient être également des cibles thérapeutiques potentielles pour de petites molécules inhibitrices. Par ailleurs, le couplage entre transport mitochondrial et concentration locale de calcium intracellulaire
via
les protéines Miro permet d’envisager des approches thérapeutiques qui seraient liées à la signalisation calcique, dont on sait qu’elle est dérégulée dans le cancer.
Comprendre les mécanismes par lesquels les mitochondries se redistribuent dans les cellules tumorales à des moments clés de leur développement, et/ou en réponse à la chimiothérapie, représente une première étape vers l’élaboration de nouveaux traitements ciblant le transport mitochondrial. Priver les cellules cancéreuses de leurs apports énergétiques, en limitant, à l’aide d’inhibiteurs spécifiques, la redistribution spatio-temporelle des mitochondries au cours de la mitose, de la migration cellulaire ou à la suite d’un traitement, pourrait ouvrir la voie à de nouvelles thérapies personnalisées pour freiner la progression du cancer et/ou contourner la chimiorésistance. |
Les auteures déclarent n’avoir aucun conflit d’intérêt concernant les données publiées dans cet article.
|
Les auteures remercient l’institut Gustave Roussy, l’Inserm, le CNRS et l’université Paris-Saclay, pour leur soutien administratif et technique, la Ligue nationale contre le cancer, pour le financement de la thèse de M.M, ainsi que la Fondation ARC et la Fondation de France, pour le financement de H.M. C.N remercie le Comité Île-de-France de la Ligue nationale contre le cancer, la Ligue contre le Cancer 94/Val-de-Marne, la Fondation ARC, la Fondation Janssen Horizon, la Fondation Rothschild, AG2R LA MONDIALE, l’appel Émergence du Labex LERMIT de l’université Paris Saclay, ainsi que les associations Odyssea et Prolific.
|
Footnotes |
1.
Warburg
O.
.
On the origin of cancer cells.
.
Science.
1956;
;
123
:
:309.
–
314
.
2.
Hanahan
D
,
Weinberg
RA
.
Hallmarks of Cancer: The Next Generation.
.
Cell.
2011;
;
144
:
:646.
–
674
.
3.
Cordier-Bussat
M
,
Thibert
C
,
Sujobert
P
,
et al.
Même l’effet Warburg est oxydable - Coopération métabolique et développement tumoral.
.
Med Sci (Paris).
2018;
;
34
:
:701.
–
708
.
4.
Moindjie
H
,
Rodrigues-Ferreira
S
,
Nahmias
C
.
Mitochondrial Metabolism in Carcinogenesis and Cancer Therapy.
.
Cancers (Basel).
.
2021;
;
13
:
:3311.
.
5.
Nahacka
Z
,
Zobalova
R
,
Dubisova
M
,
et al.
Miro proteins connect mitochondrial function and intercellular transport.
.
Crit Rev Biochem Mol Biol.
2021;
;
56
:
:401.
–
25
.
6.
van Spronsen
M
,
Mikhaylova
M
,
Lipka
J
,
et al.
TRAK/Milton Motor-Adaptor Proteins Steer Mitochondrial Trafficking to Axons and Dendrites.
.
Neuron.
2013;
;
77
:
:485.
–
502
.
7.
Fenton
AR
,
Jongens
TA
,
Holzbaur
ELF
.
Mitochondrial adaptor TRAK2 activates and functionally links opposing kinesin and dynein motors.
.
Nat Commun.
2021;
;
12
:
:4578.
.
8.
Cai
Q
,
Gerwin
C
,
Sheng
Z-H
.
Syntabulin-mediated anterograde transport of mitochondria along neuronal processes.
.
J Cell Biol.
2005;
;
170
:
:959.
–
969
.
9.
Fujita
T
,
Maturana
AD
,
Ikuta
J
,
et al.
Axonal guidance protein FEZ1 associates with tubulin and kinesin motor protein to transport mitochondria in neurites of NGF-stimulated PC12 cells.
.
Biochem Biophys Res Commun.
2007;
;
361
:
:605.
–
610
.
10.
Cho
K-I
,
Cai
Y
,
Yi
H
,
et al.
Association of the kinesin-binding domain of RanBP2 to KIF5B and KIF5C determines mitochondria localization and function.
.
Traffic Cph Den.
2007;
;
8
:
:1722.
–
1735
.
11.
Hooikaas
PJ
,
Martin
M
,
Mühlethaler
T
,
et al.
MAP7 family proteins regulate kinesin-1 recruitment and activation.
.
J Cell Biol.
2019;
;
218
:
:1298.
–
1318
.
12.
Caino
MC
,
Seo
JH
,
Aguinaldo
A
,
et al.
A neuronal network of mitochondrial dynamics regulates metastasis.
.
Nat Commun.
2016;
;
7
:
:13730.
.
13.
Basu
H
,
Pekkurnaz
G
,
Falk
J
,
et al.
FHL2 anchors mitochondria to actin and adapts mitochondrial dynamics to glucose supply.
.
J Cell Biol.
2021;
;
220
:
:e201912077.
.
14.
López-Doménech
G
,
Covill-Cooke
C
,
Ivankovic
D
,
et al.
Miro proteins coordinate microtubule- and actin-dependent mitochondrial transport and distribution.
.
EMBO J.
2018;
;
37
:
:321.
–
336
.
15.
MacAskill
AF
,
Rinholm
JE
,
Twelvetrees
AE
,
et al.
Miro1 Is a Calcium Sensor for Glutamate Receptor-Dependent Localization of Mitochondria at Synapses.
.
Neuron.
2009;
;
61
:
:541.
–
555
.
16.
Wang
X
,
Winter
D
,
Ashrafi
G
,
et al.
PINK1 and Parkin target Miro for phosphorylation and degradation to arrest mitochondrial motility.
.
Cell.
2011;
;
147
:
:893.
–
906
.
17.
Modi
S
,
López-Doménech
G
,
Halff
EF
,
et al.
Miro clusters regulate ER- mitochondria contact sites and link cristae organization to the mitochondrial transport machinery.
.
Nat Commun.
2019;
;
10
:
:4399.
.
18.
Desai
SP
,
Bhatia
SN
,
Toner
M
,
et al.
Mitochondrial Localization and the Persistent Migration of Epithelial Cancer cells.
.
Biophys J.
2013;
;
104
:
:2077.
–
2088
.
19.
Cunniff
B
,
McKenzie
AJ
,
Heintz
NH
,
et al.
AMPK activity regulates trafficking of mitochondria to the leading edge during cell migration and matrix invasion.
.
Mol Biol Cell.
2016;
;
27
:
:2662.
–
2674
.
20.
Schuler
M-H
,
Lewandowska
A
,
Caprio
GD
,
et al.
Miro1-mediated mitochondrial positioning shapes intracellular energy gradients required for cell migration.
.
Mol Biol Cell.
2017;
;
28
:
:2159.
–
2169
.
21.
Zhao
J
,
Zhang
J
,
Yu
M
,
et al.
Mitochondrial dynamics regulates migration and invasion of breast cancer cells.
.
Oncogene.
2013;
;
32
:
:4814.
–
4824
.
22.
Rivadeneira
DB
,
Caino
MC
,
Seo
JH
,
et al.
Survivin promotes oxidative phosphorylation, subcellular mitochondrial repositioning, and tumor cell invasion.
.
Sci Signal.
2015;
;
8
:
:ra80.
.
23.
Zhang
P
,
Yao
J
,
Wang
B
,
et al.
Microfluidics-Based Single-Cell Protrusion Analysis for Screening Drugs Targeting Subcellular Mitochondrial Trafficking in Cancer Progression.
.
Anal Chem.
2020;
;
92
:
:3095.
–
102
.
24.
Furnish
M
,
Caino
MC
.
Altered mitochondrial trafficking as a novel mechanism of cancer metastasis.
.
Cancer Rep Hoboken NJ.
2020;
;
3
:
:e1157.
.
25.
Mills
KM
,
Brocardo
MG
,
Henderson
BR
.
APC binds the Miro/Milton motor complex to stimulate transport of mitochondria to the plasma membrane.
.
Mol Biol Cell.
2016;
;
27
:
:466.
–
482
.
26.
Agarwal
E
,
Altman
BJ
,
Ho Seo
J
,
et al.
Myc Regulation of a Mitochondrial Trafficking Network Mediates Tumor Cell Invasion and Metastasis.
.
Mol Cell Biol.
2019;
;
39
:
:e00109.
–
e00119
.
27.
Pangou
E
,
Sumara
I
.
The Multifaceted Regulation of Mitochondrial Dynamics During Mitosis.
.
Front Cell Dev Biol.
2021;
;
9
:
:767221.
.
28.
Chung
JY-M
,
Steen
JA
,
Schwarz
TL
.
Phosphorylation-Induced Motor Shedding Is Required at Mitosis for Proper Distribution and Passive Inheritance of Mitochondria.
.
Cell Rep.
2016;
;
16
:
:2142.
–
55
.
29.
Moore
AS
,
Coscia
SM
,
Simpson
CL
,
et al.
Actin cables and comet tails organize mitochondrial networks in mitosis.
.
Nature.
2021;
;
591
:
:659.
–
64
.
30.
Rohn
JL
,
Patel
JV
,
Neumann
B
,
et al.
Myo19 ensures symmetric partitioning of mitochondria and coupling of mitochondrial segregation to cell division.
.
Curr Biol.
2014;
;
24
:
:2598.
–
2605
.
31.
Majstrowicz
K
,
Honnert
U
,
Nikolaus
P
,
et al.
Coordination of mitochondrial and cellular dynamics by the actin-based motor Myo19.
.
J Cell Sci.
2021;
;
134
:
:jcs255844.
.
32.
Lawrence
EJ
,
Boucher
E
,
Mandato
CA
.
Mitochondria-cytoskeleton associations in mammalian cytokinesis.
.
Cell Div.
2016;
;
11
:
:3.
.
33.
Kanfer
G
,
Courthéoux
T
,
Peterka
M
,
et al.
Mitotic redistribution of the mitochondrial network by Miro and Cenp-F.
.
Nat Commun.
2015;
;
6
:
:8015.
.
34.
Kanfer
G
,
Kornmann
B
.
Dynamics of the mitochondrial network during mitosis.
.
Biochem Soc Trans.
2016;
;
44
:
:510.
–
516
.
35.
Kanfer
G
,
Peterka
M
,
Arzhanik
VK
,
et al.
CENP-F couples cargo to growing and shortening microtubule ends.
.
Mol Biol Cell.
2017;
;
28
:
:2400.
–
2409
.
36.
Li
Q
,
Yao
L
,
Wei
Y
,
et al.
Role of RHOT1 on migration and proliferation of pancreatic cancer.
.
Am J Cancer Res.
2015;
;
5
:
:1460.
–
1470
.
37.
Sun
J
,
Huang
J
,
Lan
J
,
et al.
Overexpression of CENPF correlates with poor prognosis and tumor bone metastasis in breast cancer.
.
Cancer Cell Int.
2019;
;
19
:
:264.
.
38.
Chen
H
,
Wang
X
,
Wu
F
,
et al.
Centromere protein F is identified as a novel therapeutic target by genomics profile and contributing to the progression of pancreatic cancer.
.
Genomics.
2021;
;
113
:
:1087.
–
95
.
39.
Furnish
M
,
Boulton
DP
,
Genther
V
,
et al.
MIRO2 Regulates Prostate Cancer Cell Growth via GCN1-Dependent Stress Signaling.
.
Mol Cancer Res.
2022
;
OF1-15.
.
40.
Wang
F
,
Ye
B-G
,
Liu
J-Z
,
et al.
miR-487b and TRAK2 that form an axis to regulate the aggressiveness of osteosarcoma, are potential therapeutic targets and prognostic biomarkers.
.
J Biochem Mol Toxicol.
2020;
;
34
:
:e22511.
.
41.
Gong
L-B
,
Wen
T
,
Li
Z
,
et al.
DYNC1I1 Promotes the Proliferation and Migration of Gastric Cancer by Up-Regulating IL-6 Expression.
.
Front Oncol.
2019;
;
9
:
:491.
.
42.
Zhou
L
,
Ye
M
,
Xue
F
,
et al.
Effects of dynein light chain Tctex-type 3 on the biological behavior of ovarian cancer.
.
Cancer Manag Res.
2019;
;
11
:
:5925.
–
5938
.
43.
Dumitru
CA
,
Brouwer
E
,
Stelzer
T
,
et al.
Dynein Light Chain Protein Tctex1: A Novel Prognostic Marker and Molecular Mediator in Glioblastoma.
.
Cancers.
2021;
;
13
:
:2624.
.
44.
Moamer
A
,
Hachim
IY
,
Binothman
N
,
et al.
A role for kinesin-1 subunits KIF5B/KLC1 in regulating epithelial mesenchymal plasticity in breast tumorigenesis.
.
EBioMedicine.
2019;
;
45
:
:92.
–
107
.
45.
Desai
R
,
East
DA
,
Hardy
L
,
et al.
Mitochondria form contact sites with the nucleus to couple prosurvival retrograde response.
.
Sci Adv.
2020;
;
6
:
:eabc9955.
.
46.
Al-Mehdi
AB
,
Pastukh
VM
,
Swiger
BM
,
et al.
Perinuclear Mitochondrial Clustering Creates an Oxidant-Rich Nuclear Domain Required for Hypoxia- Induced Transcription.
.
Sci Signal.
2012;
;
5
:
:ra47.
.
47.
Thomas
LW
,
Ashcroft
M
.
Exploring the molecular interface between hypoxia- inducible factor signalling and mitochondria.
.
Cell Mol Life Sci.
2019;
;
76
:
:1759.
–
1777
.
48.
Alshaabi
H
,
Shannon
N
,
Gravelle
R
,
et al.
Miro1-mediated mitochondrial positioning supports subcellular redox status.
.
Redox Biol.
2020;
;
38
:
:101818.
.
49.
Moschoi
R
,
Imbert
V
,
Nebout
M
,
et al.
Protective mitochondrial transfer from bone marrow stromal cells to acute myeloid leukemic cells during chemotherapy.
.
Blood.
2016;
;
128
:
:253.
–
264
.
50.
Ahmad
T
,
Mukherjee
S
,
Pattnaik
B
,
et al.
Miro1 regulates intercellular mitochondrial transport & enhances mesenchymal stem cell rescue efficacy.
.
EMBO J.
2014;
;
33
:
:994.
–
1010
.
51.
Yamashita
YM
,
Inaba
M
,
Buszczak
M
.
Specialized intercellular communications via cytonemes and nanotubes.
.
Annu Rev Cell Dev Biol.
2018;
;
34
:
:59.
–
84
.
52.
Zampieri
LX
,
Silva-Almeida
C
,
Rondeau
JD
,
et al.
Mitochondrial Transfer in Cancer: A Comprehensive Review.
.
Int J Mol Sci.
2021;
;
22
:
:3245.
.
53.
Hekmatshoar
Y
,
Nakhle
J
,
Galloni
M
,
et al.
The role of metabolism and tunneling nanotube-mediated intercellular mitochondria exchange in cancer drug resistance.
.
Biochem.
2018;
;
475
:
:2305.
–
2328
.
54.
Antanavicˇiuˉte˙
I
,
Rysevaite˙
K
,
Liutkevicˇius
V
,
et al.
Long-Distance Communication between Laryngeal Carcinoma Cells.
.
PLoS ONE.
2014;
;
9
:
:e99196.
.
55.
Pasquier
J
,
Guerrouahen
BS
,
Al Thawadi
H
,
et al.
Preferential transfer of mitochondria from endothelial to cancer cells through tunneling nanotubes modulates chemoresistance.
.
J Transl Med.
2013;
;
11
:
:94.
.
56.
Genovese
I
,
Carinci
M
,
Modesti
L
,
et al.
Mitochondria: Insights into Crucial Features to Overcome Cancer Chemoresistance.
.
Int J Mol Sci.
2021;
;
22
:
:4770.
.
|