| |
| Med Sci (Paris). 38(6-7): 545–552. doi: 10.1051/medsci/2022080.L’inflammasome NLRP3 dans la physiopathologie des infections virales Un focus sur la COVID-19 Marlène Chemarin,1* Océane Dufies,2* Anastassia Mazet,1 Eva Mellan,2 Rémy Coudereau,3,4 Bénédicte F. Py,1 Laurent Boyer,2 and Fabienne Venet1,3** 1CIRI, Centre international de recherche en infectiologie, Univ Lyon, Inserm, U1111, Université Claude Bernard Lyon1, CNRS, UMR5308, ENS de Lyon
,
F-69007
,
Lyon
,
France 2Université Côte d’Azur, Inserm
,
C3M
,
Nice
,
France 3Laboratoire d’immunologie, Hôpital Edouard Herriot - Hospices civils de Lyon
,
69437Lyon Cedex 03
,
France 4
EA 7426
Pathophysiology of Injury-Induced Immunosuppression
, Université Claude Bernard Lyon 1 - Hospices civils de Lyon - BioMérieux, Unité Mixte de Recherche HCLBioMérieux
,
69003
,
Lyon
,
France |
Le SARS-CoV-2 (
severe acute respiratory syndrome coronavirus 2
) est un virus de la famille des coronavirus (CoV) humains qui a émergé en République populaire de Chine à la fin de l’année 2019. Il est responsable de la pandémie de COVID-19
(coronavirus disease-2019)
et de plus de cinq millions de décès à ce jour (données de l’Organisation mondiale de la santé [OMS] au 1
er
janvier 2022)
1
. Le SARS-CoV-2 est un virus enveloppé à ARN simple brin appartenant à la famille des
betacoronavirus
. Son génome code plusieurs protéines non structurales qui permettent la réplication virale et quatre protéines structurales parmi lesquelles la protéine Spike. Cette dernière est activée sous l’action de protéases cellulaires et se lie au récepteur membranaire ACE2 (
angiotensin-converting enzyme 2
). Cela permet au virus d’entrer dans les cellules cibles et de répliquer son génome afin de créer de nouveaux virions qui seront libérés par exocytose [
1
].
Les cellules des voies respiratoires supérieures constituent les cibles privilégiées du SARS-CoV-2 car elles expriment fortement ACE2. Le SARS-CoV-2 se transmet essentiellement par les gouttelettes chargées de virions émises lors d’expectorations ou d’échanges verbaux. Parmi les sujets infectés, 80 % présentent une forme asymptomatique, légère ou modérée de la maladie, à type de syndrome grippal spontanément résolutif en six à dix jours ; 15 % développeront une forme sévère de la maladie, caractérisée par une pneumonie interstitielle atypique bilatérale nécessitant un recours à l’oxygénothérapie ; enfin, 5 % développeront une forme critique de la maladie avec, notamment, un syndrome de détresse respiratoire aiguë (SDRA), un choc septique et une défaillance multiviscérale [
2
].
La réponse de l’hôte face au virus joue un rôle central dans la physiopathologie de la COVID-19 [
2
]. En particulier, l’activation de l’inflammasome NLRP3 (
nucleotide-binding domain leucin-rich repeat
[LRR]
and pyrin-containing receptor 3
, nommée également cryopyrine, CIAS1 [
cold autoinflammatory syndrome 1 protein
] ou NALP3 [
NACHT, LRR and PYD domains-containing protein 3
]) pourrait participer à la phase initiale de la réponse immunitaire innée mise en place au cours de la COVID-19, particulièrement intense chez certains patients. Cette voie de signalisation pourrait ainsi représenter une cible thérapeutique innovante dans les formes les plus sévères de la maladie.
|
Physiologie et physiopathologie de l’inflammasome NLRP3 Physiologie de l’inflammasome NLRP3
NLRP3 est une protéine de 115 kDa constituée d’un domaine LRR (
leucin-rich repeat
) C-terminal, d’un domaine central d’oligomérisation (NOD,
nucleotide-binding and oligomerization domain
ou NACHT) qui présente une activité ATPase, et d’un domaine N-terminal effecteur PYD (
pyrin domain
) capable de recruter l’adaptateur ASC (
apoptosis-associated speck-like protein containing a CARD [caspase recruitment domain]
). NLRP3 est un senseur cytosolique de stress qui enclenche une voie de signalisation pro-inflammatoire prenant part à la réponse immunitaire innée, première ligne de défense contre les infections. Suite à son activation (voir plus loin), NLRP3 assemble un complexe de signalisation multiprotéique dans le cytosol. Ce complexe a été appelé inflammasome en raison de son interaction avec la protéine NEK7 (
NIMA-related kinase 7)
puis du recrutement de l’adaptateur ASC
via
son domaine PYD, lui-même recrutant,
via
son domaine CARD, la caspase-1
(
Figure 1
)
. Dans le cytoplasme, l’inflammasome se concentre en une ultrastructure micrométrique, nommée
speck
(ou structure ponctiforme), visible en microscopie [
3
] (
→
).
(→) Voir la Synthèse de Y. Jamilloux,
m/s
n° 11, novembre 2013, page 975
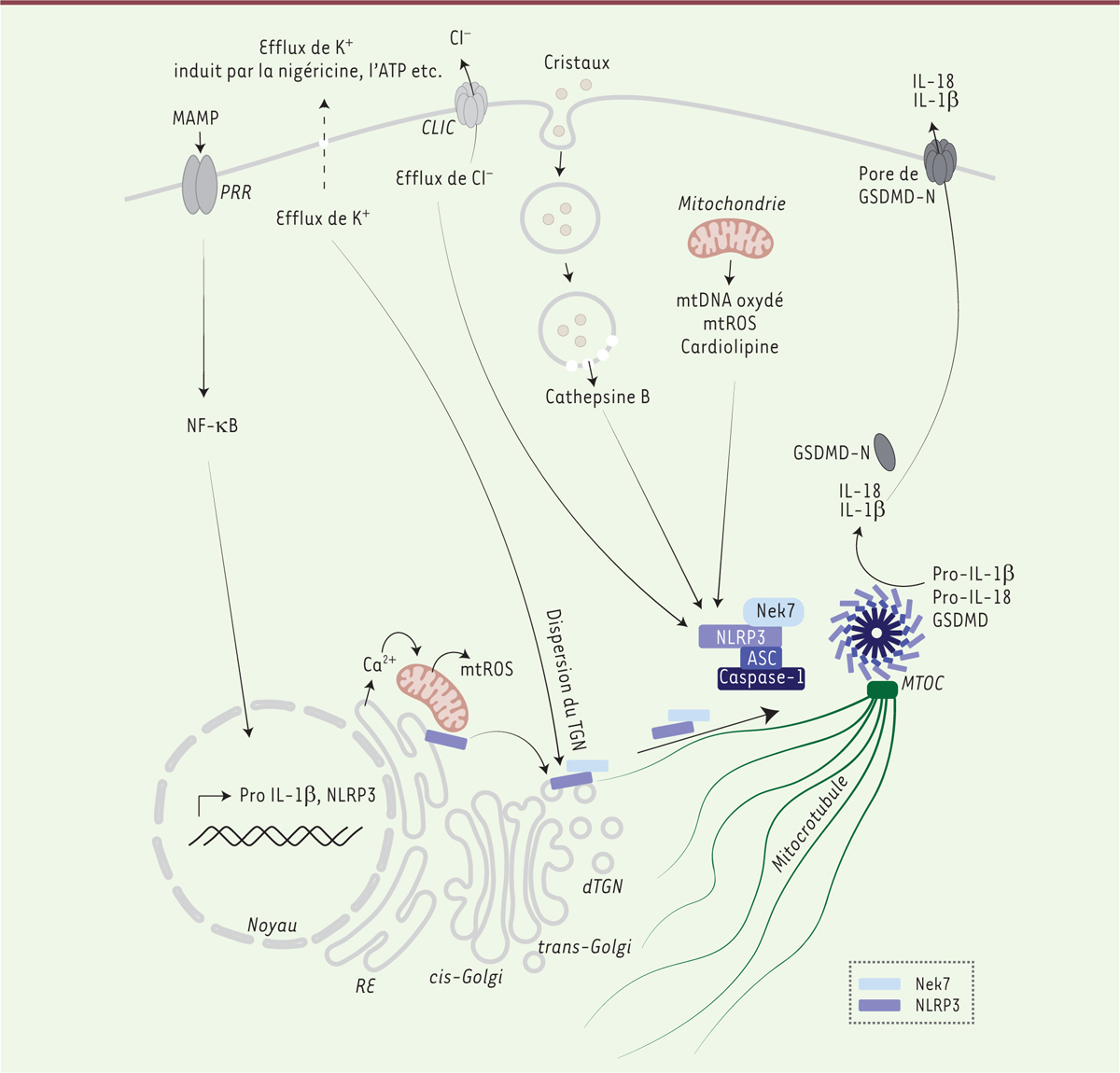
 | Figure 1.
Mécanismes d’activation de l’inflammasome NLRP3.
L’activation de l’inflammasome NLRP3 requiert deux étapes. Le premier signal, ou signal de
priming
, induit l’activation de la voie NF-κB (
nuclear factor kappa-B
) et permet la transcription de NLRP3 ainsi que celle d’autres gènes codant les proformes des cytokines pro-inflammatoires (pro-IL-1β et pro-IL-18). Ce
priming
est déclenché par la liaison de composants microbiens MAMP (
microbial-associated molecular patterns
), ou endogènes DAMP (
damage-associated molecular patterns
) à leurs récepteurs, les PRR (
pattern recognition receptors
). Le second signal, ou signal d’activation, induit l’assemblage de l’inflammasome. Il correspond à l’intégration de signaux de stress cellulaires comme, par exemple, l’efflux de potassium (entraînant une perturbation du TGN [
trans-Golgi network
]
)
, l’exposition à une toxine microbienne, à des cristaux, une rupture des lysosomes, ou encore un dysfonctionnement mitochondrial. Régulé par NEK7, NLRP3 s’oligomérise et recrute la protéine adaptatrice ASC qui permet à son tour le recrutement et le clivage de la pro-caspase-1 en caspase-1. L’inflammasome ainsi formé apparaît dans la cellule sous la forme d’une structure ponctiforme appelée
speck
. La caspase-1 activée clive la gasdermine D (GSDMD) et libère son domaine N-terminal actif (GSDMD-N), et clive les pro-IL-1β et pro-IL-18 en leurs formes actives IL-1β et IL-18. La GSDMD-N va ensuite s’insérer dans la membrane plasmique pour, d’une part, permettre la sécrétion d’IL-1β et d’IL-18, et, d’autre part, induire la mort cellulaire inflammatoire de la cellule par pyroptose. NEK7 :
NIMA-related kinase 7
; ASC
: apoptosis-associated speck-like protein containing a CARD domain
; ATP : adénosine triphosphate ; dTGN
: dispersed trans-Golgi network
; IL-1β : interleukine 1β ; IL-18 : interleukine 18 ; mtDNA : ADN mitochondrial ; MTOC :
microtubule-organizing center
; mtROS :
mitochondrial reactive oxygen species
; NLRP3 :
nucleotide-binding, LRR and PYD domains-containing protein 3
; RE : réticulum endoplasmique ; ROS :
reactive oxygen species.
|
L’inflammasome constitue une plateforme de transactivation pour la caspase-1. C’est cette caspase qui contrôle la maturation, par clivage protéolytique, des interleukines pro-inflammatoires IL-1β et IL-18, qui sont produites sous forme de précurseurs dans le cytosol à la suite de la stimulation de la cellule
(
Figure 1
)
. La caspase-1 clive également la gasdermine D (GSDMD), une protéine cytosolique dont le domaine N-terminal, alors libéré, s’insère dans la membrane cellulaire sous forme d’oligomères, formant des pores, ce qui permet d’une part la libération de l’IL-1β et de l’IL-18 matures, et, d’autre part, conduit à la pyroptose, une forme de mort cellulaire pro-inflammatoire accompagnée de la libération de nombreuses alarmines [
3
].
La machinerie conduisant à l’activation de l’inflammasome est complexe [
4
] (
→
). Deux signaux sont nécessaires. Le premier signal, nommé
priming
(ou amorçage) est déclenché par la liaison de composants microbiens, les MAMP (
microbial-associated molecular patterns
), ou endogènes, les DAMP (
damage-associated molecular patterns
) à leurs récepteurs dédiés, les PRR (
pattern recognition receptors
). Le signal d’amorçage permet d’augmenter la concentration cellulaire de composants et de substrats de l’inflammasome, en particulier NLRP3 et la pro-IL-1β, dont la transcription est induite notamment par l’activation du facteur de transcription NF-κB (
nuclear factor kappa-B),
induite, entre autres, par les produits microbiens. Ce signal d’amorçage permet également de rendre NLRP3 compétent pour son activation,
via
des modifications post-traductionnelles [
3
]. Le second signal, ou signal d’activation, induit l’assemblage de l’inflammasome. Il correspond à l’intégration en parallèle de signaux produits lors d’un stress cellulaire [
3
].
(→) Voir la Synthèse de M. Groslambert,
m/s
n° 1, janvier 2018, page 47
Mécanismes d’activation de l’inflammasome NLRP3 lors d’une infection virale
Lors des infections virales, l’inflammasome NLRP3 est activé. Le signal de
priming
repose alors sur la reconnaissance des acides nucléiques ou des protéines du virus par les récepteurs de l’immunité innée, les
Toll-like receptors
(TLR), qui stimulent la voie de signalisation aboutissant à l’activation de NF-κB [
3
]. Le signal d’activation, secondaire, sera, quant à lui, induit par une rupture lysosomale, qui provoque le relargage de cathepsine B dans le cytosol, par la production d’espèces réactives de l’oxygène (
reactive oxygen species, ROS
), par la détection du génome viral
via
l’hélicase DHX33 (
DEAH-box helicase 33
) ou la ribonucléase L (RnaseL, L pour latent), ou par des déséquilibres ioniques dus à l’activité de canaux ioniques, tels que P2X7 (
purinergic receptor P2X7
), ou de canaux formés par les viroporines virales
2
[
5
].
Pour l’infection par le virus de la grippe
Influenza A
, par exemple, le
priming
de l’inflammasome NLRP3 est induit par la reconnaissance de l’ARN viral par le TLR7. La viroporine M2 du virus crée ensuite un canal à protons au sein de l’appareil de Golgi, ce qui constitue le second signal, avec la libération de ROS par acidification du cytoplasme, activant ainsi l’inflammasome [
5
].
L’activation de l’inflammasome NLRP3 et la mise en place d’une réponse immunitaire pro-inflammatoire peuvent être bénéfiques ou délétères selon le stade de l’infection. Ainsi, dans un modèle murin d’infection par le virus
Influenza
A, l’inhibition tardive de l’inflammasome NLRP3 par un inhibiteur spécifique, le MCC950, empêche l’emballement du système immunitaire et est associée à une diminution de l’inflammation pulmonaire, à une diminution de la perte de poids et à une augmentation de la survie des animaux.
A contrario
, son inhibition précoce augmente la perte de poids et la mortalité des animaux infectés [
6
].
|
Rôle de l’inflammasome NLRP3 dans la physiopathologie de la COVID-19 Les facteurs de risque de la COVID-19 sévère liés à l’inflammasome NLRP3
Plusieurs facteurs de risque associés aux formes les plus sévères de COVID-19 liés à l’activation de l’inflammasome NLRP3 ont été identifiés, dont le vieillissement, le diabète, l’obésité, ou l’hypertension [
7
]. Dans ces contextes cliniques, une activation chronique de l’inflammasome NLRP3 a en effet été décrite [
7
]. Par exemple, chez le sujet diabétique ou obèse, l’acide urique, les cristaux de cholestérol ou l’acide palmitique sont à l’origine d’une inflammation chronique de bas grade à laquelle participe l’inflammasome NLRP3. Cette activation chronique provoque, entre autres, une fibrose pulmonaire et des cardiomyopathies qui pourraient rendre les individus plus vulnérables face aux atteintes cardio-respiratoires associées à la COVID-19.
Les mécanismes d’activation de l’inflammasome NLRP3 au cours de la COVID-19
La capacité des protéines de capside (protéines N) du SARS-CoV-2 à activer l’inflammasome NLRP3 a été initialement démontrée chez la souris [
8
], puis chez l’homme, en utilisant des monocytes sanguins isolés de volontaires sains [
9
,
10
]. L’activation des voies de l’inflammasome NLRP3 a également été observée
ex vivo,
dans les monocytes circulants de patients atteints de COVID-19 [
9
,
10
] de même qu’
in situ
par l’analyse de coupes histologiques de poumons réalisées chez des patients décédés de la maladie [
9
].
Plusieurs études se sont attachées à identifier les différents signaux participant au
priming
et à l’activation de l’inflammasome NLRP3 lors de l’infection par le SARS-CoV-2. En particulier, certaines protéines du virus pourraient jouer un rôle direct dans l’activation de l’inflammasome
(
Figure 2
)
. Par exemple, une séquence de l’ARN codant la protéine Spike, riche en guanine et uracile (GU), est reconnue par le TLR8 qu’expriment les macrophages humains. Cette reconnaissance, à l’origine de la transcription de la pro-IL-1β et de la protéine NLRP3, représente donc un premier signal. La liaison de la protéine Spike au TLR8 induit en outre une activation alternative de l’inflammasome NLRP3 qui se traduit par l’activation de la caspase-8 [
11
,
12
]. La protéine E du SARS-CoV, une viroporine à l’origine d’un efflux de calcium du ERGIC (
ER-Golgi intermediate compartment
), a été associée à des concentrations élevées d’IL-1β dans le parenchyme pulmonaire [
13
]. De même, l’ORF8b du génome viral, ou protéine 8b, peut également activer l’inflammasome NLRP3 en interagissant directement avec son domaine LRR. L’ORF8b induit aussi un stress du réticulum endoplasmique, connu pour être un activateur de l’inflammasome NLRP3 [
14
]. Une autre viroporine virale, la viroporine 3a codée par l’ORF3a, est, quant à elle, à l’origine d’un efflux de potassium dans la cellule qui pourrait être responsable de l’activation de l’inflammasome NLRP3 [
15
,
16
]. La protéine virale N (ou nucléocapside) participerait également à l’activation de l’inflammasome en interagissant directement avec la protéine NLRP3 [
8
], ce qui conduirait à l’assemblage de l’inflammasome et à la sécrétion de l’IL-1β [
8
]. Enfin, la liaison de la protéine Spike à ACE2 et au TLR4 permettrait de générer le second signal d’activation [
17
]. En parallèle de ses capacités à activer l’inflammasome, le SARS-CoV-2 serait capable d’inhiber la pyroptose, qui dépend de l’inflammasome activé. La protéine N du virus se lie en effet directement à la GSDMD, empêchant ainsi son clivage par la caspase-1 et son activation [
18
]. Ainsi, le SARS-CoV-2 pourrait jouer un rôle dans la sévérité de la COVID-19 en interférant avec l’inflammasome NLRP3.
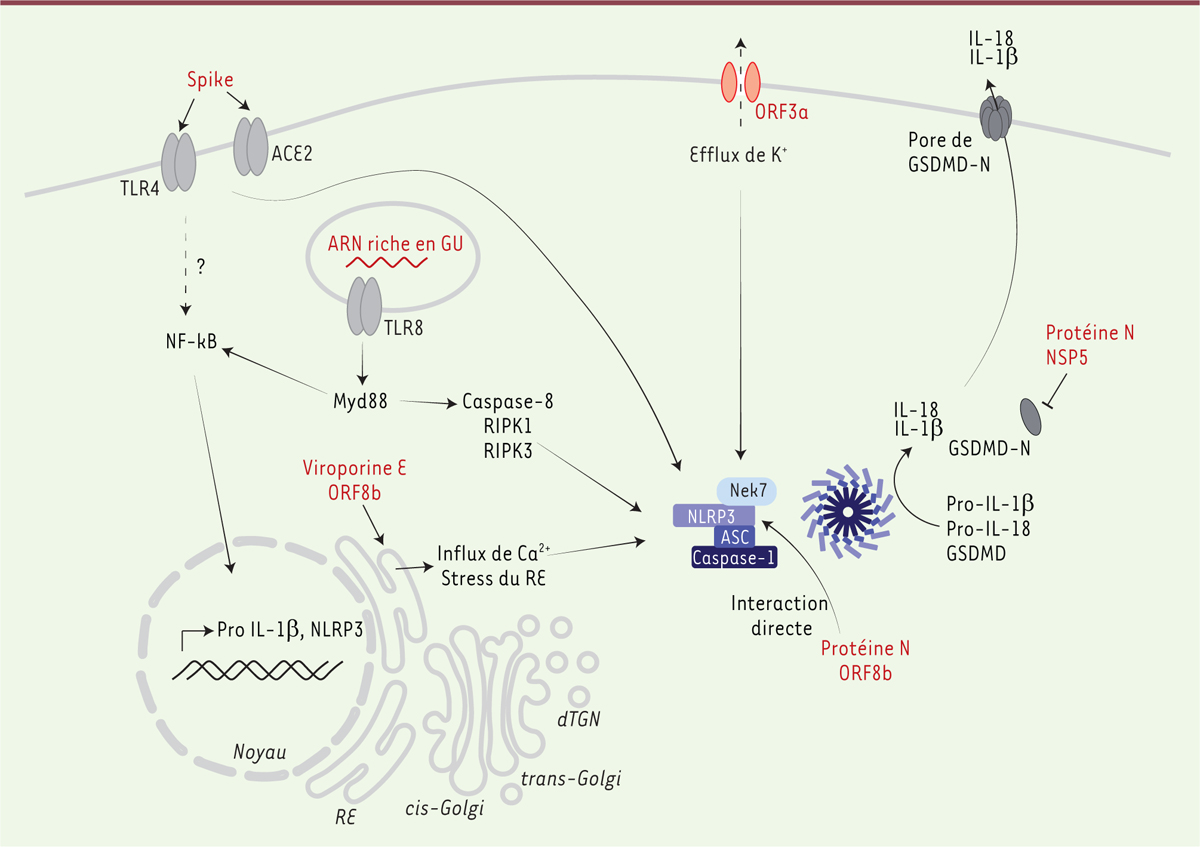
 | Figure 2.
Mécanismes d’activation et de régulation de l’inflammasome NLRP3 par les protéines du SARS-CoV-2.
La protéine Spike permet de générer, d’une part, le signal de
priming
en se fixant au TLR4 (
Toll-like receptor 4
) et, d’autre part, le signal d’activation en se liant à la fois au TLR4 et à son récepteur ACE2 (
angiotensin-converting enzyme 2
) pour permettre la formation de l’inflammasome NRLP3 (
nucleotide-binding, LRR and PYD domains-containing protein 3)
. La séquence riche en GU (guanine, uracile) de l’ARN codant la protéine Spike est reconnue par le TLR8 (
Toll-like receptor 8
), et induit la transcription des gènes impliqués dans la signalisation de l’inflammasome NLRP3 en activant la voie de signalisation Myd88 (
myeloid differentiation primary response 88
). L’activation du TLR8 induit aussi une activation alternative de l’inflammasome NLRP3, impliquant la caspase-8, RIPK (
receptor-interacting serine/threonine-protein kinase
) 1 et RIPK3. La viroporine E et la protéine 8b du virus interagissent avec le réticulum endoplasmique (RE) et provoquent, respectivement, un efflux de calcium du RE et un stress. Comme la protéine N, la protéine 8b peut aussi interagir directement avec NLRP3 et l’activer. La viroporine 3a provoque un efflux de potassium (K
+
) dans la cellule responsable de l’activation de l’inflammasome NLRP3. Deux protéines du SARS-CoV-2 modulent négativement l’activation de NLRP3 : la protéine N, qui se lie à la gasdermine D (GSDMD), empêchant son activation, et NSP5 (
nonstructural protein 5
) qui clive la GSDMD, inhibant son ancrage dans la membrane plasmique. Les composants du SARS-CoV-2 sont indiqués en rouge. ASC :
apoptosis-associated speck-like protein containing a CARD domain
; GSDMD-N : domaine N-terminal de la gasdermine D
;
IL-1β : interleukine 1β ; IL-18 : interleukine 18
; NF-κB :
nuclear factor kappa-B.
Pro-IL-1 β : précurseur de l’interleukine 1β.
|
Conséquences cellulaires et cliniques de l’activation de l’inflammasome NLRP3 au cours de la COVID-19
Au cours d’infections, la suractivation de l’inflammasome NLRP3 pourrait être à l’origine d’une hyperproduction des cytokines pro-inflammatoires, IL-1β et IL-18, ce qui conduirait,
in fine
, à l’orage cytokinique observé chez les patients atteints de COVID-19 qui nécessitent alors une prise en charge en réanimation [
19
]. Chez les patients les plus gravement atteints, plusieurs études ont décrit cette augmentation de concentrations de cytokines pro-inflammatoires (IL-1β, IL-18, IL-1RA [
(interleukin-1 receptor antagonist
], IL-18Bpa [
interleukin 18-binding protein
], IL-6, IL-2R, IL-8, IL-10, TNF-a [
tumor necrosis factor alpha
], CXCL10 [
C-X-C motif chemokine ligand 10
], etc.) [
20
-
23
].
Localement, au niveau pulmonaire, l’IL-1β permettrait le recrutement de polynucléaires neutrophiles, des cellules capables de produire des pièges extracellulaires, les NET (
neutrophil extracellular traps
), constitués, entre autres, de leur ADN et d’histones. Ces pièges pourraient créer des dommages endothéliaux et épithéliaux au niveau du parenchyme pulmonaire, des facteurs de risque de défaillance pulmonaire aiguë et de syndrome de détresse respiratoire aiguë [
24
].
La protéine ACE2 est exprimée par un large éventail de types cellulaires. Le SARS-CoV-2 pourrait ainsi être à l’origine de dommages liés à l’activation de l’inflammasome NLRP3 dans d’autres organes : au niveau cardiaque, avec des myocardites et une diminution de la fraction d’éjection [
25
] ou au niveau neurologique. Des hypothèses sur l’implication de l’activation de l’inflammasome NLRP3 dans les encéphalites, les céphalées, la confusion en lien avec la COVID-19 ont en effet été émises [
15
,
26
]. Enfin, dans les cas les plus graves, l’inflammation générale, accentuée par l’expression quasi ubiquitaire d’ACE2, pourrait conduire à des défaillances multiviscérales.
Des biomarqueurs liés à l’activation de l’inflammasome NLRP3
L’identification de biomarqueurs en lien avec l’activation de la voie de l’inflammasome NLRP3 pourrait conditionner la prise en charge et le devenir des patients souffrant de COVID-19. Une corrélation a en effet été observée entre des concentrations plasmatiques élevées d’IL-18, à l’admission des patients, et la sévérité de la maladie : les patients présentant les concentrations les plus importantes présentent un risque significativement augmenté de décès [
9
].
La diminution de la proportion de monocytes non classiques
3,
dans le sang et la perte d’activation de la caspase-1 en réponse à un activateur de NLRP3, la nigéricine, dans les polynucléaires neutrophiles immatures, ont également été décrites comme des biomarqueurs associés à la sévérité et à l’évolution péjorative de la COVID-19 [
23
]. L’hypothèse que la suractivation de NLRP3 pourrait provenir d’un défaut de ses mécanismes de régulation négative a été proposée [
27
]. Des études ont ainsi mis en évidence une régulation croisée entre les interférons de type I et l’IL-1β [
28
] et un défaut de production d’interférons de type I et III a été relevé dans les formes sévères de COVID-19. Cette dérégulation pourrait participer à l’excès de production d’IL-1β dans ces formes graves de la maladie [
29
]. Le ciblage des composants, des effecteurs, ou encore des régulateurs de l’inflammasome NLRP3, apparaît donc représenter des pistes thérapeutiques intéressantes contre la COVID-19.
|
L’inflammasome NLRP3 et sa cascade de signalisation : une cible thérapeutique dans la COVID-19 ?
L’efficacité de différents traitements qui ciblent des événements en amont de l’activation de l’inflammasome NLRP3, ou en aval, a été évaluée pour la prise en charge des patients souffrant de COVID-19
(
Tableau I
)
. Ces traitements déjà utilisés ou en cours de développement pour le traitement d’autres maladies inflammatoires, ont en effet été repositionnés dans le cadre de la prise en charge de la COVID-19.
Tableau I.
| Traitement |
Cible |
Mécanisme |
Effet sur la COVID-19 modérée |
Effet sur la COVID-19 sévère |
|
Inhibition de l’activation de l’inflammasome NLRP3
|
|
|
Colchicine
|
Inhibe la polymérisation des microtubules |
Inhibition des inflammasomes NLRP3 et pyrine |
Diminution des hospitalisations, des décès et du recours à la ventilation mécanique |
Diminution des décès et du recours à la ventilation mécanique |
|
|
Emricasan
|
Inhibiteur
pan-caspase |
Inhibition de la caspase-1 |
En cours
|
En cours
|
|
|
DFV890
|
NLRP3 |
Inhibition de NLRP3 |
En cours
|
En cours
|
|
|
Dapansutrile
|
NLRP3 |
Inhibition de NLRP3 |
En cours
|
En cours
|
|
|
Inhibition de la cascade de signalisation en aval de l’inflammasome NLRP3
|
|
|
Canakinumab
Anticorps monoclonal
|
IL-1β |
Inhibition de l’IL-1β |
/ |
Pas d’amélioration |
|
|
Anakinra
IL-1RA recombinant
|
IL-1β |
Inhibition de la fixation
de l’IL-1β à son récepteur |
Pas d’amélioration |
Diminution de la sévérité, de la mortalité et de la durée de l’hospitalisation |
|
|
Disulfirame
|
Inhibition de l’ancrage membranaire de la gasdermine D |
Inhibition de la pyroptose |
En cours
|
En cours
|
|
|
Diméthylfumarate
|
Inhibition de la gasdermine D |
Inhibition de la pyroptose |
En cours
|
En cours
|
Traitements ciblant la voie de l’inflammasome NLRP3 en cours d’évaluation dans la COVID-19.
Seuls les essais randomisés ayant inclus plus de 100 patients évaluant des traitements ciblant la voie d’activation de l’inflammasome NLRP3 utilisés ou en cours d’utilisation pour le traitement des patients atteints de la COVID-19 modérée ou sévère ont été pris en compte dans ce tableau. Les principaux résultats de ces essais cliniques sont renseignés lorsque ceux-ci sont disponibles.
|
En amont, cibler l’activation de l’inflammasome NLRP3
Il est possible d’inhiber l’activation de l’inflammasome NLRP3 soit en ciblant la protéine elle-même, soit en interférant avec des évènements nécessaires à son activation, comme la polymérisation des microtubules, ou avec des conséquences de son activation, comme le clivage de la caspase 1. Deux inhibiteurs de l’inflammasome NLRP3, le DFV890 et le dapansutrile, qui sont en cours de développement respectivement pour le traitement de l’urticaire familial au froid et la crise de goutte, ont été repositionnés dans la prise en charge de la COVID-19. Le DFV890 fait l’objet d’une étude clinique de phase II afin d’évaluer son efficacité chez des patients atteints de défaillance respiratoire liée à la pneumopathie associée à l’infection par le SARS-CoV-2 (NCT04382053). Le dapansutrile (ou OLT1177) qui est un inhibiteur de l’inflammasome NLRP3, a été développé pour réduire l’activation de NF-κB [
30
]. Il est actuellement évalué dans un essai clinique de phase II dans la prise en charge de patients souffrant d’une forme modérée de COVID-19 mais présentant des facteurs de risque de développer des formes sévères (NCT04540120). L’effet de la colchicine a également été examiné. Il s’agit d’une molécule qui est notamment utilisée dans le traitement des crises de goutte, une maladie fortement dépendante de NLRP3. La colchicine inhibe la polymérisation des microtubules, nécessaire notamment à l’activation des inflammasomes auxquels participent la pyrine ou NLRP3 [
31
], mais également indispensable pour le recrutement des cellules inflammatoires. Deux essais randomisés réalisés avec des patients atteints de COVID-19 ont conclu à une diminution significative des hospitalisations et des décès [
32
], mais aussi à la prévention de la dégradation clinique des patients qui avaient été traités [
33
]. En revanche, une étude menée par le consortium RECOVERY n’a pas observé de différence en ce qui concerne la mortalité, ou la durée de l’hospitalisation, ou le recours à la ventilation mécanique, dans le groupe de patients hospitalisés et traités par la colchicine en comparaison du groupe de patients qui n’avaient pas été traités mais avaient reçu un placebo [
34
].
Une façon d’inhiber l’action des inflammasomes est de cibler les caspases responsables de la maturation des cytokines inflammatoires IL-1β et IL-18. L’emricasan est un inhibiteur pan-caspases (il inhibe toutes les caspases). Il a été initialement évalué pour la prise en charge de patients atteints de stéatose hépatique non alcoolique. Une étude clinique de phase I est en cours afin de déterminer la tolérance de cet inhibiteur dans la prise en charge des patients atteints de COVID-19 légère (NCT04803227) ; les laboratoires
Histogen
et
Amerimmune
, en charge de l’étude, ont annoncé la résolution complète des symptômes de la COVID-19, chez 13 patients souffrant d’une forme légère de la maladie, traités avec cette molécule.
Cibler la cascade de signalisation en aval de l’activation de l’inflammasome NLRP3
L’activation de l’inflammasome NLRP3 a pour conséquence la libération d’IL-1β, d’IL-18 mais aussi de nombreuses alarmines qui résultent de la mort par pyroptose des cellules. Ces médiateurs peuvent être ciblés individuellement. Une étude randomisée a montré que l’administration du canakinumab, un anticorps monoclonal recombinant humain anti-IL-1β, à des patients présentant une forme sévère de COVID-19, ne permettait pas d’améliorer la survie de ces derniers, comparativement à l’administration d’un placebo [
35
]. D’autres études ont montré néanmoins une amélioration de la fonction respiratoire [
36
,
37
] et une augmentation de la survie à 60 jours des patients traités [
36
]. Ces résultats contradictoires peuvent être la conséquence des effectifs limités inclus dans les différentes études, ou résulter de différences de sévérités ou de prise en charge entre les cohortes de patients. L’anakinra, une forme recombinante de l’IL-1RA, antagoniste naturel du récepteur de l’IL-1β, permet de cibler indirectement l’IL-1β en inhibant par compétition sa fixation à son récepteur. Un essai clinique randomisé évaluant l’utilisation d’anakinra chez des patients présentant une forme modérée de COVID-19 n’a pas démontré d’effet sur l’aggravation clinique ou la mortalité des patients [
38
]. Le consortium CORIMUNO à l’origine de cet essai clinique évalue actuellement l’utilisation de l’anakinra chez des patients hospitalisés en réanimation (NCT04341584).
L’activation de l’inflammasome NLRP3 est largement associée à la pyroptose, une mort cellulaire hautement inflammatoire faisant intervenir la gasdermine D (GSDMD). Le disulfirame, un inhibiteur de l’ancrage de la GSDMD à la membrane et donc de la formation des pores qui en résultent, fait l’objet de deux études cliniques randomisées. Ces dernières visent à évaluer l’efficacité du disulfirame à prévenir la complication des formes modérées de la maladie (NCT04485130 et NCT04594343). Le diméthylfumarate (DMF), utilisé dans le traitement de la sclérose en plaques récurrente-rémittente, inhibe directement l’activation de la GSDMD par succinylation de ses cystéines [
39
]. Le consortium RECOVERY, piloté par l’université d’Oxford (Royaume-Uni), évalue actuellement l’utilisation de DMF dans la prise en charge des patients hospitalisés atteints de COVID-19 (NCT04381936).
Cibler l’activation de l’inflammasome NLRP3 : trouver la bonne cinétique
La cinétique d’activation de l’inflammasome NLRP3 pourrait être un paramètre important à prendre en compte avant d’administrer un traitement ciblant cette cascade de signalisation. Par exemple, un blocage précoce de l’activation de l’inflammasome NLRP3 pourrait limiter la trop importante réponse immunitaire innée que certains patients développent. Le dosage de l’IL-18 plasmatique ou le suivi de l’activation cellulaire de l’inflammasome pourraient ainsi aider à déterminer s’il est nécessaire de bloquer cette voie de signalisation. La concentration circulante de suPAR (
soluble urokinase plasminogen activator receptor
) est associée à un risque de formes sévères de COVID-19 et est corrélée aux concentrations sanguines de calprotectine (S100A8/S100A9) et d’IL-1α
4
. Une étude a utilisé le suPAR comme biomarqueur afin d’administrer l’anakinra, la forme recombinante de l’IL-1RA, à des patients à risque de forme grave de la maladie. Cette étude conclut à une diminution de la sévérité, de la mortalité et de la durée d’hospitalisation des patients [
40
].
|
L’immense effort de recherche effectué au cours de la pandémie de COVID-19 a permis de mettre en évidence l’activation de la voie de l’inflammasome NLRP3 au cours de l’infection par le SARS-CoV-2. Les mécanismes cellulaires et moléculaires mis en jeu doivent encore être détaillés. Néanmoins, différentes stratégies thérapeutiques ciblant cette voie sont d’ores et déjà proposées dans la prise en charge des patients infectés par le SARS-CoV-2. Les résultats des essais cliniques sont attendus afin de confirmer l’intérêt de ces stratégies thérapeutiques et la nécessité de stratifier les patients qui pourraient bénéficier au mieux de ce type de traitements. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Perico
L
,
Benigni
A
,
Casiraghi
F
,
et al.
Immunity, endothelial injury and complement-induced coagulopathy in COVID-19.
.
Nat Rev Nephrol.
2021;
;
17
:
:46.
–
64
.
2.
Osuchowski
MF
,
Winkler
MS
,
Skirecki
T
,
et al.
The COVID-19 puzzle: deciphering pathophysiology and phenotypes of a new disease entity.
.
Lancet Respir Med.
2021;
;
9
:
:622.
–
42
.
3.
Groslambert
M
,
Py
BF
.
NLRP3, un inflammasome sous contrôle.
.
Med Sci (Paris).
2018;
;
34
:
:47.
–
53
.
4.
Jamilloux
Y
,
Henry
T.
Les inflammasomes. Plates-formes de l’immunité innée.
.
Med Sci (Paris).
2013;
;
29
:
:975.
–
84
.
5.
Farag
NS
,
Breitinger
U
,
Breitinger
HG
,
et al.
Viroporins and inflammasomes: A key to understand virus-induced inflammation.
.
Int J Biochem Cell Biol.
2020;
;
122
:
:105738.
.
6.
Tate
MD
,
Ong
JDH
,
Dowling
JK
,
et al.
Reassessing the role of the NLRP3 inflammasome during pathogenic influenza A virus infection via temporal inhibition.
.
Sci Rep.
2016;
;
6
:
:27912.
.
7.
Amin
S
,
Aktar
S
,
Rahman
MM
,
et al.
NLRP3 inflammasome activation in COVID-19: an interlink between risk factors and disease severity.
.
Microbes Infect.
2021
;
:104913.
.
8.
Pan
P
,
Shen
M
,
Yu
Z
,
et al.
SARS-CoV-2 N protein promotes NLRP3 inflammasome activation to induce hyperinflammation.
.
Nat Commun.
2021;
;
12
:
:4664.
.
9.
Rodrigues
TS
,
Sá KSG de, Ishimoto
AY
,
et al.
Inflammasomes are activated in response to SARSCoV-2 infection and are associated with COVID-19 severity in patients.
.
J Exp Med.
2021;
;
218
:
:e20201707.
.
10.
Ferreira
AC
,
Soares
VC
,
Azevedo-Quintanilha
IG de
,
et al.
SARS-CoV-2 engages inflammasome and pyroptosis in human primary monocytes.
.
Cell Death Discov.
2021;
;
7
:
:43.
.
11.
Campbell
GR
,
To
RK
,
Hanna
J
,
et al.
SARS-CoV-2, SARS-CoV-1, and HIV-1 derived ssRNA sequences activate the NLRP3 inflammasome in human macrophages through a non-classical pathway.
.
iScience.
2021;
;
24
:
:102295.
.
12.
Gaidt
MM
,
Ebert
TS
,
Chauhan
D
,
et al.
Human Monocytes Engage an Alternative Inflammasome Pathway.
.
Immunity.
2016;
;
44
:
:833.
–
46
.
13.
Nieto-Torres
JL
,
Verdiá-Báguena
C
,
Jimenez-Guardeño
JM
,
et al.
Severe acute respiratory syndrome coronavirus E protein transports calcium ions and activates the NLRP3 inflammasome.
.
Virology.
2015;
;
485
:
:330.
–
9
.
14.
Shi
C-S
,
Nabar
NR
,
Huang
N-N
,
et al.
SARS-Coronavirus Open Reading Frame-8b triggers intracellular stress pathways and activates NLRP3 inflammasomes.
.
Cell Death Discov.
2019;
;
5
:
:101.
.
15.
De Rivero Vaccari
JC
,
Dietrich
WD
,
Keane
RW
,
et al.
The Inflammasome in Times of COVID-19.
.
Front Immunol.
2020;
;
11
:
:583373.
.
16.
Yap
JKY
,
Moriyama
M
,
Iwasaki
A
.
Inflammasomes and pyroptosis as therapeutic targets for COVID 19.
.
J Immunol.
2020;
;
205
:
:307.
–
312
.
17.
Kucia
M
,
Ratajczak
J
,
Bujko
K
,
et al.
An evidence that SARS-Cov-2/COVID-19 spike protein (SP) damages hematopoietic stem/progenitor cells in the mechanism of pyroptosis in Nlrp3 inflammasome-dependent manner.
.
Leukemia.
2021;
;
35
:
:3026.
–
9
.
18.
Ma
J
,
Zhu
F
,
Zhao
M
,
et al.
SARS-CoV-2 nucleocapsid suppresses host pyroptosis by blocking Gasdermin D cleavage.
.
EMBO J.
2021;
;
40
:
:e108249.
.
19.
Vora
SM
,
Lieberman
J
,
Wu
H
.
Inflammasome activation at the crux of severe COVID-19.
.
Nat Rev Immunol.
2021;
;
21
:
:694.
–
703
.
20.
Huang
C
,
Wang
Y
,
Li
X
,
et al.
Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China.
.
Lancet.
2020;
;
395
:
:497.
–
506
.
21.
Lucas
C
,
Wong
P
,
Klein
J
,
et al.
Longitudinal analyses reveal immunological misfiring in severe COVID-19.
.
Nature.
2020;
;
584
:
:463.
–
9
.
22.
Zhao
Y
,
Qin
L
,
Zhang
P
,
et al.
Longitudinal COVID-19 profiling associates IL-1RA and IL-10 with disease severity and RANTES with mild disease.
.
JCI Insight.
2020;
;
5
:
:139834.
.
23.
Courjon
J
,
Dufies
O
,
Robert
A
,
et al.
Heterogeneous NLRP3 inflammasome signature in circulating myeloid cells as a biomarker of COVID-19 severity.
.
Blood Adv.
2021;
;
5
:
:1523.
–
34
.
24.
Barnes
BJ
,
Adrover
JM
,
Baxter-Stoltzfus
A
,
et al.
Targeting potential drivers of COVID-19: Neutrophil extracellular traps.
.
J Exp Med.
2020;
;
217
:
:e20200652.
.
25.
Gedefaw
L
,
Ullah
S
,
Leung
PHM
,
et al.
Inflammasome Activation-Induced Hypercoagulopathy: Impact on Cardiovascular Dysfunction Triggered in COVID-19 Patients.
.
Cells.
2021;
;
10
:
:916.
.
26.
Zhao
N
,
Di
B
,
Xu
L-L
.
The NLRP3 inflammasome and COVID-19: Activation, pathogenesis and therapeutic strategies.
.
Cytokine Growth Factor Rev.
2021;
;
61
:
:2.
–
15
.
27.
Berg
DF van den
,
Te Velde
AA
.
Severe COVID-19: NLRP3 Inflammasome Dysregulated.
.
Front Immunol.
2020;
;
11
:
:1580.
.
28.
Mayer-Barber
KD
,
Yan
B
.
Clash of the Cytokine Titans: counter-regulation of interleukin-1 and type I interferon-mediated inflammatory responses.
.
Cell Mol Immunol.
2017;
;
14
:
:22.
–
35
.
29.
Blanco-Melo
D
,
Nilsson-Payant
BE
,
Liu
W-C
,
et al.
Imbalanced Host Response to SARS-CoV-2 Drives Development of COVID-19.
.
Cell.
2020;
;
181
:
:1036-45.e9.
.
30.
Marchetti
C
,
Swartzwelter
B
,
Gamboni
F
,
et al.
OLT1177, a β-sulfonyl nitrile compound, safe in humans, inhibits the NLRP3 inflammasome and reverses the metabolic cost of inflammation.
.
Proc Natl Acad Sci USA.
2018;
;
115
:
:E1530-9.
.
31.
Magupalli
VG
,
Negro
R
,
Tian
Y
,
et al.
HDAC6 mediates an aggresome-like mechanism for NLRP3 and pyrin inflammasome activation.
.
Science.
2020;
;
369
:
:eaas8995.
.
32.
Tardif
J-C
,
Bouabdallaoui
N
,
L’Allier
PL
,
et al.
Colchicine for community-treated patients with COVID-19 (COLCORONA): a phase 3, randomised, double-blinded, adaptive, placebo-controlled, multicentre trial.
.
Lancet Respir Med.
2021;
;
9
:
:924.
–
32
.
33.
Deftereos
SG
,
Giannopoulos
G
,
Vrachatis
DA
,
et al.
Effect of Colchicine vs Standard Care on Cardiac and Inflammatory Biomarkers and Clinical Outcomes in Patients Hospitalized With Coronavirus Disease 2019: The GRECCO-19 Randomized Clinical Trial.
.
JAMA Netw Open.
2020;
;
3
:
:e2013136.
.
34.
RECOVERY Collaborative Group.
.
Colchicine in patients admitted to hospital with COVID-19 (RECOVERY): a randomised, controlled, open-label, platform trial.
.
Lancet Respir Med.
2021;
;
9
:
:1419.
–
26
.
35.
Caricchio
R
,
Abbate
A
,
Gordeev
I
,
et al.
Effect of Canakinumab vs Placebo on Survival Without Invasive Mechanical Ventilation in Patients Hospitalized With Severe COVID-19: A Randomized Clinical Trial.
.
JAMA.
2021;
;
326
:
:230.
–
9
.
36.
Generali
D
,
Bosio
G
,
Malberti
F
,
et al.
Canakinumab as treatment for COVID19-related pneumonia: A prospective case-control study.
.
Int J Infect Dis.
2021;
;
104
:
:433.
–
40
.
37.
Ucciferri
C
,
Auricchio
A
,
Di Nicola
M
,
et al.
Canakinumab in a subgroup of patients with COVID-19.
.
Lancet Rheumatol.
2020;
;
2
:
:e457.
–
8
.
38.
Effect of anakinra versus usual care in adults in hospital with COVID-19 and mild-to-moderate pneumonia (CORIMUNO-ANA-1): a randomised controlled trial.
.
Lancet Respir Med.
2021;
;
9
:
:295.
–
304
.
39.
Humphries
F
,
Shmuel-Galia
L
,
Ketelut-Carneiro
N
,
et al.
Succination inactivates gasdermin D and blocks pyroptosis.
.
Science.
2020;
;
369
:
:1633.
–
7
.
40.
Kyriazopoulou
E
,
Poulakou
G
,
Milionis
H
,
et al.
Early treatment of COVID-19 with anakinra guided by soluble urokinase plasminogen receptor plasma levels: a double-blind, randomized controlled phase 3 trial.
.
Nat Med.
2021;
;
27
:
:1752.
–
60
.
|