Les structures lymphoïdes tertiaires sont présentes dans les tissus soumis à une inflammation chronique, dans les maladies auto-immunes, les infections chroniques, le rejet de greffe et les cancers. Leur présence et leur densité sont corrélées à un pronostic favorable dans de nombreux types de cancers [ 1 ]. Ce sont des agrégats lymphoïdes organisés sur un réseau de fibroblastes et comprenant une zone de lymphocytes T, dans laquelle les cellules dendritiques matures sont en contact avec ces lymphocytes, et une zone de lymphocytes B folliculaires. Les structures lymphoïdes tertiaires matures sont définies par la présence d’un centre germinatif contenant des lymphocytes T folliculaires helper et des cellules dendritiques folliculaires en contact étroit avec les lymphocytes B. Le centre germinatif produit des lymphocytes B mémoires et des plasmocytes à longue durée de vie sécrétant des anticorps de haute affinité pour l’antigène. La présence de lymphocytes B et de structures lymphoïdes tertiaires matures permet de prédire les réponses thérapeutiques aux inhibiteurs de points de contrôle immunitaire et la survie chez les patients atteints d’un sarcome des tissus mous, d’un mélanome, d’un cancer du rein, d’un cancer du poumon non à petites cellules, d’un cancer urothélial, et d’autres types de cancer [ 2 – 4 ]. Cependant, les mécanismes par lesquels les lymphocytes B et les plasmocytes influencent le devenir clinique et la réponse aux inhibiteurs de points de contrôle immunitaire sont inconnus. On sait que les lymphocytes B intra-tumoraux peuvent produire des anticorps (des immunoglobulines G et des immunoglobulines A) spécifiques d’antigènes associés aux tumeurs dans certains cancers [ 5 – 7 ], mais rien ne prouve que ces anticorps proviennent d’une différenciation des lymphocytes B à l’intérieur des tumeurs, notamment de ceux présents dans les structures lymphoïdes tertiaires.
Pour répondre à cette question et analyser l’impact des structures lymphoïdes tertiaires sur l’architecture du microenvironement tumoral, nous avons utilisé une technique de transcriptomique spatiale (Visium, 10X Genomics), qui permet, en utilisant des oligonucléotides à code-barres spatiaux situés dans des puits de 55 µm de diamètre, de quantifier l’expression spatiale de l’ensemble des gènes dans un maximum de 5 000 puits. Dans les tumeurs du rein contenant des structures lymphoïdes tertiaires, nous avons ainsi pu montrer que les signatures transcriptomiques de la lignée des lymphocytes B (permettant d’identifier toutes les étapes de maturation, depuis les lymphocytes B « naïfs » jusqu’aux plasmocytes) et de celle des lymphocytes T (permettant d’identifier les différentes populations de lymphocytes T) sont présentes préférentiellement dans les zones contenant les structures lymphoïdes tertiaires. La signature de la lignée monocytaire est un peu plus présente dans les structures lymphoïdes tertiaires, tandis que celle des lymphocytes natural killer (NK) est distribuée de manière plus diffuse dans la tumeur. Les signatures des cellules endothéliales et des granulocytes neutrophiles sont uniformément distribuées, avec des scores plus faibles à l’intérieur des structures lymphoïdes tertiaires, alors que la signature fibroblastique est surtout présente dans les structures lymphoïdes tertiaires. Les tumeurs dépourvues de structures lymphoïdes tertiaires ne présentent pas une telle organisation transcriptomique : elles ont des scores transcriptomiques de la lignée des lymphocytes B très faibles et distribués de manière diffuse dans la tumeur, ainsi qu’une localisation dispersée d’autres signatures immunitaires et stromales [ 8 ].
Par cette technique de transcriptomique spatiale, nous avons pu identifier les gènes plus fortement exprimés dans les structures lymphoïdes tertiaires dont la présence a été validée par immunofluorescence avec des anticorps anti-CD3 et anti-CD20, qui révèlent respectivement les lymphocytes T et les lymphocytes B. Nous avons ainsi obtenu une signature de 29 gènes surexprimés dans ces structures, qui était dominée par des gènes d’immunoglobulines (Ig) fortement exprimés dans les plasmocytes, et incluait des gènes ( IGHA , IGHG1 , IGHG2 , IGHG3 , IGHG4 ) témoignant de l’existence d’une commutation isotypique [ 8 ].
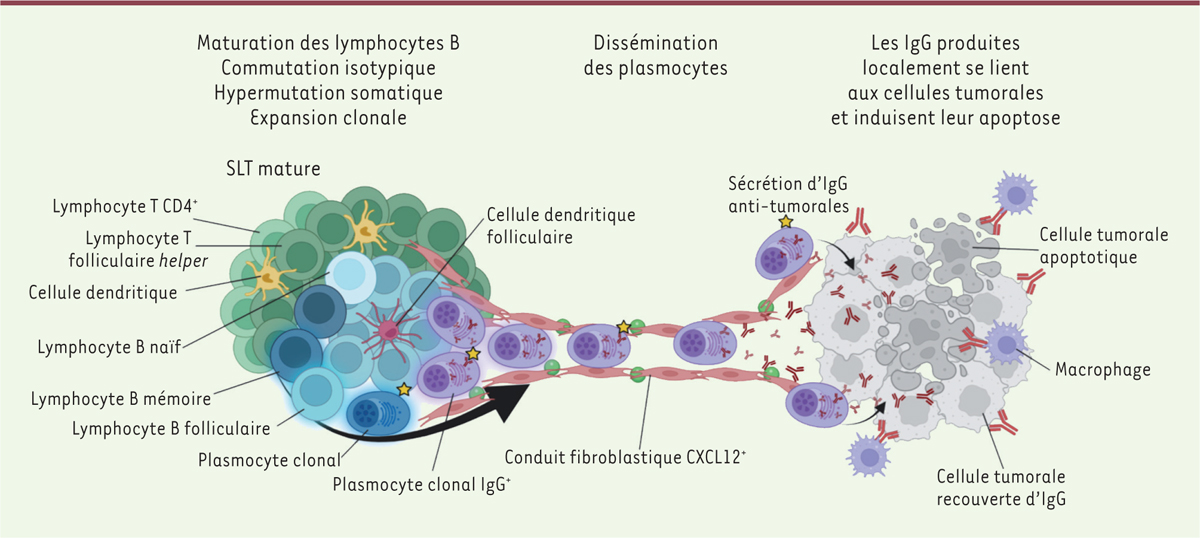
L’expression de gènes ( MZB1 [ marginal zone B and B1 cell-specific protein ], IGKC [ immunoglobulin kappa constant ]) associée aux plasmocytes ainsi que la présence de ces cellules identifiées par immunofluorescence (avec des anticorps anti-IgG, anti-IgA et anti-MUM1 [ multiple myeloma oncogene-1 ]) ont été détectées non seulement dans les zones riches en structures lymphoïdes tertiaires, mais aussi dans la zone tumorale située à distance de ces structures. La technique Visium 10X de transcriptomique spatiale sur coupes congelées permet d’obtenir les séquences nucléotidiques des transcrits des gènes d’immunoglobulines et d’identifier les clonotypes IGH (V, D et J) et IGL (V et J). Les mêmes clonotypes IgH ont été identifiés dans les structures lymphoïdes tertiaires et à distance, démontrant ainsi la dissémination des plasmocytes issus de ces structures au sein des tumeurs. De plus, nous avons observé une augmentation du taux de mutations de gènes V codant les domaines variables des immunoglobulines, accompagnée d’une sélection et d’une amplification de certains clones, dans les tumeurs comportant des structures lymphoïdes tertiaires, ce qui montre que la maturation des lymphocytes B se produit in situ [ 8 ]. Après leur différenciation dans les structures lymphoïdes tertiaires, les plasmocytes migrent le long de conduits de fibroblastes qui produisent la chimiokine CXCL12 ( C-X-C motif chemokine ligand 12 , également appelé SDF-1 pour stromal cell-derived factor 1 ) [ 8 ] ( Figure 1 ) .
| Figure 1.
Les structures lymphoïdes tertiaires induisent une réponse humorale anti-tumorale locale.
Dans les structures lymphoïdes tertiaires (SLT) intra-tumorales se déroulent la maturation, la commutation isotypique, l’hypermutation somatique et l’expansion clonale de lymphocytes B, aboutissant à la production de plasmocytes producteurs d’anticorps Ig(immunoglogulines)G (IgG
+
). Les plasmocytes sont ensuite disséminés à travers la tumeur le long de conduits constitués de fibroblastes produisant la chimiokine CXCL12 (
C-X-C motif chemokine ligand 12
) (CXCL12
+
). La production, par les plasmocytes, d’anticorps dirigée contre les cellules cancéreuses induit l’apoptose de ces cellules ou leur destruction par des macrophages.
|
Les tumeurs contenant des structures lymphoïdes tertiaires matures sont caractérisées non seulement par un infiltrat riche en plasmocytes, mais aussi par un nombre élevé de cellules cancéreuses marquées par un anticorps anti-IgG, ce qui indique que les anticorps IgG produits par les plasmocytes réagissent avec les cellules tumorales. Les anticorps liés à ces cellules peuvent activer localement une réponse effectrice en se fixant, par leur région Fc, aux récepteurs Fc des lymphocytes NK et des macrophages. Nous avons recherché la présence de ces cellules effectrices dans les zones de la tumeur où les cellules cancéreuses sont recouvertes d’anticorps. Nous avons ainsi trouvé une proportion substantielle de cellules tumorales apoptotiques à proximité des macrophages, mais pas à proximité des lymphocytes NK, dans les tumeurs présentant des densités élevées de cellules cancéreuses marquées par des anticorps anti-IgG [ 8 ] ( Figure 1 ) . Cette observation ne démontre pas formellement que les macrophages tuent les cellules cancéreuses, mais elle suggère qu’ils agissent comme des cellules effectrices de leur élimination après avoir été activés par les anticorps présents à la surface des cellules cancéreuses. Le fait que les lymphocytes NK ne semblent pas être associés à la destruction de ces cellules peut s’expliquer par leur faible densité dans les tumeurs du rein que nous avons analysées, ainsi que par le fait qu’ils sont anergiques, comme cela a été rapporté dans de nombreuses tumeurs solides [ 9 ].
Enfin, nous avons montré qu’une densité élevée de cellules cancéreuses recouvertes d’anticorps IgG est corrélée à un taux de réponse thérapeutique et à un taux de survie sans progression de la tumeur plus élevés chez des patients atteints d’un cancer du rein métastatique et traités par une association de deux anticorps inhibiteurs de point de contrôle immunitaire (nivolumab et ipilimumab). Ces résultats ont été confirmés dans un groupe incluant, en plus de ces patients, d’autres patients traités avec le nivolumab seul [ 8 ].
En conclusion, notre étude montre que la production intra-tumorale de plasmocytes dans les structures lymphoïdes tertiaires et la présence d’anticorps IgG associés aux cellules cancéreuses sont prédictives de la réponse à l’immunothérapie. L’induction de structures lymphoïdes tertiaires dans les tumeurs qui en sont dépourvues ou l’utilisation d’anticorps produits localement chez des patients ayant répondu favorablement à l’immunothérapie pourraient constituer de nouveaux outils thérapeutiques en oncologie.