La voie de signalisation ERK ( extracellular signal-regulated kinase ) consiste en une séquence de protéines kinases, RAF/MEK( MAP/ERK kinase )/ERK, impliquées dans l’activation des kinases ERK1 et ERK2 [ 1 , 2 ]. Chez les mammifères, chaque niveau de cette voie implique plus d’une enzyme. Ainsi, trois protéines RAS codées par les gènes paralogues 1 Kras, Hras et Nras peuvent lier et activer les trois protéines kinases RAF codées par les gènes Araf , Braf et Raf1 . Les protéines RAF, une fois activées, peuvent phosphoryler et activer les kinases MEK1 et MEK2, codées par les gènes Mek1 et Mek2 . MEK1 et MEK2 sont responsables de la phosphorylation des protéines ERK1 et ERK2, codées par les gènes Erk1 et Erk2 . MEK1 et MEK2 sont les seules kinases connues capables d’activer ERK1 et ERK2, et elles sont considérées, à ce titre, comme des cibles thérapeutiques prometteuses, puisque la suractivation des kinases ERK est fréquemment observée dans diverses maladies, incluant les cancers et les maladies auto-immunes. La présence de plusieurs paralogues aux différents niveaux de cette voie de signalisation reflète d’ailleurs la complexité du contrôle de son activation dans les différents processus cellulaires où elle est impliquée chez les mammifères.
La voie ERK est activée par plusieurs types de récepteurs, dont les récepteurs de l’antigène des lymphocytes B ( B-cell receptor , BCR) et des lymphocytes T ( T-cell receptor , TCR). Plusieurs études ont montré l’importance de cette voie de signalisation dans le développement du système immunitaire [ 3 , 4 ]. Elle est impliquée dans l’activation des lymphocytes B et dans leur maturation au cours de laquelle l’affinité pour l’antigène augmente [ 5 ]. Son implication dans la transmission du signal en aval du BCR est par ailleurs importante pour la tolérance immunitaire. Les voies de signalisation PI3K (phosphoinositide 3-kinase) et ERK sont également activées par un signal tonique induit par l’expression du BCR à la surface cellulaire, ce qui favorise la survie des lymphocytes B immatures et leur différenciation en lymphocytes B transitionnels puis matures [ 6 ]. L’activation constitutive des voies PI3K et RAS permet la sélection positive de lymphocytes B auto-réactifs. Dans le cas de la voie RAS, ce processus dépend de l’activation des protéines ERK. Toutefois, l’activation directe de ces protéines par une forme constitutivement active de MEK est incapable d’empêcher la tolérance centrale 2 [ 7 ].
La voie ERK est aussi impliquée dans la différenciation des lymphocytes T en lymphocytes T auxiliaires (CD4 + ) et en lymphocytes T cytotoxiques (CD8 + ), et dans la sélection positive de ces cellules. En absence d’une voie ERK fonctionnelle, la différenciation des lymphocytes T est bloquée au stade CD4 + CD8 + (stade « double positif ») [ 4 ]. L’expression d’une forme mutée de MEK1 à effet « dominant négatif », bloquant l’activation des protéines ERK, a permis de montrer, chez la souris, le rôle essentiel de la voie ERK dans la sélection positive mais pas dans la sélection négative des lymphocytes T [ 3 ]. Finalement, l’activation de la voie ERK par le TCR des lymphocytes T mène à différentes réponses selon le type de lymphocytes T (naïf ou mémoire ; CD4 + ou CD8 + ) [ 8 – 10 ].
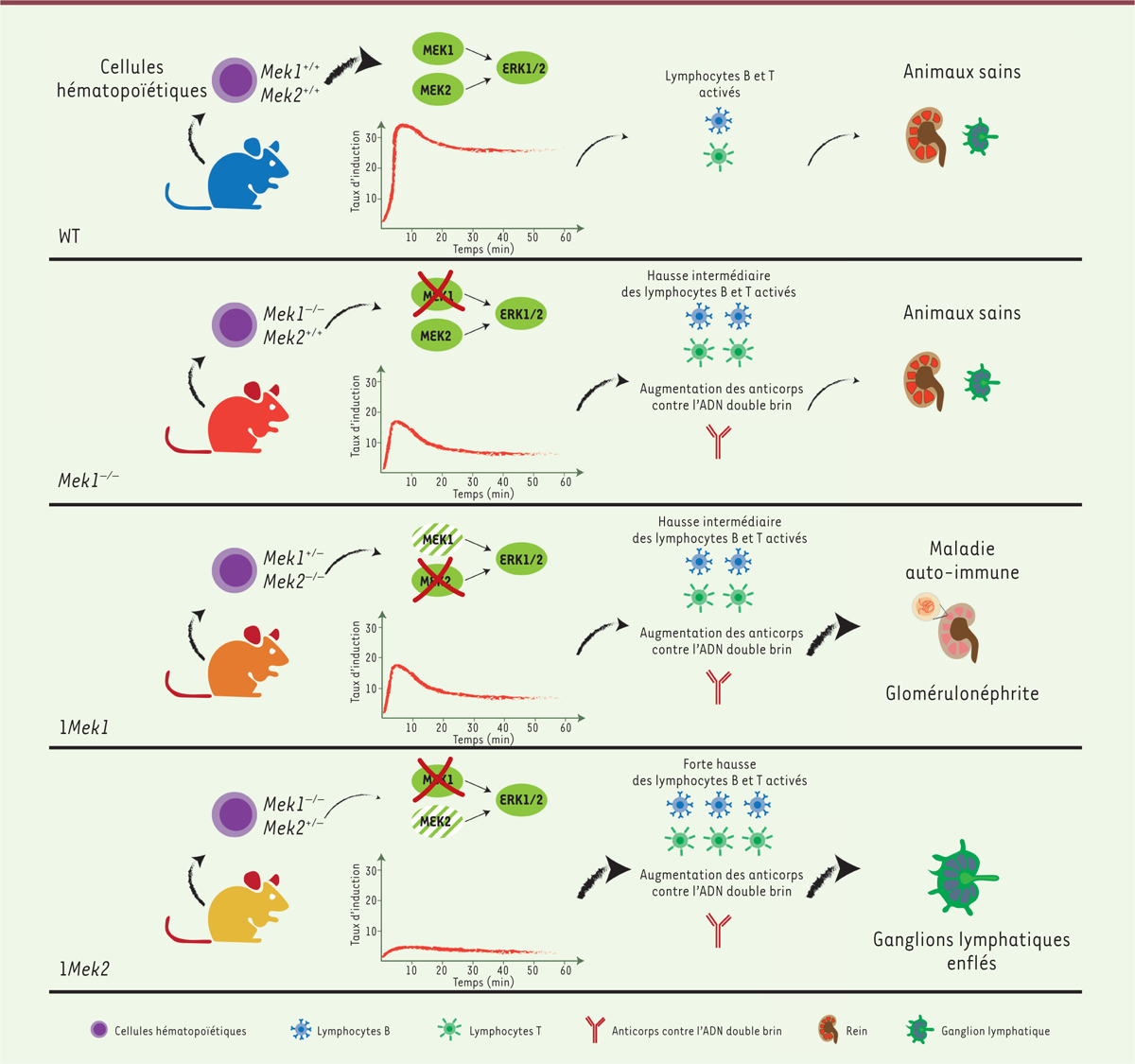
Si l’implication de la voie ERK dans l’hématopoïèse et dans le développement du système immunitaire est connue, la fonction spécifique de chaque kinase reste à définir. Pour évaluer le rôle spécifique de Mek1 et Mek2 dans la mise en place du système immunitaire chez la souris, et pour s’affranchir de la létalité embryonnaire précoce des mutants Mek1 ubiquitaires, nous avons supprimé le gène Mek1 spécifiquement dans les cellules hématopoïétiques par la technique Cre-LoxP, en utilisant, d’une part, un allèle conditionnel de ce gène sur un fonds génétique mutant nul pour Mek2, et d’autre part, la lignée de souris Vav1-icre pour diriger l’expression de la recombinase cre dans les cellules hématopoïétiques. Les souris double homozygotes mutantes ( Mek1 -/- Mek2 -/- ), totalement dépourvues de MEK1 et MEK2 dans les cellules des différentes lignées hématopoïétiques, ont une anémie sévère et meurent rapidement après la naissance [ 11 ]. Au contraire, les souris ne possédant qu’un seul allèle fonctionnel de Mek1 (souris Mek1 +/flox Mek2 -/- Vav1-icre + , par la suite nommées 1 Mek1 ) ou de Mek2 (souris Mek1 flox/flox Mek2 +/- Vav1-icre + , par la suite nommées 1 Mek2 ) dans les lignées hématopoïétiques sont viables et fertiles, et elles présentent une érythropoïèse normale, ce qui permet d’analyser le rôle de MEK1 et de MEK2 dans la myélopoïèse et la lymphopoïèse [ 11 ].
Nous avons entrepris de caractériser une série allélique de souris mutantes pour les gènes Mek1 et Mek2 ( Mek1 -/- , Mek2 -/- , 1 Mek1 et 1 Mek2 ) en mesurant, pour chaque génotype, la quantité de protéines MEK dans les lymphocytes B et les lymphocytes T par une analyse en cytométrie en flux des lymphocytes B B220 + et des lymphocytes T CD4 + de la rate. En parallèle, l’activation de la voie ERK dans les lymphocytes B B220 + en réponse à l’activation du BCR par des anticorps anti-IgG et à l’activation des lymphocytes T CD4 + CD44 + par des anticorps anti-CD3 et anti-CD28 a été analysée par cytométrie en flux avec des anticorps spécifiques des formes phosphorylées des protéines ERK, S6 (une protéine ribosomique), AKT (protéine kinase B) et SYK ( spleen-associated tyrosine kinase ). Cette étude a révélé l’existence d’un gradient dans les quantités de protéines MEK dans ces cellules immunitaires [ 12 ] : il y avait quatre fois plus de protéine MEK1 que de protéine MEK2 dans les lymphocytes B et deux fois plus de MEK1 que de MEK2 dans les lymphocytes T. De plus, nous avons mis en évidence l’existence d’un gradient d’activation des protéines ERK dans les lymphocytes B induits par l’engagement du BCR, et ce gradient était corrélé avec la quantité de protéines MEK. Ainsi, l’activation était maximale dans les lymphocytes B des souris de génotype « sauvage » et des souris Mek2 -/- , intermédiaire chez les souris Mek1 -/- et 1 Mek1 et minimale chez les souris 1 Mek2 . De plus, l’activation de la protéine ribosomique S6 et des kinases AKT et SYK était diminuée dans les lymphocytes B et les lymphocytes T.
L’impact de la baisse d’activité MEK sur la différenciation des lignées lymphoïdes et myéloïdes a été évalué par cytométrie en flux sur les cellules de la rate chez des souris âgées de deux à trois mois avec les différents génotypes. Aucune différence n’a été observée entre ces génotypes pour les lymphocytes B immatures, matures, folliculaires et ceux de la zone marginale, ainsi que pour les lymphocytes T CD4 + et CD8 + et les cellules myéloïdes, incluant les monocytes inflammatoires, les monocytes résidents, les granulocytes neutrophiles, les macrophages et les cellules dendritiques conventionnelles ou de sous-types cDC1 et cDC2 [ 12 ]. En revanche, le nombre total des lymphocytes B activés, incluant les plasmocytes, les lymphocytes B associés à l’âge, ceux du centre germinatif et ceux commutés en IgG1 + , était augmenté dans la rate des souris Mek1 -/- , 1 Mek1 et 1 Mek2 . Il existait aussi une augmentation du nombre de lymphocytes T auxiliaires et de lymphocytes T cytotoxiques activés chez les souris 1 Mek1 , mais la polarisation des lymphocytes T en lymphocytes Th1, Th2 et Th17 n’était pas affectée. Ces résultats indiquent que les souris mutantes pour Mek présentent une activation spontanée des lymphocytes B et des lymphocytes T, et que l’expressivité du phénotype est inversement proportionnelle au niveau d’activation de la voie ERK.
Les souris 1 Mek1 et 1 Mek2 ont une espérance de vie réduite par rapport aux souris de génotype « sauvage », aux souris Mek2 -/- ou Mek1 -/- . Ainsi, 60 % des femelles et 20 % des mâles 1 Mek1 meurent précocement à partir de l’âge de trois mois, et 80 % des femelles et 50 % des mâles 1 Mek2 meurent à partir de l’âge de quatre mois. Les souris 1 Mek1 présentent des signes d’anémie, alors que les souris 1 Mek2 montrent des signes de faiblesse et ont de très volumineux ganglions lymphatiques et des amas anormaux de lymphocytes dans le foie. La proportion de lymphocytes B B220 + et de lymphocytes T CD4 + et CD8 + dans les ganglions lymphatiques des souris 1 Mek2 n’est pas affectée. En revanche, dans les ganglions lymphatiques des souris 1 Mek1, la proportion des lymphocytes B est très augmentée, au détriment des lymphocytes T CD4 + et CD8 + . Ces données indiquent que les causes de la mort prématurée des mutants 1 Mek1 et 1 Mek2 sont distinctes.
La caractérisation des lymphocytes B et des lymphocytes T a révélé que les souris mutantes 1 Mek1 et 1 Mek2 présentent une activation exacerbée des lymphocytes B et T à l’âge adulte (10 mois). L’activation spontanée des lymphocytes B et T combinée à l’accumulation de plasmocytes, de lymphocytes B associés à l’âge, de lymphocytes B des centres germinatifs, et à l’augmentation de lymphocytes B sécrétant des IgG1 chez les souris Mek1 -/- , 1 Mek1 et 1 Mek2 , ainsi que la production, par ces souris, d’anticorps contre des protéines nucléaires et contre l’ADN double brin, font suspecter l’existence d’une maladie auto-immune. Cependant, seules les souris 1 Mek1 développent les signes d’une maladie auto-immune, similaire au lupus érythémateux disséminé. Ces souris , surtout les femelles, ont une anémie sévère causée par une néphropathie glomérulaire avec dépôt rénal de protéines composé d’immunoglobulines et de protéines du complément, associée à une réponse inflammatoire conduisant à une détérioration des tubules rénaux et à une insuffisance rénale, toutes anomalies caractéristiques du lupus érythémateux disséminé. Chez les souris 1 Mek2 , la néphropathie glomérulaire et l’anémie sont beaucoup plus rares. En revanche, ces souris (mâles et femelles), mais pas les souris Mek1 -/- et 1 Mek1 , présentent des ganglions lymphatiques dont le volume est augmenté ou des infiltrations de cellules immunitaires dans différents organes incluant le foie et le rein, ce qui suggère l’existence d’un syndrome lymphoprolifératif.
En résumé, ces résultats indiquent que, malgré le fait que les souris mutantes Mek1 -/- , 1 Mek1 et 1 Mek2 présentent toutes une activation spontanée des lymphocytes B et T et produisent des autoanticorps, seules les souris 1 Mek1 sont plus susceptibles de développer une maladie auto-immune avec une réponse inflammatoire causant une maladie rénale sévère et une anémie ( Figure 1 ) . Chez les souris 1 Mek2 , en revanche, l’activité très réduite de la voie de signalisation ERK entraîne l’activation spontanée des lymphocytes B et T et leur prolifération, mais semble insuffisante pour provoquer une maladie auto-immune. Ces résultats montrent le rôle spécifique de chaque kinase MEK au cours de l’hématopoïèse et l’importance de la régulation de la voie de signalisation ERK pour contrôler et optimiser l’activation des lymphocytes B et T afin de prévenir l’apparition d’un syndrome lymphoprolifératif ou d’une maladie auto-immune.
| Figure 1.
Phénotypes des différentes souris mutantes pour les gènes Mek1 et Mek2.
Le schéma représente l’expressivité des phénotypes immunitaires et des anomalies affectant le rein et les ganglions lymphatiques dans la série allélique de souris mutantes pour les gènes
Mek1
et
Mek2
. L’intensité des phénotypes lymphocytaires est inversement proportionnelle aux niveaux d’activation des protéines ERK observés dans les lymphocytes B, indépendamment de l’isoforme MEK produite. Le développement de la maladie dépend de l’isoforme MEK et du seuil d’activation des protéines ERK. Les mutants
Mek1
-/-
et
Mek1
+/-
Mek2
-/-
(1
Mek1
) ont des niveaux similaires d’activation des kinases ERK similaires, mais seuls les mutants 1
Mek1
développent, par l’intermédiaire de la protéine MEK1, une réponse immunitaire anormale entraînant une inflammation et une néphropathie glomérulaire. En revanche, les mutants
Mek1
-/-
Mek2
+/-
(1
Mek2
), qui présentent les niveaux d’activation ERK les plus faibles, ont une activation lymphocytaire exacerbée. Cependant, le niveau très faible d’activation des proteines ERK chez ces souris empêche la forte réponse immunitaire nécessaire au développement de l’inflammation et de la néphropathie glomérulaire (figure adaptée de [
12
]).
|