| |
| Med Sci (Paris). 38(6-7): 517–519. doi: 10.1051/medsci/2022074.
L’autophagie facilite la reconstruction du réseau mitochondrial après un stress thermique chez le nématode
C. elegans
Romane Leboutet1 and Renaud Legouis1* 1Université Paris-Saclay, CEA, CNRS, Institut de biologie intégrative de la cellule (I2BC), Inserm U1280
,
Gif-sur-Yvette
,
France MeSH keywords: Animaux, Autophagie, Caenorhabditis elegans, Protéines de Caenorhabditis elegans, Réaction de choc thermique, Humains, Longévité, Mitochondries, génétique |
Le nématode
Caenorhabditis
elegans : un modèle pour étudier l’adaptation au stress thermique
Les organismes sont exposés à des variations de température qui mettent à l’épreuve l’homéostasie cellulaire. L’intensité et la durée du stress thermique affectent différemment la réponse cellulaire, allant d’un effet bénéfique (hormèse) à la mort cellulaire nécrotique. Une augmentation importante de la température intracellulaire peut entraîner une accumulation de protéines mal repliées formant des agrégats cytotoxiques. La réponse au stress thermique repose sur l’activité protectrice des protéines chaperonnes de choc thermique, sur l’élimination, par le protéasome, des protéines mal repliées, et sur le processus d’autophagie [
1
].
En plus de son temps de génération court, de sa transparence et de son isogénie
1
, le nématode
Caenorhabditis elegans
présente une réponse physiologique relativement rapide au stress (entre quelques heures et quelques jours), et la conservation évolutive des mécanismes cellulaires impliqués en font un outil de premier plan dans l’étude de la résistance au stress [
2
]. La réponse adaptative de
C. elegans
à un stress thermique a été étudiée au début de l’âge adulte, mais on sait moins comment le ver s’adapte à un stress thermique survenant au cours de son développement.
Certaines études ont pu mettre en évidence un rôle cytoprotecteur du processus d’autophagie chez
C. elegans
: en effet, certains chocs thermiques et la surexpression de la protéine HSF-1
(heat shock factor protein 1)
induisent l’autophagie dans de nombreux tissus, un processus essentiel pour la résistance au stress et pour la longévité du ver [
3
]. L’autophagie facilite la dégradation des composants cytosoliques et le recyclage en réponse à divers stress cellulaires, mais sa contribution à la résistance au stress
in vivo
n’est pas connue. Nous avons étudié les mécanismes de l’adaptation de
C. elegans
à un stress environnemental au cours de son développement [
4
].
|
L’autophagie participe à l’adaptation cellulaire et développementale après un choc thermique
L’autophagie désigne un ensemble de trois mécanismes cellulaires distincts : l’autophagie impliquant les protéines chaperonnes, la microautophagie et la macroautophagie. Contrairement aux deux premiers mécanismes, la macroautophagie nécessite la formation de structures vésiculaires dotées d’une double membrane lipidique : les autophagosomes. Ces vésicules séquestrent des éléments cytoplasmiques, puis fusionnent avec les lysosomes, ce qui permet la dégradation de ces éléments et le recyclage d’acides aminés, de sucres et de lipides. Pour évaluer la contribution de l’autophagie après un stress thermique au cours du développement, nous avons fait subir à des larves de
C. elegans
un stress thermique aigu non létal pendant 60 minutes à 37 °C
(
Figure 1
)
. Un tel stress entraîne un retard de développement et une légère réduction du nombre de descendants, sans létalité. Il induit des modifications cellulaires des organites endomembranaires, une fragmentation importante du réseau mitochondrial et une altération de son fonctionnement. Le réseau mitochondrial se rétablit, morphologiquement et fonctionnellement, après une période de récupération de 24 heures.
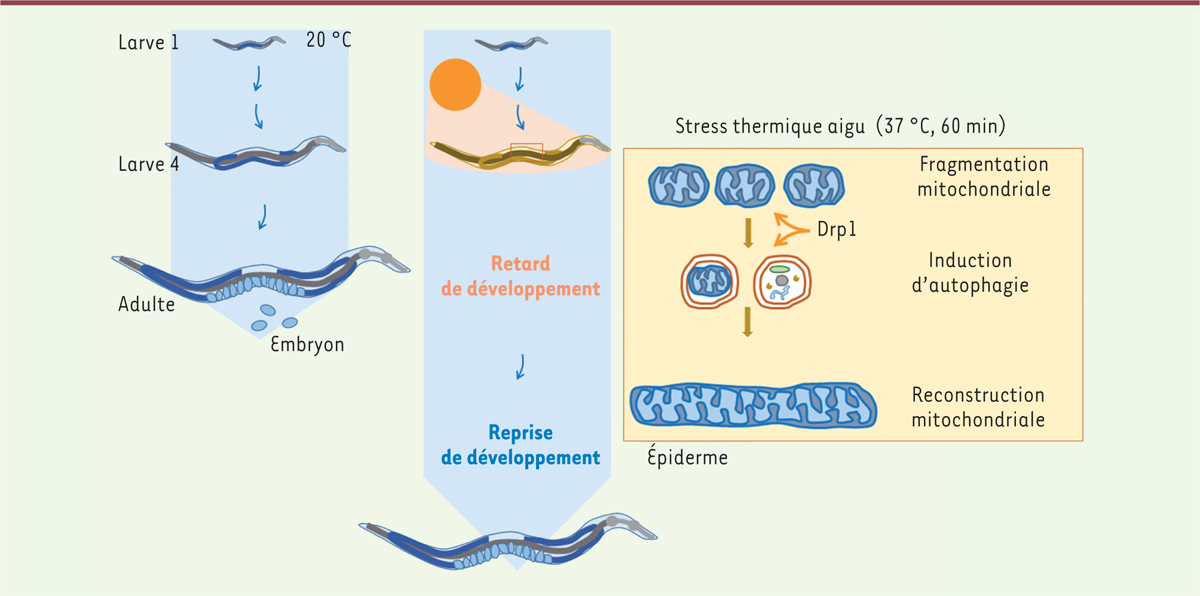
 | Figure 1.
Les effets d’un stress thermique aigu chez le nématode C. elegans.
Un stress thermique aigu non létal (37 °C pendant 1 heure) délivré à des larves de stade 4 de
C. elegans
retarde leur développement, induit une fission du réseau mitochondrial cellulaire qui dépend de l’activité de la protéine DRP-1, et déclenche un flux autophagique nécessaire à l’adaptation de ces larves au stress. Le processus d’adaptation permet la reconstruction du réseau mitochondrial, l’élimination des éléments cellulaires endommagés, puis la reprise du développement larvaire.
|
Par différentes expériences utilisant la génétique et l’imagerie, nous avons pu montrer que l’autophagie est l’un des mécanismes cellulaires de résistance et d’adaptation de
C. elegans
au stress. Après un stress thermique aigu, on observe, chez des vers mutants ayant une autophagie dysfonctionnelle, un retard de développement ainsi qu’un nombre réduit de descendants par rapport aux vers témoins. Par ailleurs, ces mutants présentent un délai de reconstruction du réseau mitochondrial dans la plupart de leurs tissus. Ces résultats montrent que le flux autophagique protège les larves des effets délétères du stress thermique aigu et facilite leur adaptation à ce stress. En utilisant des nématodes transgéniques exprimant des protéines clés du processus autophagique rendues fluorescentes par fusion avec la GFP (
green fluorescent protein)
(GFP::LGG-1, GFP::LGG-2 et ATG-18::GFP)
2
, nous avons constaté, après un stress thermique aigu, une augmentation des sites de biogenèse et du nombre des autophagosomes. Ce résultat met en évidence l’existence d’un lien étroit entre la réponse cellulaire au choc thermique et la macroautophagie qui est induite en réponse au stress. Nous avons émis l’hypothèse que la voie de dégradation sélective des mitochondries (mitophagie) est impliquée dans l’adaptation des vers au stress thermique aigu.
Le nématode
C. elegans
est un modèle puissant pour étudier la mitophagie [
5
]. À la suite d’un stress thermique aigu, nous avons constaté, dans les cellules de l’épiderme, que de nombreux autophagosomes sont associés aux mitochondries ou se trouvent à proximité de celles-ci, ce qui suggère des évènements de mitophagie. Pour évaluer la contribution de la mitophagie à l’adaptation des vers au stress thermique aigu, nous avons testé différents mutants chez lesquels les voies connues pour être impliquées dans l’autophagie sélective des mitochondries sont inactives. Nous avons ainsi constaté que les gènes
pink-1 (PTEN-induced putative kinase 1
),
pdr-1 (Parkinson’s disease-related 1)
, et
fndc-1
(
FUN14 domain-containing 1
) impliqués dans la mitophagie ne sont pas indispensables à l’adaptation des vers après un stress thermique aigu. Ce résultat peut s’expliquer de trois façons : 1) l’autophagie est requise pour l’adaptation à ce stress, mais pas la mitophagie ; 2) il existe une redondance fonctionnelle entre plusieurs voies de mitophagie ; 3) la mitophagie est impliquée par une autre voie, encore inconnue.
|
DRP-1, une protéine clé de la fission mitochondriale, est impliquée dans la formation des autophagosomes
La structure du réseau mitochondrial est maintenue par un équilibre complexe entre les activités de protéines de fusion et de fission mitochondriale. La fission est nécessaire pour créer de nouvelles mitochondries, mais elle contribue également au contrôle de qualité en permettant l’élimination des mitochondries endommagées et peut faciliter l’apoptose lors d’un stress cellulaire intense [
6
]. Le processus de fission comprend la formation d’un site de constriction mitochondriale impliquant un contact avec le réticulum endoplasmique. L’oligomérisation de la protéine DRP-1 (
dynamin-related protein 1
), située sur la membrane mitochondriale externe, augmente cette constriction. Au cours de la mitophagie, l’activité de DRP-1 intervient dans le contrôle de la structure du réseau mitochondrial pour permettre l’élimination des parties endommagées [
7
]. Chez les mammifères, cette protéine n’est pas seulement impliquée dans la fission mitochondriale. Elle module aussi la forme du réticulum endoplasmique en favorisant les sites de contact avec les mitochondries et participe, avec le transporteur mitochondrial d’ions Zn
2+
SLC39A1/ZIP1, au contrôle de la qualité des mitochondries
(
Figure 2
)
. Or, les sites de contacts entre le réticulum endoplasmique et les mitochondries se sont révélés très importants pour la formation des autophagosomes [
8
].
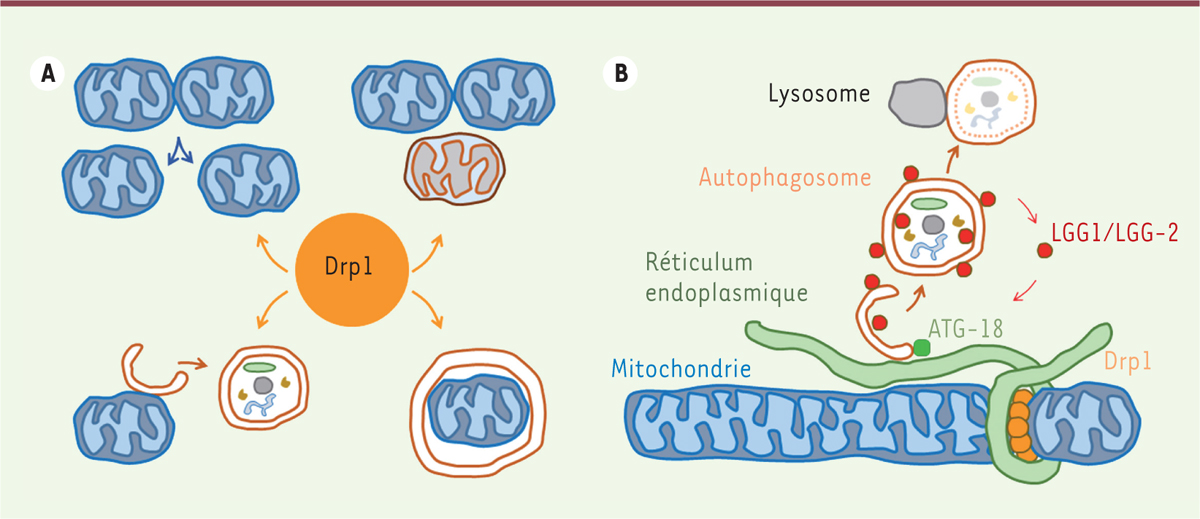
 | Figure 2.
Les différents rôles de DRP-1 dans la dynamique du réseau mitochondrial et dans l’autophagie/mitophagie. A.
La formation d’oligomères de la protéine DRP-1 à la membrane des mitochondries induit la fission mitochondriale (en haut, à gauche). Cette protéine est également impliquée dans la surveillance de la qualité des mitochondries (en haut, à droite). Elle est recrutée aux sites de contacts entre la mitochondrie et le réticulum endoplasmique, et pourrait favoriser la biogenèse de l’autophagosome (en bas, à gauche). Elle pourrait interagir directement avec les protéines de la mitophagie présentes sur les mitochondries dysfonctionnelles destinées à être dégradées (en bas, à droite).
B.
En présence d’un stress qui induit un dysfonctionnement mitochondrial, la protéine DRP-1 pourrait coordonner la fission mitochondriale, la biogenèse des autophagosomes et l’élimination des mitochondries défectueuses.
|
Nous avons constaté que les nématodes mutants chez lesquels le gène
drp-1
a été inactivé ne présentent pas de fission mitochondriale au cours du stress thermique aigu, ce qui indique que la protéine DRP-1 est nécessaire à la fragmentation mitochondriale induite par ce stress. De plus, ces mutants ont un retard de développement similaire à celui des mutants d’autophagie, sans effet additif, ce qui suggère que la protéine DRP-1 et l’autophagie agissent de concert pour rétablir le développement après un stress thermique aigu. De plus, en utilisant une souche de nématodes exprimant DRP-1::GFP, nous avons observé une colocalisation bien plus importante de DRP-1 avec les mitochondries et les marqueurs des autophagosomes après un stress thermique aigu, ce qui est en faveur d’un rôle direct de DRP-1 dans la biogenèse des autophagosomes. En effet, nous avons constaté qu’après un stress thermique aigu, les animaux mutants dépourvus de DRP-1 présentent des amas anormaux d’autophagosomes qui s’amalgament avec les mitochondries, formant une structure membranaire entourant partiellement des contenus cytoplasmiques. Nous avons exclu la possibilité d’une conséquence indirecte due à la taille anormale des mitochondries, car le double mutant
fzo-1
,
drp-1
, chez lequel le réseau mitochondrial est plus fragmenté, présente un défaut similaire à celui observé chez le mutant
drp-1
. Nous avons donc montré que la protéine DRP-1 est impliquée dans la formation d’autophagosomes contribuant à la réponse adaptative de la larve du nématode
C. elegans
à un stress thermique aigu.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Dokladny
K
,
Myers
OB
,
Moseley
PL
.
Heat shock response and autophagy: cooperation and control.
.
Autophagy.
2015;
;
11
:
:200.
–
213
.
2.
Bar-Ziv
R
,
Frakes
AE
,
Higuchi-Sanabria
R
,
et al.
Measurements of physiological stress responses in C. elegans.
.
J Vis Exp.
2020
;
10.3791/61001
.
3.
Kumsta
C
,
Hansen
M
.
Hormetic heat shock and HSF-1 overexpression improve C. elegans survival and proteostasis by inducing autophagy.
.
Autophagy.
2017;
;
13
:
:1076.
–
1077
.
4.
Chen
Y
,
Leboutet
R
,
Largeau
C
,
et al.
Autophagy facilitates mitochondrial rebuilding after acute heat stress via a DRP-1-dependent process.
.
J Cell Biol.
2021;
;
220
:
:e201909139.
.
5.
Leboutet
R
,
Chen
Y
,
Legouis
R
,
et al.
Mitophagy during development and stress in C. elegans.
.
Mech Ageing Dev.
2020;
;
189
:
:111266.
.
6.
Youle
RJ
,
van der Bliek
AM
.
Mitochondrial fission, fusion, and stress.
.
Science.
2012;
;
337
:
:1062.
–
1065
.
7.
Chen
Y
,
Culetto
E
,
Legouis
R
.
The strange case of Drp1 in autophagy: Jekyll and Hyde?
BioEssays.
2022
;
:e2100271.
.
8.
Hamasaki
M
,
Furuta
N
,
Matsuda
A
.
et al.
Autophagosomes form at ER-mitochondria contact sites.
.
Nature.
2013;
;
495
:
:389.
–
393
.
|