La mitose, le processus qui permet à une cellule eucaryote de se diviser en deux cellules filles possédant le même patrimoine génétique, est nécessaire à la croissance et au renouvellement des tissus. Avant le début de la mitose, le matériel génétique qui a été dupliqué s’organise en chromosomes constitués chacun de deux chromatides sœurs portant la même information génétique. La redistribution équilibrée des chromosomes entre les deux cellules filles nécessite la formation d’une structure nouvelle, le fuseau mitotique, constitué de microtubules issus des deux centrosomes disposés symétriquement dans la cellule en cours de division ( Figure 1 ) . Les microtubules, dits kinétochoriens, vont capturer les chromosomes et permettre leur alignement à l’équateur de la cellule. Lorsque les chromosomes sont parfaitement ancrés aux microtubules et alignés, les chromatides sœurs sont entraînées aux pôles opposés de la cellule au fur et à mesure de la dépolymérisation des microtubules. La cellule va ensuite se scinder à l’équateur pour constituer deux cellules filles distinctes. Toute anomalie de la répartition des chromosomes lors de ce processus aboutira à un dysfonctionnement plus ou moins grave des cellules filles, entraînant souvent leur mort programmée (par apoptose).
| Figure 1.
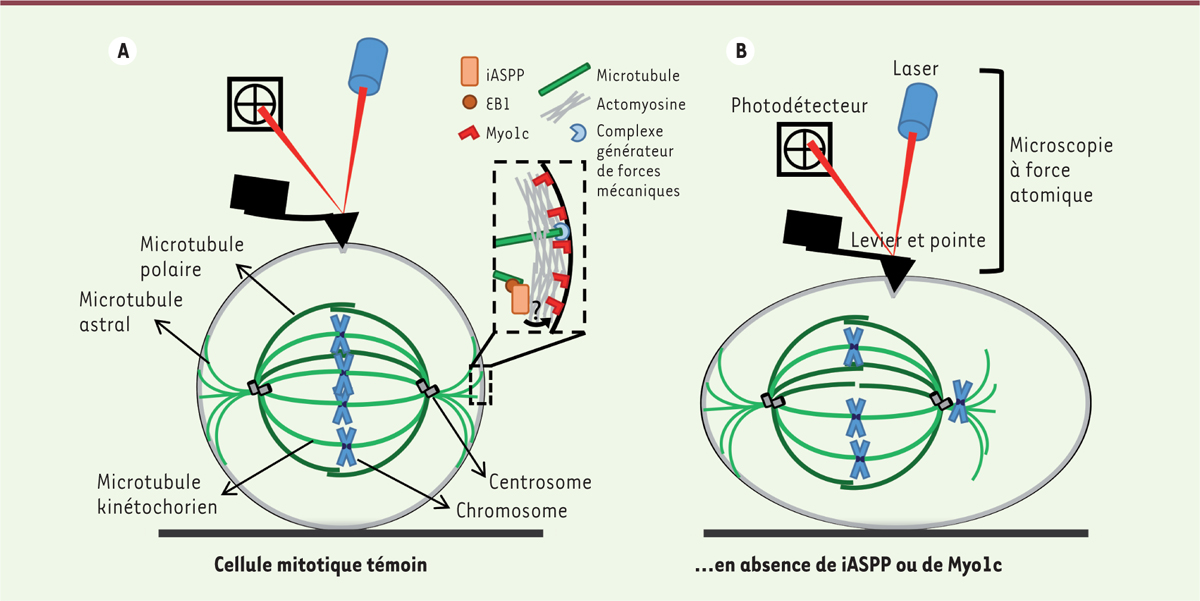
Les protéines iASPP et myosine 1c favorisent la rigidité et l’arrondissement des cellules mitotiques. A.
Lors de leur entrée en mitose, les cellules se détachent de leur support et s’arrondissent. Cela requiert, notamment, la rigidification du cortex d’actomyosine et son association à la membrane plasmique. Les protéines iASPP et myosine 1c (Myo1c) contribuent à la rigidification des cellules mitotiques. Les propriétés de Myo1c lui permettent de lier la membrane plasmique au cortex sous-jacent. La protéine iASPP est capable de s’associer à Myo1c, mais son mode d’action reste à préciser à l’échelle moléculaire.
B.
En l’absence de iASPP ou de Myo1c, la cellule perd en rigidité, comme l’atteste l’analyse par microscopie à force atomique (mesure, à l’aide d’un rayon laser, de la déviation d’un micro-levier terminé par une pointe nanométrique qui vient indenter la région corticale). Les microtubules astraux perdent leur ancrage cortical à l’un des deux pôles de la cellule mitotique, plus lâche et plus allongée, ce qui crée une dissymétrie des forces exercées par l’intermédiaire de ces microtubules astraux. Les défauts d’organisation du fuseau mitotique peuvent entraîner diverses anomalies de répartition des chromosomes, un phénomène qu’aggraveront les contraintes externes de l’environnement tissulaire.
|
Afin de constituer l’environnement optimal pour l’organisation et le positionnement du fuseau mitotique, les cellules adhérentes doivent d’abord se détacher de leur support. Puis, sous l’effet conjugué d’une augmentation de la pression osmotique intracellulaire et de la rigidification du cortex cellulaire, qui induisent des forces de résistance opposées, la cellule prend une forme sphérique ( Figure 1A ) [ 1 ]. Lorsqu’on empêche la cellule de s’arrondir en exerçant sur elle des contraintes mécaniques externes, la division cellulaire est perturbée, certains chromosomes restant hors de portée des microtubules [ 2 ]. La rigidité du cortex cellulaire dépend des propriétés biomécaniques du réseau de filaments d’actine et de myosine situé directement sous la membrane plasmique, notamment de la tension produite par la myosine sur ce réseau, mais aussi de son association étroite avec la membrane plasmique. Ainsi, la perturbation du lien entre membrane plasmique et cortex d’actomyosine - par l’élimination de la protéine « linker » moésine - dans les cellules S2 de drosophile suffit à empêcher la rigidification du cortex cellulaire, avec pour conséquences diverses anomalies du fuseau mitotique et de la ségrégation des chromosomes durant la mitose [ 3 , 4 ].
Le fuseau mitotique est amarré à la membrane plasmique par l’intermédiaire d’autres microtubules émanant des centrosomes, appelés microtubules astraux ( Figure 1A ) . Des complexes moléculaires spécifiques font le lien entre l’extrémité des microtubules astraux et la membrane plasmique, exerçant des forces de traction de part et d’autre du fuseau, ce qui permet de positionner celui-ci au centre de la structure sphérique, perpendiculairement au futur plan de division cellulaire.
Plusieurs études ont montré qu’une famille de protéines, les +TIP ( plus end tracking proteins ), forment des complexes associés à l’extrémité la plus dynamique (« extrémité + ») des microtubules, qui ancrent les microtubules kinétochoriens aux chromosomes et les microtubules astraux à la périphérie de la cellule mitotique. Parmi les partenaires de liaison de la protéine EB1 ( end-binding protein 1 ), archétype de cette famille, que nous avions précédemment identifiés [ 5 ], nous nous sommes plus particulièrement intéressés à la protéine iASPP ( inhibitor of apoptosis stimulating proteins of p53 ). Cette protéine est un inhibiteur du suppresseur de tumeur p53. Elle est surexprimée dans de nombreux cancers et est considérée comme un oncogène potentiel. Nous avons montré que lorsqu’on inhibe l’expression de iASPP, par des ARN interférents, dans des cellules cancéreuses en culture, les cellules en mitose forment un fuseau mitotique d’apparence normale, mais qui n’est plus positionné symétriquement au centre de la cellule ( Figure 1B ) . La réintroduction de iASPP dans ces cellules permet le recentrage du fuseau, sauf dans le cas où une modification génétique de cette protéine l’empêche de se lier à EB1. Un examen par microscopie de haute résolution montre qu’en l’absence de iASPP, le fuseau n’est arrimé à la membrane plasmique (par l’intermédiaire des microtubules astraux) qu’à un seul pôle de la cellule, ce qui aboutit à un déséquilibre des forces exercées sur le fuseau et à son positionnement asymétrique [ 6 ].
Nous avons ensuite recherché des partenaires de liaison de iASPP susceptibles d’influencer l’ancrage des microtubules astraux au cortex cellulaire, et avons ainsi identifié la myosine 1c, qui fait partie d’une famille de protéines dont une fonction serait d’unir la membrane plasmique au cortex d’actine sous-membranaire, tout comme la moésine dans les cellules S2 de drosophile. Nous avons montré que l’extinction de l’expression de cette myosine provoque les mêmes défauts de positionnement du fuseau mitotique et d’ancrage des microtubules astraux que ceux provoqués par l’extinction de l’expression de iASPP, renforçant l’idée que ces deux protéines contribuent au même mécanisme.
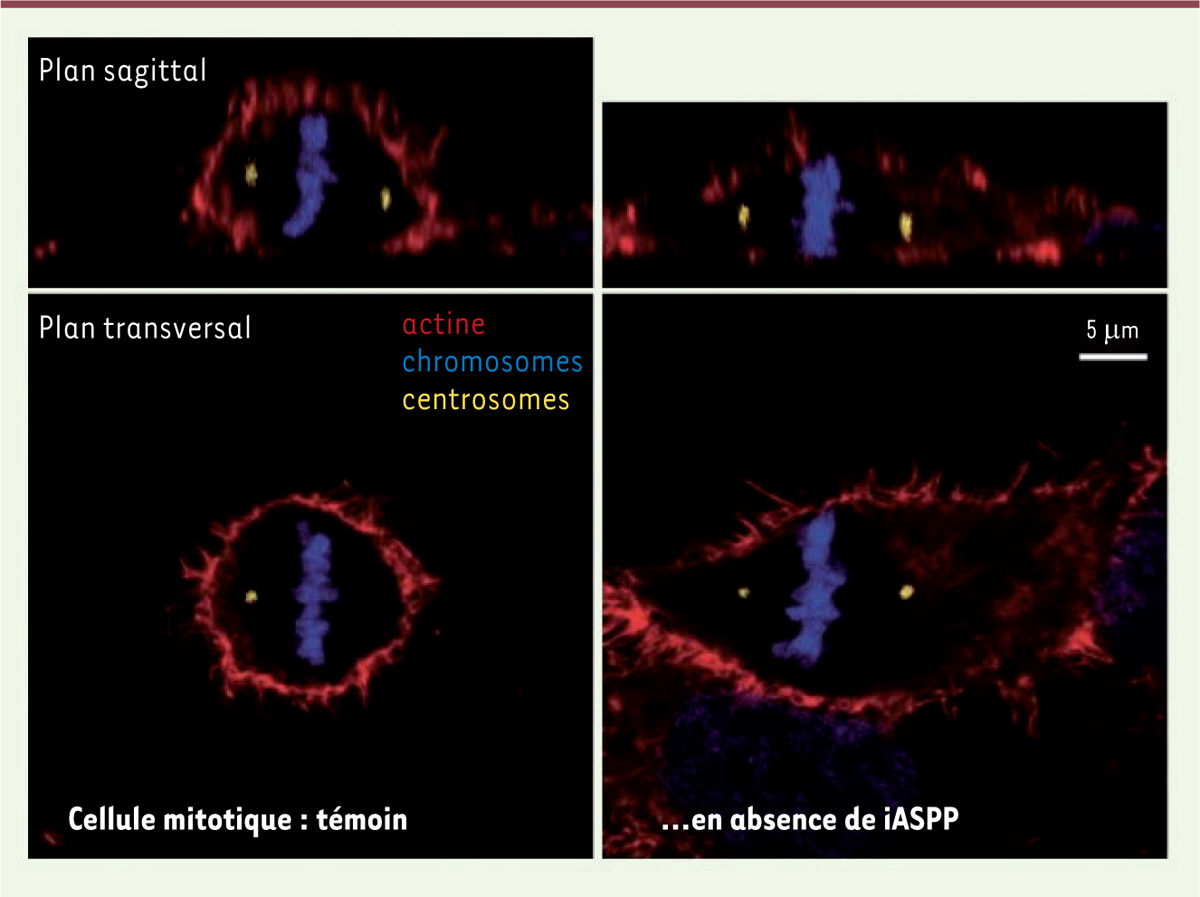
L’analyse des propriétés biomécaniques des cellules en mitose par microcopie à force atomique a montré que l’extinction de l’expression de iASPP ou de la myosine 1c entraîne une moindre rigidité du cortex. Moins rigides, les cellules en mitose sont incapables d’adopter une forme sphérique, et apparaissent à la fois plus plates et plus étirées ( Figure 2 ) . L’allongement des cellules (alors que la taille du fuseau est quasiment inchangée) et le défaut de rigidité du cortex auquel s’ancrent les complexes corticaux produisant une force mécanique sont vraisemblablement à l’origine du défaut d’arrimage des microtubules astraux.
| Figure 2.
La protéine iASPP contribue à l’arrondissement des cellules mitotiques.
L’analyse des cellules HeLa (issues d’un adénocarcinome du col utérin) par microcopie confocale à fluorescence montre l’impact de l’inhibition de l’expression de iASPP (par des ARN interférents) sur la forme des cellules en mitose. Le marquage fluorescent de l’actine permet de visualiser le contour de la cellule, le marquage des centrosomes, de visualiser les pôles du fuseau mitotique, le marquage des chromosomes, de vérifier que la cellule est en mitose. La disposition des chromosomes dans le plan équatorial de la cellule est caractéristique de la métaphase, la phase de la mitose qui précède la ségrégation des chromosomes entre les deux cellules filles issues de la division de la cellule mère.
|
Si l’action de iASPP et de la myosine 1c reste à préciser à l’échelle moléculaire, cette étude a révélé de nouveaux acteurs dans le processus qui fournit l’environnement adéquat pour la répartition symétrique des chromosomes entre les deux cellules filles lors de la mitose. Elle complète d’autres études récentes montrant que la version oncogénique de la protéine Ras [ 7 ], une protéine mutée dans de nombreux cancers, et la vimentine [ 8 ], fréquemment surexprimée dans les tumeurs, augmentent la rigidité et la sphéricité des cellules en mitose, leur permettant ainsi de mieux résister à des contraintes mécaniques externes et d’éviter de graves anomalies de la mitose. Ces résultats suggèrent donc que les oncogènes contribuent à l’acquisition de propriétés biomécaniques favorisant le maintien de la sphéricité des cellules mitotiques, donc la division cellulaire sans erreur, même lorsque les propriétés mécaniques de l’environnement tissulaire sont défavorables, par exemple lors de la formation de métastases à distance de la tumeur d’origine. Ainsi, des approches qui cibleraient ce processus de rigidification des cellules cancéreuses en mitose, ce qui conduirait à une division anormale et à une mort cellulaire, pourraient compléter l’arsenal thérapeutique visant à endiguer la prolifération des cellules tumorales.