Au cours du développement du système nerveux central, la formation des synapses neuronales (ou synaptogenèse) fait suite à l’élongation de l’axone et à l’exploration de l’environnement par le cône de croissance axonal. Après la reconnaissance du neurone cible, la synaptogenèse débute avec la différenciation des éléments pré- et post-synaptiques [ 1 ]. Les vésicules synaptiques contenant le neurotransmetteur ( e.g. , l’acide γ-aminobutyrique (GABA) pour les synapses inhibitrices GABAergiques, ou le glutamate pour les synapses excitatrices glutamatergiques) s’accumulent progressivement dans l’élément présynaptique, tandis que les récepteurs du neurotransmetteur ( e.g. , le récepteur GABA A , ou les récepteurs AMPA et NMDA du glutamate), qui diffusaient librement dans la membrane plasmique du neurone cible, se concentrent dans l’élément post-synaptique en se liant à des molécules d’échafaudage (géphyrine pour les synapses inhibitrices, ou PSD95 pour les synapses excitatrices), qui les ancrent au cytosquelette sous-membranaire [ 1 ]. La différenciation et l’adéquation des éléments pré- et post- synaptiques impliquent des molécules d’adhérence trans-synaptique : parmi elles, les neuroligines post-synaptiques, qui interagissent avec les neurexines pré-synaptiques, et les protéines post-synaptiques de la famille Slit- et Trk- like , qui se lient à des protéines pré-synaptiques à activité tyrosine phosphatase [ 1 , 2 ].
Les connexions synaptiques sont produites en surnombre et le mécanisme par lequel les synapses surnuméraires sont éliminées au cours du développement est mal compris. Seules les synapses actives, capables de libérer le neurotransmetteur, sont maintenues [ 1 , 3 ]. Le neurotransmetteur GABA et son récepteur post-synaptique GABA A sont impliqués de manière activité-dépendante dans la stabilisation et l’élagage des synapses GABAergiques [ 3 ]. L’adénosine triphosphate (ATP) et l’adénosine, un produit de transformation de l’ATP, sont libérés avec le GABA dans la fente synaptique [ 4 ] et activent, dans les neurones de l’hippocampe, surtout les récepteurs métabotropiques A 2A et A 1 de l’adénosine, des récepteurs de la membrane synaptique couplés à des protéines Gs et Gi, dont la fonction est de contrôler le niveau intracellulaire d’AMP cyclique, et ainsi, l’activité de la protéine kinase A (PKA) [ 5 ]. Nous avons étudié le rôle de la signalisation par l’adénosine dans la stabilisation et l’élimination des synapses GABAergiques naissantes.
Pour être impliquée dans la synaptogenèse, une molécule ou une voie de signalisation doit répondre à plusieurs critères : 1) elle doit être opérante pendant la fenêtre temporelle de la synaptogenèse ; 2) le blocage de son activité ou sa suppression doivent avoir un impact majeur sur le nombre des synapses ; 3) elle doit interagir avec d’autres molécules déjà impliquées dans la synaptogenèse ; et 4) le mécanisme sous-jacent doit dépendre de l’activité neuronale [ 1 ]. Nous avons cherché à savoir si la signalisation par l’adénosine répondait à ces critères.
Nous avons montré qu’il existe, chez la souris, entre 5 et 16 jours de vie post-natale, c’est-à-dire pendant la période de synaptogenèse, une augmentation transitoire de la libération d’ATP et d’adénosine dans l’hippocampe, qui dépend de l’activité neuronale [ 6 ]. Cela s’accompagne d’une expression accrue de l’enzyme de conversion de l’AMP en adénosine (CD73) et du récepteur A 2A de l’adénosine, mais pas de son récepteur A 1 [ 6 ]. Une analyse morphologique des neurones de l’hippocampe en culture in vitro , par microscopie optique de super-résolution, et ex vivo , par microscopie électronique, a révélé que les récepteurs A 2A s’accumulent à la périphérie de la densité post-synaptique des synapses inhibitrices GABAergiques pendant cette période clé du développement, alors que ces récepteurs sont principalement situés à distance de la synapse dans des neurones matures [ 6 ]. Ces résultats nous ont conduits à proposer que le récepteur A 2A et son ligand, l’adénosine, jouent un rôle particulier dans la formation des synapses GABAergiques [ 6 ].
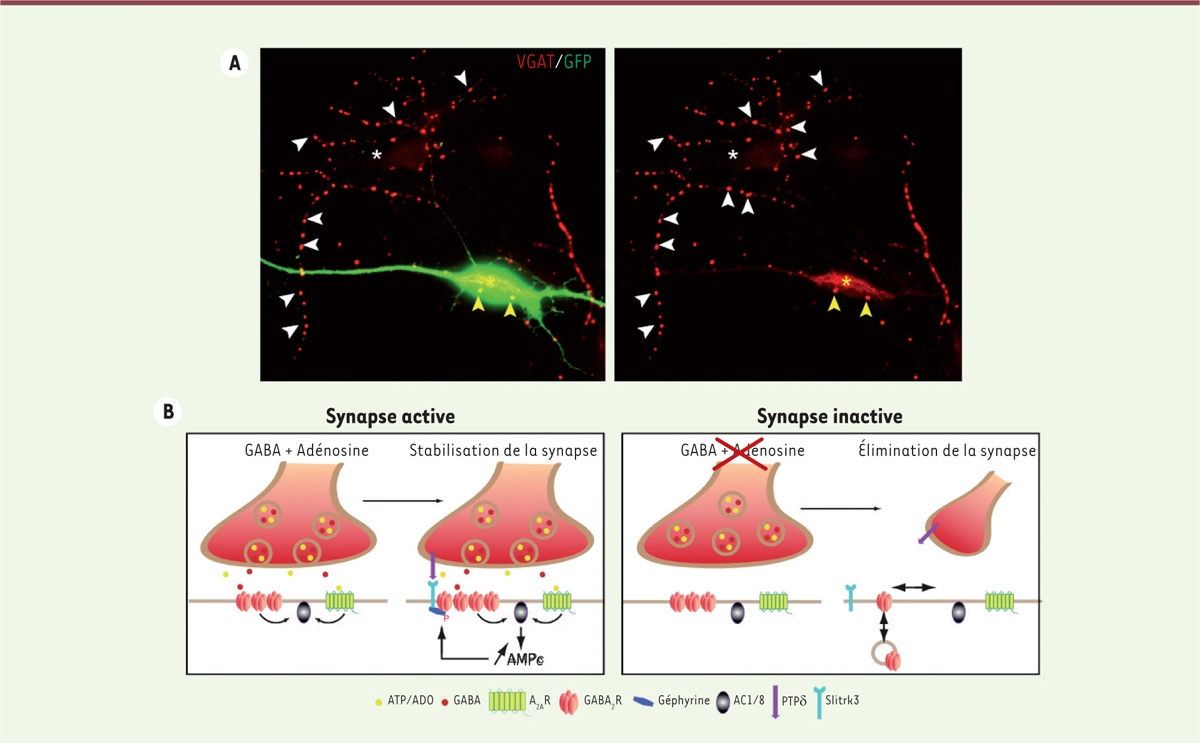
Nous avons montré que les récepteurs A 2A contrôlent le destin des synapses GABAergiques. La suppression des récepteurs A 2A , en utilisant la technique shRNA ( small hairpin RNA ), leur blocage pharmacologique, ou l’élimination de l’adénosine ambiant, entraînent la déstabilisation des sites pré- et post-synaptiques ( Figure 1A ) . Une réduction de la fréquence des courants synaptiques inhibiteurs dans les tranches d’hippocampe pré-traitées avec un antagoniste du récepteur A 2A est par ailleurs enregistrée [ 6 ]. En suivant en vidéomicroscopie le devenir des synapses actives – celles capables de recycler par endocytose le neurotransmetteur libéré par exocytose –, nous avons montré qu’elles sont dépendantes de la présence de l’adénosine. Nous avons ensuite constaté que si les récepteurs A 2A restaient inactifs pendant plus de vingt minutes, la déstabilisation des synapses était irréversible [ 6 ]. Sachant qu’il faut trois à quatre heures pour former une nouvelle synapse [ 7 ], ce résultat suggérait que la voie de signalisation par l’adénosine est impliquée dans la stabilisation plutôt que dans la formation de nouvelles synapses inhibitrices. Nous avons alors cherché à comprendre le mécanisme moléculaire sous-jacent.
| Figure 1.
Mécanisme de stabilisation/élimination des synapses GABAergiques naissantes. A.
Images montrant un neurone d’hippocampe qui a perdu ses synapses GABAergiques en l’absence du détecteur d’activité synaptique. En rouge : les synapses GABAergiques marquées avec un anticorps dirigé contre le transporteur vésiculaire du GABA (VGAT) ; en vert : un neurone transfecté (exprimant la protéine fluorescente GFP) dans lequel le récepteur A
2A
a été supprimé par inactivation du transcrit avec un shRNA. Le neurone qui n’exprime plus le récepteur A
2A
n’a que quelques connexions synaptiques (flèches jaunes) autour de son corps cellulaire (étoile jaune). En revanche, un neurone non fluorescent situé à proximité du neurone fluorescent et qui exprime le récepteur A
2A
présente un grand nombre de synapses (flèches blanches) autour de son corps cellulaire (étoile blanche) et le long de ses ramifications.
B..
Schéma montrant, dans la synapse naissante active (à gauche), la libération conjointe d’ATP et de GABA : la transformation locale d’ATP en adénosine active les récepteurs A
2A
(A
2A
R), tandis que le GABA active les récepteurs GABA
A
(GABA
A
R), et les deux voies de signalisation convergent au niveau de l’adényl cyclase sensible à la Ca
2+
-calmoduline. L’AMPc ainsi produit va à son tour stabiliser la synapse
via
le recrutement des molécules trans-synaptiques Slitrk3 par la géphyrine phosphorylée sur le résidu sérine en position 303 (Ser303). Dans la synapse inactive (à droite), en l’absence de libération d’ATP et de GABA, cette voie n’est pas activée et la synapse est rapidement éliminée. ATP : adénosine triphosphate ; ADO : adénosine ; GABA : acide γ-aminobutyrique ; A
2A
R : récepteur de l’adénosine de type 2A ; GABA
A
R : récepteur GABA de type A ; VDCC : canal calcique dépendant du voltage ; AC1/8 : adényl cyclases 1/8 ; PTPδ : protéine tyrosine phosphatase δ ; Slitrk3 : membre 3 de la famille Slit- et Trk-like.
|
On savait que le GABA et les récepteurs GABA A activés ont un rôle similaire dans la stabilisation des synapses inhibitrices naissantes [ 3 ]. Dans le cerveau en développement (jusqu’à la deuxième semaine postnatale chez la souris), la transmission synaptique impliquant le récepteur GABA A est excitatrice [ 8 ] et pourrait contrôler divers processus développementaux : migration et différenciation neuronale, neuritogenèse et synaptogenèse [ 8 ]. L’activation de ce récepteur induit l’ouverture de canaux calciques dépendants du potentiel de membrane et l’influx d’ions calcium dans le neurone, ce qui stabiliserait la synapse nouvellement formée par un mécanisme inconnu. Nous avons voulu savoir si les récepteurs A 2A et GABA A étaient interchangeables pour stabiliser les synapses. Nous avons constaté que l’activation des récepteurs A 2A est nécessaire et suffisante pour la stabilisation des synapses GABAergiques : l’activation des récepteurs GABA A n’est pas requise tant que les récepteurs A 2A restent activés [ 6 ]. Ainsi, le récepteur GABA A agirait en amont de la voie de signalisation couplée au récepteur A 2A . Nous avons ensuite montré que la voie de signalisation des récepteurs GABA A converge avec celle des récepteurs A 2A à l’étape des adényl cyclases stimulées par la calmoduline Ca 2+ -dépendante pour produire de l’AMP cyclique. En effet, l’activation simultanée des récepteurs A 2A et GABA A avait des effets additifs sur la production d’AMP cyclique [ 6 ]. Ainsi, l’adényl cyclase agit comme un détecteur de coïncidence de l’activité des récepteurs A 2A et GABA A pour stabiliser les synapses. L’AMP cyclique produit par l’activation de ces récepteurs active la protéine kinase A, qui phosphoryle ensuite la géphyrine, qui, à son tour, stabilise les synapses GABAergiques en ancrant au cytosquelette, d’une part les récepteurs GABA A , et, d’autre part, les molécules d’adhérence trans-synaptique Slitrk3, qui sont reliées à l’élément pré-synaptique par leur liaison aux protéines transmembranaires pré-synaptiques PTP-δ [ 6 ].
Ces données permettent de proposer que le récepteur A 2A agit comme un détecteur d’activité de la terminaison pré-synaptique, et que la synapse est éliminée lorsque ce détecteur n’est pas activé ( Figure 1B ) . Nous avons montré que le détecteur de synapses actives est opérant pendant une fenêtre temporelle périnatale. La caféine, la drogue psychoactive la plus couramment consommée dans le monde (y compris pendant la grossesse et l’allaitement), est un bloqueur naturel du récepteur A 2A . L’exposition du fœtus ou du nourrisson à la caféine pendant la période périnatale de la synaptogenèse pourrait déclencher la suppression de certaines synapses, avec des effets délétères à long terme. Nos résultats chez la souris montrent qu’une exposition transitoire à la caféine pendant cette phase cruciale du remaniement synaptique entraîne un déficit cognitif [ 6 ]. De plus, des travaux récents ont montré l’existence, chez l’homme, d’une augmentation du nombre des récepteurs A 2A dans le cerveau âgé, qui serait impliquée dans la perte de synapses et la neurodégénérescence [ 9 , 10 ]. Reste à savoir si le mécanisme de stabilisation/élimination des synapses au cours du développement que nous avons identifié est réactivé dans des maladies neurodégénératives comme la maladie d’Alzheimer, et si le ciblage thérapeutique de ce mécanisme pourrait limiter la perte de synapses et le déclin cérébral dans cette maladie.