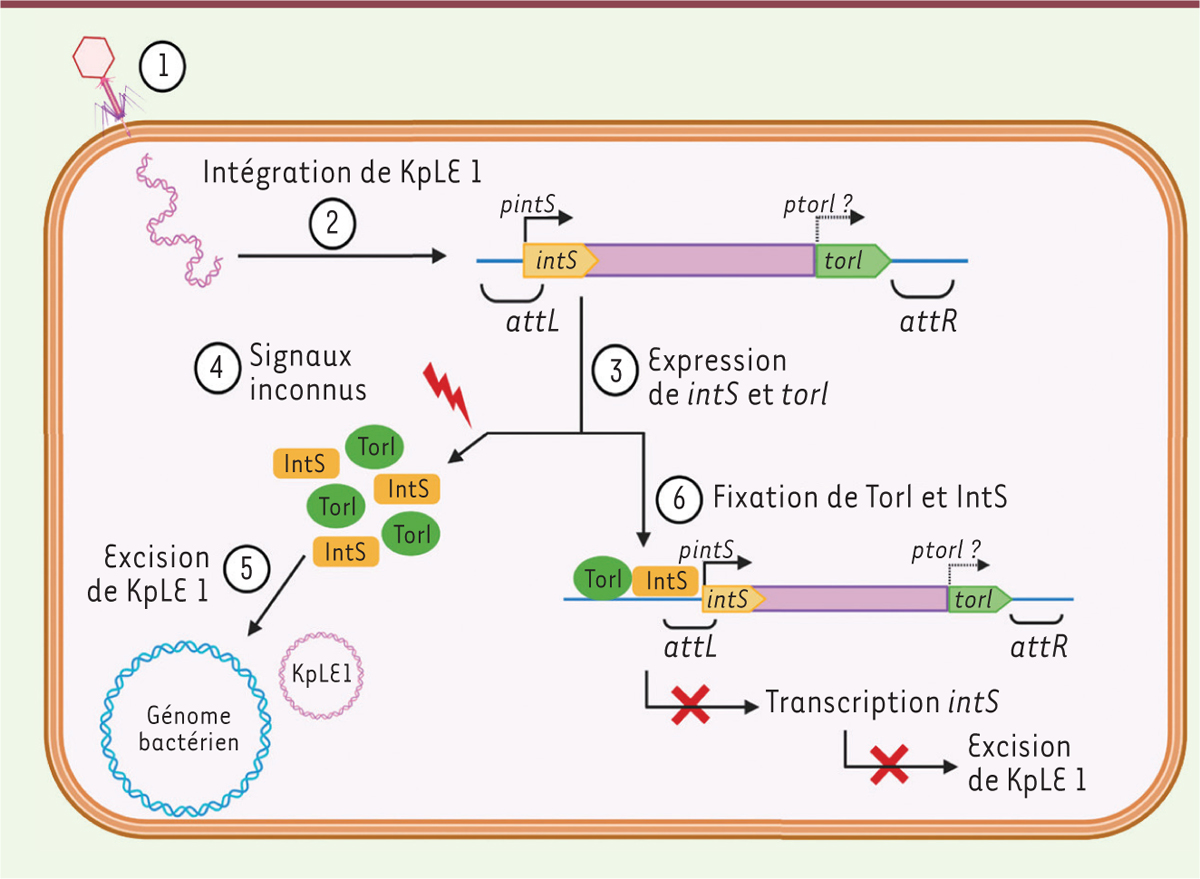
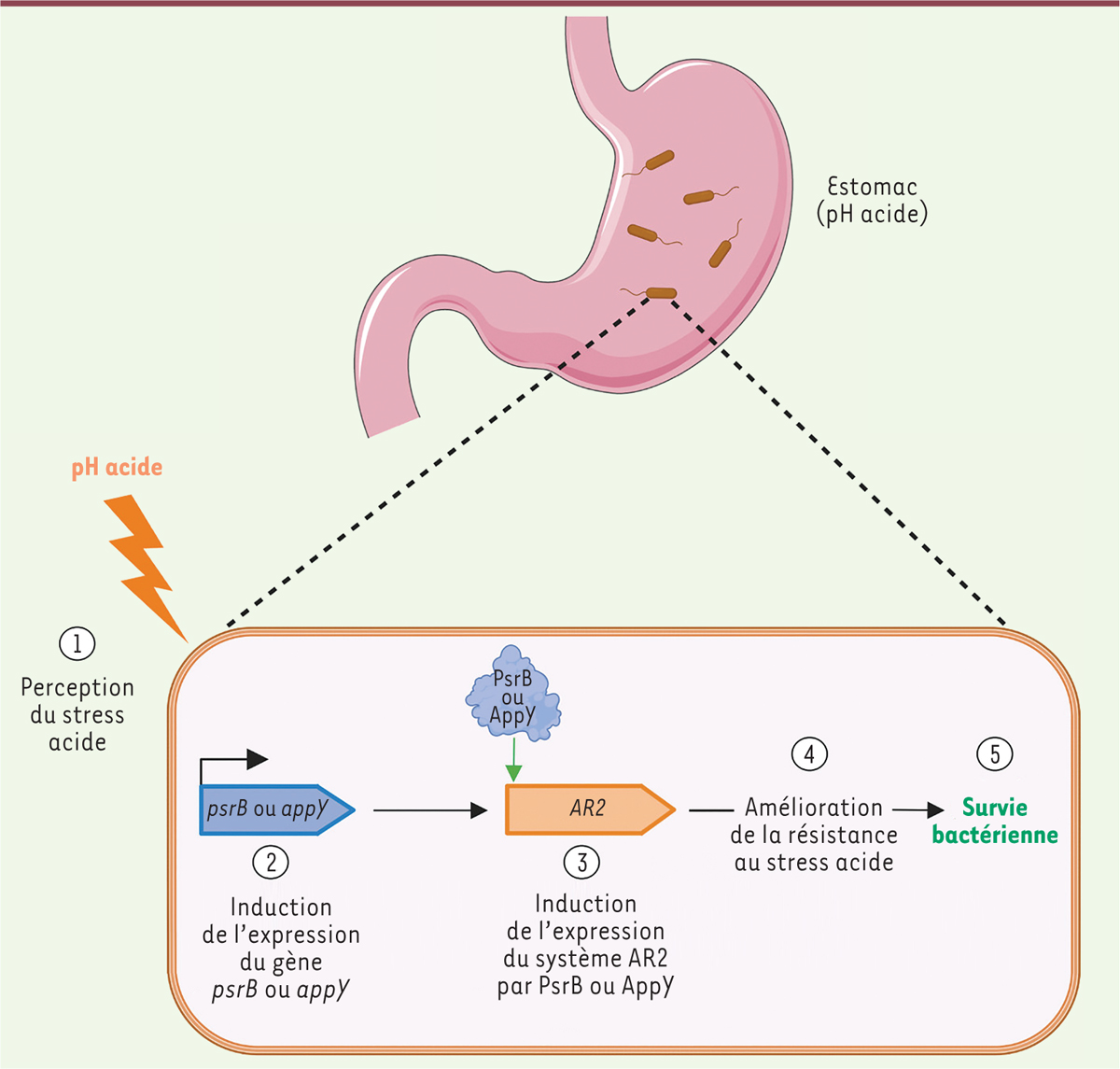
|
Entretien avec Mireille Ansaldi et Aurélia Battesti Mireille Ansaldi, directrice de recherche au CNRS, et Aurélia Battesti, maître de conférences à Aix-Marseille Université, travaillent au Laboratoire de Chimie bactérienne (LCB) de Marseille. Elles sont spécialisées dans l’étude des interconnexions qui existent entre les prophages et les génomes bactériens, d’un point de vue évolutif et mécanistique. Le collectif Phages.fr, auquel appartient Mireille Ansaldi, a reçu en 2018 le prix François Sommer Homme Nature par la Fondation Sommer. Qu’est-ce qui vous a poussées à travailler dans la recherche ? Mireille Ansaldi : Initialement, je voulais faire des études courtes. J’ai donc choisi un BTS. Après cette formation en biotechnologies, j’ai travaillé comme technicienne dans un laboratoire mais je me suis rendu compte que je souhaitais finalement continuer mes études. Je suis donc retournée à l’université et je ne me suis plus arrêtée. Aurélia Battesti : Je suis également allée à l’université sans savoir précisément quel métier je voulais exercer. Une fois en maîtrise, ma rencontre avec des professeurs de microbiologie passionnants m’a donné envie de continuer dans ce domaine. C’est lorsque je suis rentrée dans un laboratoire que j’ai compris que je voulais faire de la recherche. Quel aspect des bactériophages vous intéresse le plus ou attise le plus votre curiosité ? MA : Cette question est compliquée car la recherche sur les bactériophages présente de multiples facettes et c’est cela que je trouve passionnant. La recherche fondamentale me captive ; par exemple, je suis en train de développer un projet sur la « dark matter », c’est-à-dire les réserves de gènes que l’on peut trouver dans les organismes vivants et particulièrement dans les virus pour lesquels nous n’avons pas de classification. De plus, les applications m’enthousiasment tout particulièrement. Ainsi, une partie de mon laboratoire travaille sur des applications presque commerciales ; chaque étape entre la recherche fondamentale et les applications finales suscite un vif intérêt. Qu’est-ce que vos recherches apportent à votre enseignement, et réciproquement ? AB : C’est une vaste question ! D’une part, mon enseignement bénéficie de mon travail de recherche. J’ai la chance d’enseigner dans une unité de virologie et je peux progressivement enrichir mes cours. En effet, de par mon métier de chercheuse, je suis amenée à conduire de nombreux projets dans le laboratoire, mais aussi à consulter les derniers articles parus sur les bactériophages. Ainsi, mon travail de recherche profite à mes cours qui visent à être toujours à la page. Par ailleurs, j’adore partager et échanger avec les étudiants sur mes activités au laboratoire. D’autre part, l’enseignement représente aussi une précieuse aide pour mon travail de recherche : il peut constituer une coupure salutaire surtout lorsque je rencontre des obstacles au laboratoire. Prendre du recul aide à porter un regard neuf sur les difficultés afin de pouvoir les surmonter. Enfin, certaines questions d’étudiants me poussent à me poser des questions différemment, m’apportant un éclairage nouveau. Voilà pourquoi, enseignement et recherche sont pour moi deux activités complémentaires. Pensez-vous que les bactériophages deviendront un traitement pour faire face à la résistance aux antibiotiques en France ? AB : Je l’espère ! Les congrès portant sur les bactériophages réunissent de plus en plus de médecins, ce qui témoigne d’un intérêt grandissant pour la phagothérapie. En effet, ses applications sont toujours assez spectaculaires et constituent pour moi un véritable espoir pour l’avenir, en tant que chercheuse mais aussi en tant que citoyenne. MA : Je partage tout à fait le point de vue d’Aurélia ! Le plus compliqué, c’est d’intégrer à nouveau des médicaments qui ont été sortis de la pharmacopée. C’est particulièrement complexe car ce changement repose sur une adaptation des règlements européens sur le médicament, ce qui est en cours de discussion. Nos voisins belges ont beaucoup fait bouger les choses avec un hôpital qui pratique la thérapie phagique depuis plusieurs années déjà. Cette pratique a été autorisée par le gouvernement dans la mesure où les bactériophages ne sont pas des médicaments classiques : ce ne sont pas des molécules chimiques. J’espère vivement qu’en France, nous trouverons également un moyen pour adapter à notre tour la phagothérapie à la règlementation du médicament. Parce que, même si la phagothérapie n’est pas une solution miracle, on pense clairement que, dans certains cas, c’est une alternative ou un complément de thérapie qui permettra de faire avancer significativement les choses sur le plan des maladies infectieuses. AB : Oui, on voit que ça bouge aussi en France ! Des projets réunissent des équipes françaises qui ont trouvé des financements. Il y a ainsi un « réseau phages » qui commence à se constituer. C’est très prometteur ! Quelles découvertes vous ont rendues les plus fières ? AB : Toutes ! Je crois que quand on a consacré beaucoup de temps à un projet, à essayer de comprendre un mécanisme, une voie de régulation, on est toujours fière d’aboutir à quelque chose, d’apporter notre pierre à l’édifice et d’essayer de contribuer à la « connaissance » à notre niveau. MA : Aucune de mes découvertes ne me rend plus fière qu’une autre. J’ai quelques années de carrière et j’ai travaillé sur des sujets très différents. Je me rends compte que, finalement, aucune découverte ne l’emporte sur une autre ; je suis passionnée à l’heure actuelle comme je l’étais il y a 20 ans. Quels sont vos projets pour l’avenir à moyen terme dans vos recherches scientifiques ? MA : Pour moi, la réponse est facile : mon métier actuel consiste à écrire des projets, ce qui occupe quasiment tout mon temps. Mes projets à l’heure actuelle sont concentrés autour du minage de la « dark matter » : arriver à comprendre quels sont ces gènes nouveaux dont on connaît déjà parfois, mais pas toujours, les fonctions. Je pense qu’il y a encore énormément de choses à trouver dans cette « dark matter », comme cela a été le cas avec la découverte des anti-CRISPR codés par les bactériophages permettant de contrôler l’activité CRISPR. C’est pourquoi j’essaye de concrétiser, avec des collègues européens, des projets qui allient différents aspects de prédictions qui pourraient conduire à de nouvelles pistes que d’autres laboratoires plus expérimentaux pourraient alors tester. C’est là un projet qui me tient vraiment à cœur pour les années à venir ! AB : Travaillant dans le laboratoire de Mirelle, j’étudie l’apport de prophages : ce sont des phages qui sont intégrés dans le chromosome bactérien participant à la physiologie bactérienne. Ainsi, j’essaye de comprendre comment des gènes d’origine phagique peuvent aider la bactérie à survivre dans certaines conditions de stress. Actuellement, j’étudie plus particulièrement des régulateurs transcriptionnels d’origine phagique. Grâce à de nombreuses collaborations au sein du laboratoire, des analyses globales ont pu être développées, en utilisant par exemple le RNA-Seq et le Chip-Seq. Nous avons déjà étudié deux régulateurs transcriptionnels et évalué leur impact sur la physiologie bactérienne. Donc, mon projet consiste à continuer dans cette voie-là, continuer à comprendre comment ces gènes d’origine virale peuvent faire évoluer le génome bactérien. Quels sont, selon vous, les moyens de communication les plus efficaces pour sensibiliser le grand public aux sciences ? MA : Je pense qu’il n’y a pas de formule magique. Sensibiliser le grand public, c’est déjà en avoir envie. Ce n’est pas qu’une question de moyen ou de média, c’est d’abord une volonté, une envie particulière de communiquer avec le public. Moi, ça fait des années que je fais des interventions pour le public. J’ai commencé à destination des plus jeunes : dans les écoles maternelles et primaires. Je me suis beaucoup investie dans le laboratoire en participant au programme « Diffusons la science » pendant la période Covid. Communiquer me passionne. Le défi majeur est alors de vulgariser, c’est-à-dire raconter ce que je fais avec des mots simples. Le plus agréable est de constater que l’auditoire parvient à comprendre des notions qui lui sont au départ étrangères, ou la plupart du temps inaccessibles car les médias n’en parlent pas. Outre le contenu scientifique, l’oralité et le contact avec le public sont aussi pour moi extrêmement importants. Que pensez-vous de la place des femmes dans le monde de la recherche scientifique ? MA : Là aussi, c’est une question un peu complexe, présentant de multiples facettes. Comme je fais partie de différentes instances du CNRS, je suis bien placée pour mesurer la place des femmes dans le monde de la recherche scientifique : c’est très simple, plus le poste est élevé, plus la part des femmes se réduit. Toutefois, cela varie également en fonction des disciplines. Par exemple, en sciences biologiques, nous sommes particulièrement mauvais à cet égard. En effet, la grande majorité des postes de techniciens ou d’ingénieurs sont occupés par des femmes ; elles sont déjà moins nombreuses comme chercheuses et quasiment inexistantes dans les postes de directeurs de recherche, voire directeurs de recherche classe exceptionnelle. Le plafond de verre saute aux yeux. Pour le briser, le CNRS, comme d’autres organismes de recherche, a mis en place des plans sur l’égalité des chances et sur les opportunités femmes/hommes dans les carrières, mais cela progresse bien doucement, doucement, doucement … AB : La bonne nouvelle, c’est que nous sommes ici deux femmes et que Mireille est cheffe d’équipe, directrice de recherche et co-directrice du LCB ! Donc c’est prometteur, c’est un exemple inspirant et encourageant pour la suite.
|