| |
| Med Sci (Paris). 38(5): 453–456. doi: 10.1051/medsci/2022053.Les mini-cerveaux vous observent-ils ? Gaël Orieux1 and Olivier Goureau1* 1Institut de la vision, Sorbonne Université, Inserm, CNRS, 17 rue Moreau, F-75012Paris, France |
Vignette (marquage des photorécepteurs cônes et bâtonnets d’un organoïde de rétine dérivé de hPSC - © Amélie Rodrigues). Depuis la découverte par l’équipe de Shinya Yamanaka, lauréat en 2012 du prix Nobel de physiologie ou médecine, d’un processus permettant la génération de cellules souches pluripotentes (CSP) dites « induites », ou cellules iPS [1], à partir de cellules somatiques, ce domaine de recherche s’est considérablement développé. L’utilisation de ces cellules a été à l’origine, notamment, du développement de procédures permettant de créer des ébauches d’organes humains miniatures, appelés organoïdes. Ces structures sont constituées de différents types de cellules, issues de la différenciation des CSP, que l’on retrouve dans les véritables organes. Leur assemblage et leur organisation spatiale autonome constituent l’une des caractéristiques de ces « mini-organes » [2] (→). (→) Voir la Synthèse de J.L. Galzi et al., m/s n° 5, mai 2019, page 467 Les organoïdes dérivés de cellules iPS humaines, qui reproduisent l’architecture et certaines fonctions de leurs homologues in vivo, sont rapidement apparus comme des modèles expérimentaux intéressants et pertinents pour étudier le développement ou les maladies spécifiquement humaines. |
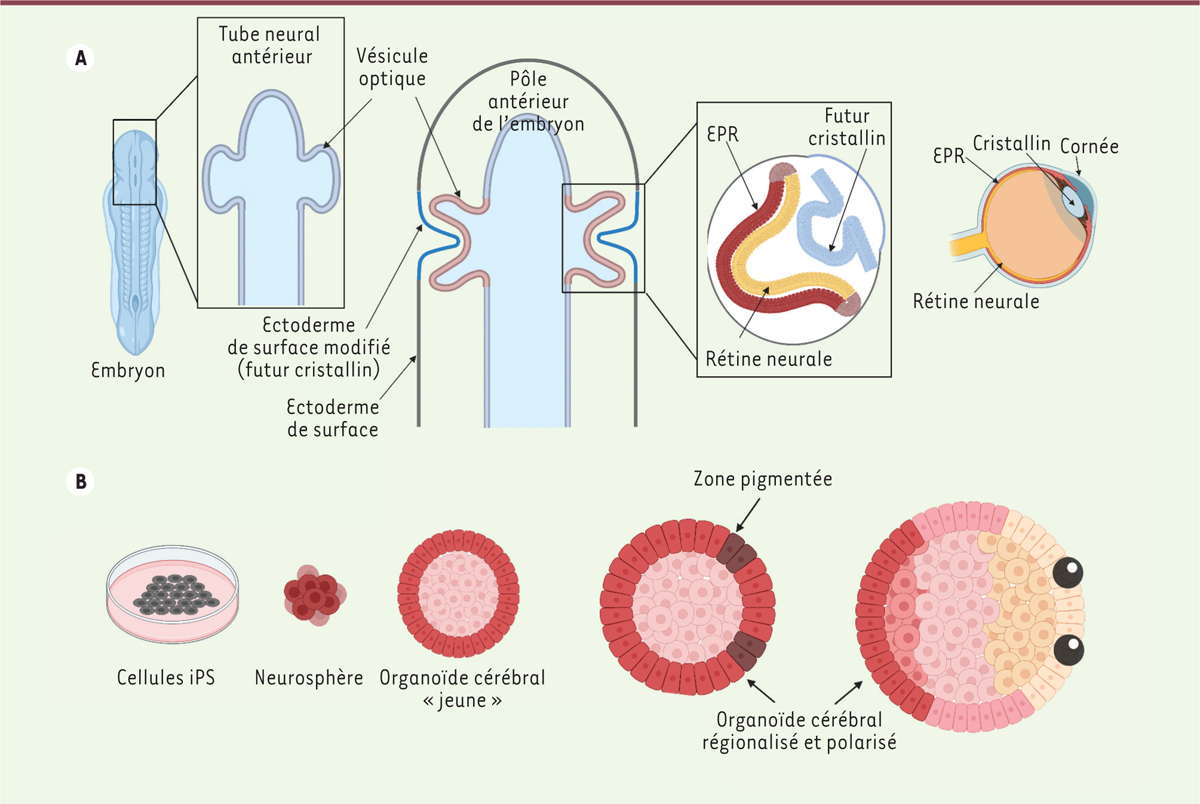
Système nerveux central et organoïdes Les études qui avaient été réalisées dans des modèles de rongeurs, de poissons ou encore d’oiseaux ont constitué le socle de connaissance permettant la compréhension du développement du système nerveux central (SNC) des vertébrés. Elles ont en effet permis d’identifier des facteurs de transcription et des facteurs diffusibles ayant un rôle de signaux instructeurs sur les cellules, qui sont hautement conservés au cours de l’évolution. La manipulation et le contrôle de ces facteurs en laboratoire ont permis de générer des organoïdes modélisant différentes régions du SNC humain, comme le cortex cérébral, l’hypothalamus, le cerveau antérieur ou la rétine. De nombreux protocoles ont ainsi été conçus, reposant la plupart sur trois étapes successives : 1) la formation de corps embryoïdes (des agrégats de CSP en cours de différenciation) ; 2) l’induction neurale – dirigée ou non – de ces agrégats ; puis 3) la différenciation et la maturation en tissus et types neuronaux spécifiques, par le biais de la régulation de voies de signalisation distinctes [3]. Une telle stratégie a permis de générer, à partir de cellules iPS humaines, des organoïdes de rétine qui modélisent fidèlement la stratification des principaux types cellulaires rétiniens, la différenciation des photorécepteurs étant observée dans la couche la plus externe et celle des cellules ganglionnaires rétiniennes (CGR) dans la couche basale [4] (→). (→) Voir la Synthèse de O. Goureau et al., m/s n° 6-7, juin-juillet 2020, page 626 Les axones des CGR constituent le nerf optique et projettent sur différentes régions cérébrales, donc en dehors de la rétine. Dans les organoïdes rétiniens cultivés à long terme, en l’absence de structures cérébrales associées et donc de cibles pour les CGR, celles-ci disparaissent progressivement. In vivo, différentes étapes interviennent dans le développement de l’œil. Les vésicules optiques résultent de l’évagination du tube neural antérieur – qui formera également l’encéphale – sous l’influence de facteurs de transcription et de signaux de remodelage, BMP (bone morphogenetic protein), WNT et SHH (Sonic Hedgehog), définissant un territoire oculaire [5]. Une seconde étape d’invagination donnera naissance à la cupule optique, constituée de deux couches, externe et interne, qui formeront respectivement l’épithélium pigmentaire rétinien et la neurorétine [6]. Le cristallin et la cornée seront quant à eux formés à partir de l’ectoderme de surface (Figure 1A).  | Figure 1. Formation des structures oculaires in vivo et dans les organoïdes cérébraux. A. Lors du développement embryonnaire, le tube neural antérieur (futur encéphale) présente une évagination à l’origine de deux vésicules optiques ; par interaction réciproque avec l’ectoderme de surface, les vésicules optiques vont s’invaginer pour former une structure à deux couches. L’une d’entre elles formera l’épithélium pigmentaire rétinien (EPR, en rouge), l’autre la rétine neurale (en jaune). Dans le même temps, l’épithélium de surface au contact de la vésicule optique formera le futur cristallin, puis, par la suite, la cornée. B. De gauche à droite : les cellules iPS, mises en culture en suspension et dans un milieu favorable à la formation de structures neurales, vont former de petits agrégats appelés « neurosphères ». Cultivées en présence de Matrigel et d’acétate de rétinol, ces neurosphères se différencient en organoïdes cérébraux qui vont progressivement se polariser et présenter des territoires pigmentés, avec une identité oculaire. Généralement au nombre de deux et situées au même pôle de l’organoïde, ces régions évolueront vers des structures plus complexes, contenant des cellules de l’épithélium pigmentaire rétinien (EPR), des neurones rétiniens et des cellules caractéristiques des autres tissus oculaires, comme le cristallin et la cornée (figure créée avec BioRender.com). |
Certaines équipes [7] ont récemment développé un protocole permettant d’obtenir, à partir de cellules iPS, des organoïdes oculaires composés de structures cornéennes, cristalliniennes et rétiniennes. Mais, dans ces organoïdes pourtant complexes, une perte des CGR apparaît toujours dans les cultures à long terme. Une approche originale permettant le maintien des CGR et le développement de leurs projections, consiste à former des « assembloïdes », en réalisant des co-cultures d’organoïdes d’identités distinctes. La réalisation d’assembloïdes à partir d’organoïdes rétiniens et d’organoïdes cérébraux a montré que les axones des CGR issus des organoïdes rétiniens pouvaient coloniser les organoïdes cérébraux sans toutefois présenter, à ce stade, une organisation particulière. Des assembloïdes formés à partir d’organoïdes rétiniens, thalamiques et corticaux ont néanmoins montré une innervation plus spécifique des territoires thalamiques par les CGR, et des territoires corticaux par des neurones thalamiques, mimant ainsi les voies visuelles que l’on retrouve in vivo [8]. |
Des organoïdes qui nous regardent Une nouvelle étape a été franchie il y a quelques mois, avec la publication d’une méthode permettant le développement simultané au sein d’un même organoïde de structures cérébrales et oculaires à partir de cellules iPS humaines [9] (Figure 1B). L’approche utilisée pour obtenir ce résultat inédit présente deux particularités : la faible densité de cellules iPS utilisée pour l’ensemencement initial, qui aboutit à la formation de neurosphères (des amas de cellules neurales) présentant une identité « cerveau antérieur », et l’ajout dans le milieu de culture, d’acétate de rétinol. Les cultures sont réalisées en présence de Matrigel à partir du 5e jour de culture, favorisant l’orientation et le maintien des structures cellulaires. Autour du 30e jour, apparaissent des territoires pigmentés (jamais plus de deux) qui montrent des signes d’invagination et expriment des facteurs de transcription spécifiques du lignage rétinien : RAX (retina and anterior neural fold homeobox) et VSX2 (visual system homeobox 2), un ensemble de caractéristiques propre aux vésicules optiques. Au cours de leur maturation, ces régions évolueront en deux structures juxtaposées – l’épithélium pigmentaire rétinien (EPR) et la rétine neurale – formant ainsi une véritable cupule optique au sein de l’organoïde cérébral, structure absente dans les organoïdes rétiniens classiques. Environ 60 % des organoïdes obtenus avec certaines lignées de cellules iPS, ont ainsi présenté deux structures pigmentées, ressemblant à des globes oculaires attachés à la structure du cerveau antérieur [9]. Les analyses de séquençage des ARN messagers à l’échelle d’une seule cellule ont permis de caractériser, à différents stades de développement, les différentes populations cellulaires qui composent ces organoïdes. Ces analyses ont confirmé l’existence dans la structure, de populations neuronales caractéristiques de différentes régions cérébrales (cerveau antérieur dorsal et cerveau antérieur ventral), du territoire oculaire et des vésicules optiques, dès le 30e jour de différenciation. Plus tardivement (après 60 jours de différenciation), le même type d’analyse du transcriptome révèle une maturation et une plus grande diversification cellulaire [9]. Des neurones excitateurs et inhibiteurs corticaux, des sous-types de neurones rétiniens, ainsi que des neurones de différentes régions spécifiques des voies visuelles, telles que le chiasma optique ou le corps genouillé latéral du thalamus ont ainsi été identifiés. De façon toute aussi surprenante que fascinante, l’analyse transcriptomique a également révélé la présence de signatures caractéristiques des épithéliums du cristallin et de la cornée, deux structures oculaires majeures jouant le rôle de lentille optique. Les immunomarquages ont confirmé la formation de ces structures oculaires au sein des organoïdes cérébraux, au-delà des seules structures rétiniennes [9]. Si la rétine a la même origine embryologique que le cerveau antérieur, la cornée et le cristallin dérivent de l’ectoderme de surface, ce qui suggère que le processus développemental des organoïdes cérébraux pourvus de structures oculaires intègre des étapes de développement complexes. Des enregistrements électrophysiologiques réalisés sur ces organoïdes confirment l’existence de neurones suffisamment matures pour produire des signaux électriques [9]. Certains organoïdes pourvus de vésicules optiques présentent une sensibilité à la lumière, avec des délais de réponse autour de 500 ms, une valeur compatible avec un processus de photo-transduction. L’immaturité des photorécepteurs suggère que ces réponses pourraient être celles de CGR intrinsèquement photosensibles, dont l’existence est bien connue [10]. L’intensité lumineuse nécessaire, environ 1 000 fois plus élevée que pour une véritable rétine, pourrait s’expliquer par le niveau de maturité insuffisant et un niveau d’expression relativement faible des acteurs de la cascade de photo-transduction dans les organoïdes encore en développement. |
La coexistence au sein d’un même organoïde, de types cellulaires rétiniens, de différentes régions visuelles cérébrales et d’ébauches de connexions entre ces régions, soulève la question fascinante de leur fonctionnalité réelle ou potentielle et de leur capacité à traiter des informations visuelles d’une complexité plus importante. Ce modèle unique pourrait ainsi être utilisé pour comprendre plus en détail le développement du système visuel chez l’homme et les maladies développementales qui y sont associées. L’observation qu’un grand nombre d’organoïdes présente deux structures ressemblant à des globes oculaires au même pôle de la structure constitue un autre aspect impressionnant de cette étude. La polarité et la symétrie constituent deux piliers du développement des animaux bilatériens. Si la plupart des modèles organoïdes actuels présentent une régionalisation, l’observation d’une véritable polarité est rare, et celle d’une symétrie encore plus. Ces organoïdes cerveau-œil représentent donc à l’heure actuelle un modèle de choix pour étudier ce processus. Les organoïdes décrits dans cette étude ne semblent viables que pendant environ 60 jours, alors que les organoïdes rétiniens ou les organoïdes cérébraux peuvent être cultivés pendant plusieurs mois. Cette limite temporelle empêche le processus développemental de se poursuivre, ce qui exclut, à l’heure actuelle, l’étude de la maturation de ces structures et des circuits qui en découlent, comme ceux permettant aux photorécepteurs matures de communiquer avec les CGR puis avec l’ensemble du système visuel ; une analyse qui n’a encore jamais pu être faite. L’adaptation des conditions de culture permettant la poursuite du développement de ces structures œil-cerveau est un nouveau défi pour ce type d’organoïde révolutionnaire. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Takahashi K, Tanabe K, Ohnuki Met al. Induction of Pluripotent Stem Cells from Adult Human Fibroblasts by Defined Factors . Cell. 2007; ; 131 : :861.–872. 2. Galzi J, Jouault T, Amédée JLes organoïdes : des mini-organes au service de la biomédecine . Med Sci (Paris). 2019; ; 35 : :467.–469. 3. Guy B, Zhang JS, Duncan LH, et al. Human neural organoids: Models for developmental neurobiology and disease . Dev Biol. 2021;; 478 : :102.–21. 4. Goureau O, Reichman S, Orieux G. Les organoïdes de rétine . Med Sci (Paris). 2020;; 36 : :626.–32. 5. Graw J.Eye Development. Curr Top Dev Biol. 2010 ; :343.–386. 6. Adler R, Canto-Soler MVMolecular mechanisms of optic vesicle development: Complexities, ambiguities and controversies . Dev Biol. 2007; ; 305 : :1.–13. 7. Isla-Magrané H, Veiga A, García-Arumí J, et al. Multiocular organoids from human induced pluripotent stem cells displayed retinal, corneal, and retinal pigment epithelium lineages . Stem Cell Res Ther. 2021;; 12 : :581.. 8. Fligor CM, Lavekar SS, Harkin J, et al. Extension of retinofugal projections in an assembled model of human pluripotent stem cell-derived organoids . Stem Cell Reports. 2021;; 16 : :2228.–41. 9. Gabriel E, Albanna W, Pasquini G, et al. Human brain organoids assemble functionally integrated bilateral optic vesicles . Cell Stem Cell. 2021;; 28 : :1740.–57.e8. 10. Do MTHMelanopsin and the Intrinsically Photosensitive Retinal Ganglion Cells: Biophysics to Behavior . Neuron. 2019; ; 104 : :205.–226. |