| |
| Med Sci (Paris). 38(5): 438–444. doi: 10.1051/medsci/2022055.Rôle des intégrines dans la fibrose cardiaque Clément Delacroix1 and Jean-Sébastien Hulot1* 1Paris Centre de recherche cardiovasculaire (PARCC), Inserm U.970, 56 rue Leblanc, 75015Paris, France |
Vignette (© adaptée de MBinfo). La fibrose cardiaque se caractérise par l’accumulation de matrice extracellulaire (MEC) dans le myocarde, une matrice qui se développe généralement en réponse à une agression contre le cœur. Le développement de cette fibrose est à l’origine d’un remodelage progressif du myocarde pouvant altérer son fonctionnement et conduire à l’insuffisance cardiaque, l’une des premières causes de morbi-mortalité dans le monde, à l’origine de 70 000 décès par an en France, soit près de la moitié des décès liés aux maladies cardiovasculaires. Il est donc particulièrement important de comprendre les mécanismes qui conduisent à cette fibrose cardiaque afin d’en limiter le développement par des thérapies ciblées. Ces dernières années, des thérapies anti-fibrosantes se sont développées, d’abord contre la fibrose d’autres organes, comme le foie, le poumon ou le rein, les applications pour le cœur restant encore aujourd’hui plus marginales. Cibler les intégrines et bloquer leurs interactions avec leurs ligands sont parmi les possibles approches thérapeutiques anti-fibrosantes récemment identifiées. Les intégrines sont des protéines transmembranaires hétérodimériques constituées de deux sous-unités, a et b. Elles remplissent différentes fonctions : mécano-senseurs, mais aussi molécules d’adhérence et de transduction de signaux dans de nombreux processus physiologiques et pathologiques, tels que l’inflammation, l’angiogenèse ou la progression tumorale métastasique. Depuis ces vingt dernières années, les intégrines ont représenté une cible privilégiée dans ces maladies et des médicaments sont désormais disponibles pour traiter certaines d’entre elles : la maladie de Crohn, une maladie inflammatoire chronique de l’intestin ; la sclérose en plaque, qui touche le système nerveux [1]. |
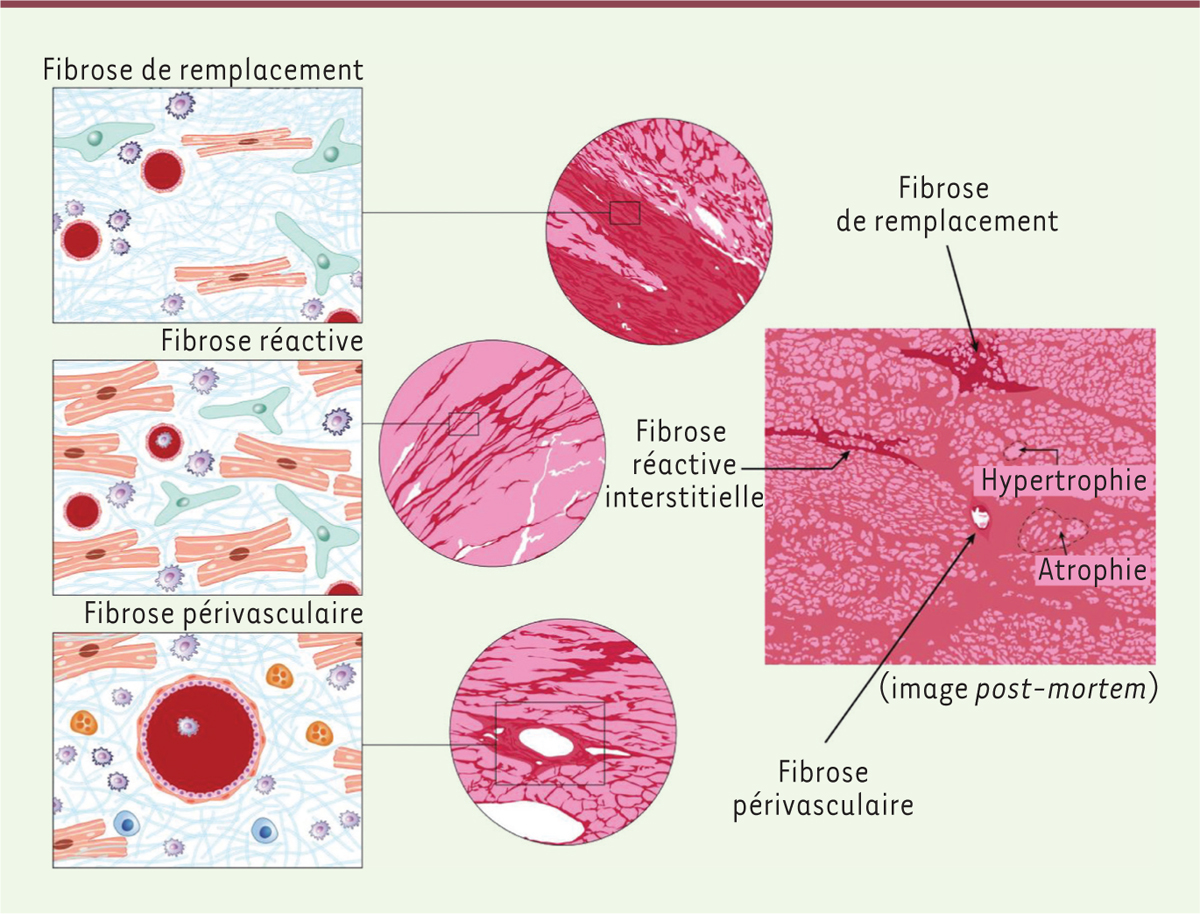
Les sources et les déterminants de la fibrose cardiaque Les différents types de fibrose La fibrose cardiaque est définie comme une accumulation de MEC (matrice extracellulaire) dans le myocarde ; cependant, cette définition est peu précise. Il existe en effet différents types de fibrose, dont l’origine implique des effecteurs et des mécanismes variés (Figure 1). En ce qui concerne la fibrose cardiaque, on distingue deux principales catégories de mécanismes fibrosants.  | Figure 1.Les différents types de fibrose. La fibrose de remplacement, plus épaisse, remplace les cardiomyocytes morts. La fibrose réactive se retrouve dans l’interstitium, autour de cardiomyocytes sains. La fibrose périvasculaire entoure l’endothélium des vaisseaux (adaptée de la figure 1 de [ 40], sous licence CC BY, http://creativecommons.org/licenses/by/4.0/). |
La première correspond à la fibrose dite de remplacement. Elle survient lorsque la MEC remplace une perte cellulaire. L’exemple typique est celui de l’infarctus du myocarde à l’origine d’une ischémie entraînant la mort de cellules, dont les cardiomyocytes, incapables de se régénérer. Les fibroblastes alors différenciés en myofibroblastes activés secrètent de la MEC, principalement composée de collagènes de type I et de type III, afin de remplacer ces cellules nécrosées et ainsi maintenir l’intégrité et la continuité du tissu. Cette fibrose de remplacement, irréversible, est considérée comme nécessaire puisqu’elle permet de prévenir la rupture cardiaque. Cependant, elle induit également des effets délétères pour le fonctionnement du cœur. Les fibres de collagène sont en effet rigides et le remplacement des cardiomyocytes par la MEC diminue la compliance cardiaque, ce qui entraîne une diminution de la fraction d’éjection du sang et une insuffisance cardiaque. Les cicatrices fibreuses perturbent également la conduction de l’influx électrique cardiaque, engendrant une anomalie de couplage électrique avec, pour conséquence, une augmentation du risque d’arythmies cardiaques potentiellement mortelles [2]. Le second type de fibrose correspond à la fibrose réactive. Celle-ci se développe préférentiellement dans l’interstitium ou autour des vaisseaux [3]. On parle, dans ce dernier cas, de fibrose périvasculaire. La fibrose réactive se développe à la suite d’une inflammation ou d’un stress (liés à des composants humoraux et/ou à des contraintes mécaniques) qui concourent à la progression d’un remodelage cardiaque pathologique plus global. Comme pour la fibrose de remplacement, la fibrose réactive est constituée majoritairement de fibres de collagène rigides, mais, dans ce cas, de la MEC s’accumule dans l’interstitium autour des cardiomyocytes sains. Malgré l’absence de nécrose de ces cardiomyocytes, leur enclavement dans une MEC rigide entraînera une anomalie de la contractilité et de la relaxation cardiaques. Le retentissement fonctionnel est variable, pouvant conduire à une insuffisance cardiaque avec ou sans baisse de la fraction d’éjection ventriculaire gauche. Les étiologies conduisant au développement de cette fibrose interstitielle sont nombreuses. L’examen d’une fibrose interstitielle cardiaque, notamment par des techniques avancées d’imagerie comme l’imagerie par résonance magnétique (IRM) cardiaque, indique souvent un processus de rigidification de la paroi myocardique à l’origine d’une augmentation de la résistance au remplissage du ventricule gauche. La distinction entre les types de fibrose est importante pour comprendre leur physiopathologie, car leurs origines sont différentes. En pratique, la fibrose cardiaque combine le plus souvent les deux types de fibrose. Ainsi, dans l’infarctus du myocarde, la zone anoxique nécrosée sera le site d’une fibrose de remplacement, mais au pourtour de cette zone nécrosée (appelée zone bordure) et à distance de celle-ci, une fibrose interstitielle s’installera en réaction au processus inflammatoire induit par la nécrose cellulaire, celle-ci pouvant être plus ou moins importante et retentir significativement sur le fonctionnement du cœur. Alors que l’on considère la fibrose de remplacement comme irréversible et nécessaire, la fibrose réactive est, quant à elle, maladaptative et pathologique. Dans d’autres contextes étiologiques, la fibrose sera surtout de type réactive et interstitielle, et aura une origine principalement liée à une inflammation chronique et à des contraintes mécaniques [4]. Différents types de fibrose peuvent donc coexister au sein d’un même tissu, avec des effecteurs qui sont tout à la fois communs et distincts aux deux types de fibrose. Différencier les deux types de fibrose et identifier les mécanismes sous-jacents spécifiques qui participent à leur formation sont donc des étapes nécessaires pour le développement de thérapies ciblées préférentiellement sur l’un ou sur l’autre de ces types de fibrose. |
Les origines de la fibrose cardiaque Les cellules à l’origine de la fibrose sont multiples. La principale source cellulaire est le fibroblaste cardiaque qui réside au sein du myocarde et qui, lorsqu’il est activé [5], se différencie en myofibroblaste, une cellule productrice de matrice extracellulaire. Initialement, des stratégies anti-fibrosantes ont donc été développées afin d’inhiber l’activation et la prolifération de ces fibroblastes. Des études récentes ont cependant montré que la fibrose cardiaque n’avait pas uniquement pour origine l’activation des fibroblastes résidents, mais était également liée à l’activation d’autres cellules et à d’autres mécanismes, notamment la différenciation de cellules hématopoïétiques circulantes recrutées dans le myocarde [6], ou de cellules périvasculaires [7], ou encore la trans-différenciation de cellules endothéliales (ou endoMT, pour endothelial to mesenchymal transition) [8], bien que l’implication de cette dernière soit controversée [9]. Dans un modèle murin, notre laboratoire a mis en évidence qu’une population particulière de cellules stromales cardiaques – des cellules exprimant le gène Pw11 – était capable de proliférer et de se différencier en fibroblastes dans la zone infarcie et dans la zone bordure, à la suite d’un infarctus du myocarde [10]. Ces cellules Pw1+ sont probablement des cellules ayant une assez forte plasticité : elles sont en effet peu différenciées et proviennent d’un reliquat de cellules ayant participé au développement du cœur lors de la vie embryonnaire. Leurs caractéristiques sont assez proches de celles des cellules souches adultes, mais elles ne peuvent régénérer le muscle cardiaque en reformant des cardiomyocytes. Elles participent en fait à la réparation du myocarde faisant suite à la perte cellulaire, par un simple processus de colmatage via la fabrication de MEC. Bien que ne synthétisant pas directement de la MEC, d’autres types de cellules sont des effecteurs de la fibrose, en participant à son déclenchement et/ou à sa progression en produisant des cytokines et des facteurs de croissance. Le TGF-β (transforming growth factor-b) est l’un de ces facteurs. Il a un rôle majeur dans le développement de la fibrose cardiaque [11,12]. Sa sécrétion locale survient souvent en réponse à une activation immuno-inflammatoire. Chez des patients hypertendus, dans le contexte du remodelage hypertrophique, l’inflammation qui y est associée contribue ainsi à l’accroissement du processus conduisant aux fibroses périvasculaire et interstitielle [13, 14]. Le rôle des cellules immunitaires dans le maintien et la résolution de cette inflammation et de cette fibrose cardiaque commence à être compris. Il semblerait qu’un déséquilibre des lymphocytes T régulateurs et des lymphocytes T auxiliaires (helper) soit une des causes de l’inflammation que l’on observe dans les cardiopathies hypertrophiques [15]. Une infiltration de macrophages, qui pourrait avoir un rôle majeur dans la sécrétion de cytokines pro-inflammatoires, notamment de TGF-β, est également retrouvée dans les stades précoces de la maladie [13]. Plus particulièrement, l’implication directe de macrophages exprimant le récepteur CCR2 (C-C chemokine receptor type 2) a été montrée dans un modèle murin d’hypertrophie cardiaque obtenue par surcharge de pression induite par une constriction aortique (TAC, pour transverse aortic constriction) [16]. En effet, dans ce modèle de fibrose, un infiltrat de macrophages exprimant CCR2 est observé et l’inhibition de ces cellules permet de réduire l’hypertrophie cardiomyocytaire, le dysfonctionnement systolique, la fibrose et l’expansion des lymphocytes T CD4+ et CD8+. |
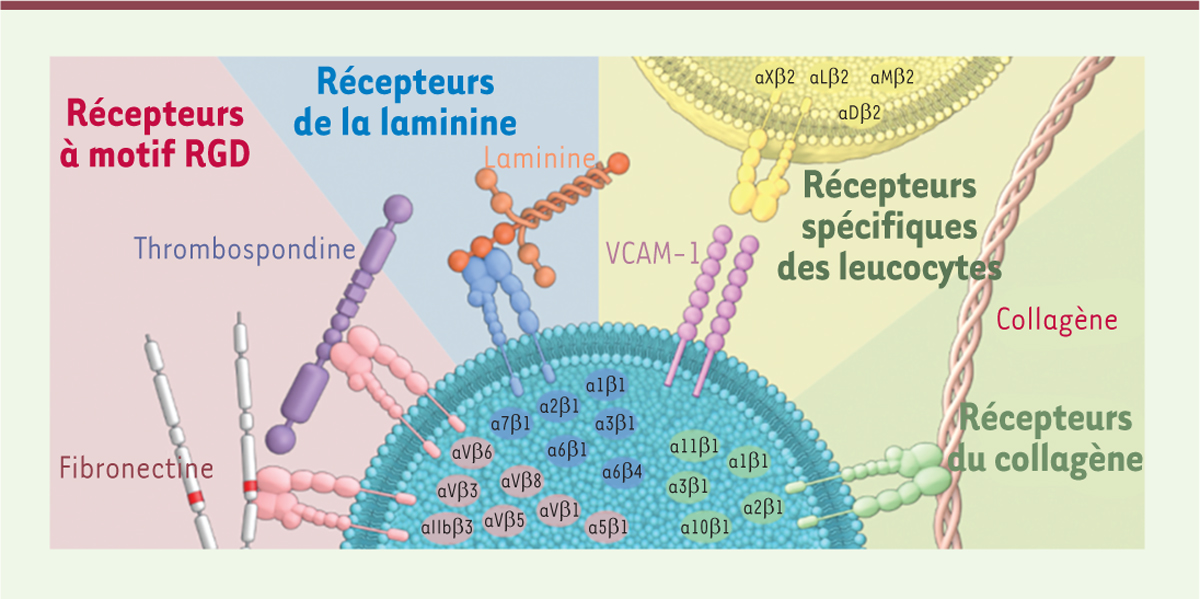
Le rôle des intégrines dans l’activation des processus fibrosants Les intégrines sont des protéines transmembranaires hétérodimériques qui possèdent de nombreux rôles dans les interaction entre cellules et entre les cellules et la MEC. Elles sont formées de deux sous-unités : a, dont il existe 18 types, et b, qui comporte huit types, pour un total de 24 combinaisons d’intégrines différentes (Figure 2). Leur fonction peut être attribuée soit à un des monomères du couple, soit à une combinaison dimérique spécifique, chaque combinaison étant susceptible d’avoir une fonction différente. L’implication de certaines de ces combinaisons a été suspectée dans le développement de la fibrose depuis quelques années, bien que la nature exacte des intégrines concernées soit restée incertaine.  | Figure 2. La famille des intégrines. Les différents dimères d’intégrines reconnaissent des ligands variés de la MEC. Les intégrines à l’origine de l’activation du TGF-β sont des membres de la sous-famille d’intégrines récepteurs à motif RGD. VCAM-1 : vascular cell adhesion molecule 1 (adapté de MBinfo, https://www.mechanobio.info/ what-is-mechanosignaling/what-is-the-extracellular-matrix-and-the-basal-lamina/ what-is-integrin/what-ligands-bind-to-integrin/) |
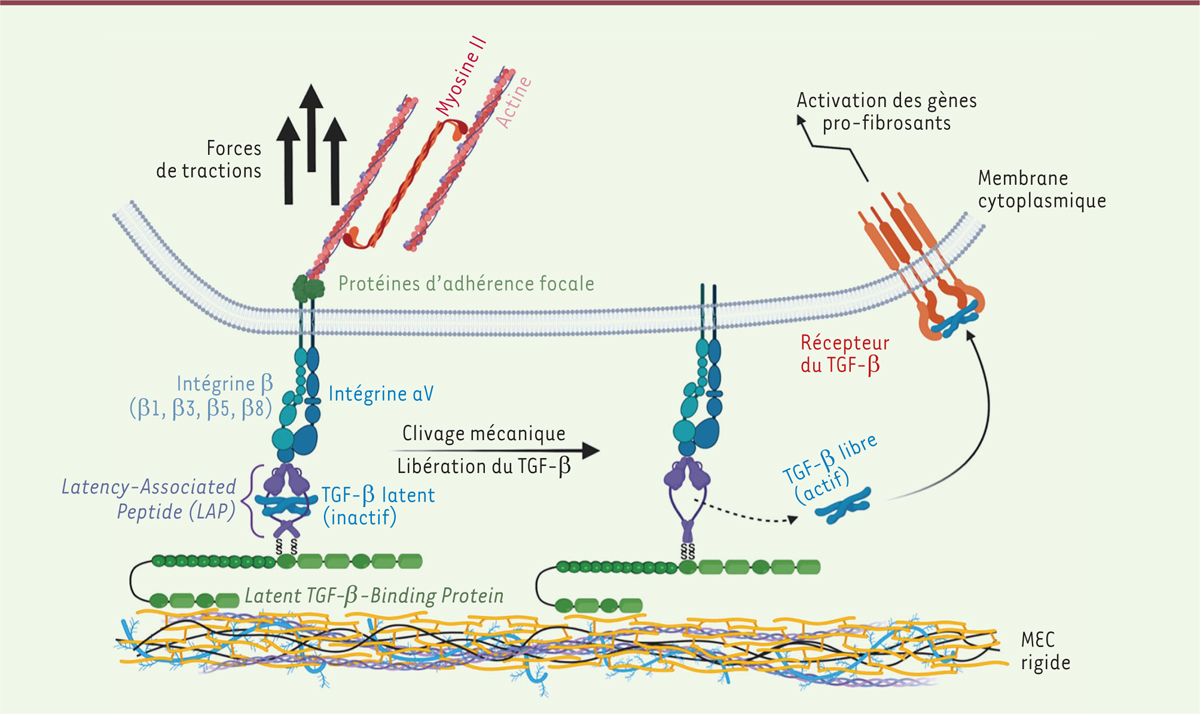
Parmi les intégrines, la sous-unité a11 a, en particulier, été associée au développement de la fibrose hépatique et des fibroses rénale et pulmonaire, cette sous-unité a11 se liant au collagène de type 1 et contrôlant la modification phénotypique des fibroblastes en myofibroblastes, les principaux acteurs de la sécrétion de la MEC [17]. Dans la fibrose cardiaque, ce mécanisme ne semble cependant pas intervenir et la plupart des travaux mettent en évidence l’implication de l’intégrine aV (aussi appelée CD51). L’intégrine aV participe à l’activation du TGF-β, qui comme nous l’avons vu, est une molécule essentielle au développement de la fibrose, quel que soit son type. Le TGF-β est un facteur de croissance qui nécessite une activation par clivage, qui peut être enzymatique (via des protéases) ou mécanique. Sous sa forme inactive, il est enclavé dans un peptide appelé LAP (latency-associated peptide, un peptide qui contient une séquence RGD, un tripeptide constitué d’arginine, de glycine et d’acide aspartique qui constitue le site de fixation des intégrines), qui est lui-même lié à la LTBP (latent TGF-b-binding protein). La LTBP se lie à la matrice extracellulaire et le motif RGD du LAP permet la fixation aux intégrines hétérodimériques aV-bx qui sont exprimées à la surface des cellules [18]. Les forces de traction entre les cellules et la MEC provoquent alors la libération de la forme active du TGF-β (Figure 3). Ainsi produit, le TGF-β se lie à son récepteur présent sur les cellules environnantes, activant les voies de signalisation essentielles pour le remodelage cardiaque [19]. Cela conduira à la transcription de gènes codant des protéines pro-fibrosantes tels que les gènes codant les collagènes et l’aSMA (smooth muscle alpha-actin). Ce mécanisme impliqué dans le développement de fibroses tissulaires, pose ainsi la question du rôle des intégrines constituées de la sous-unité aV dans le développement de la fibrose cardiaque.
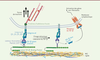 | Figure 3. Activation du TGF-b. Les intégrines αVβx exprimées par les cellules fixent, en interagissant avec son motif RGD, le LAP (Latency-Associated Peptide), associé au TGF-β inactif. La LTBP-1 (Latent TGF-b-Binding Protein-1) lie le complexe intégrines/LAP à la matrice extracellulaire (MEC). Les forces de tractions intracellulaires et la rigidité de la MEC induisent la libération du TGF-β alors actif, qui se lie à son récepteur et active les voies de signalisation menant à la transcription des gènes pro-fibrosants. |
|
Expression des intégrines aV dans les maladies fibrosantes L’intégrine aV peut s’associer avec cinq différentes sous-unités b (b1, b3, b5, b6 et b8), créant ainsi cinq complexes hétérodimériques pouvant avoir des expressions spécifiques à certains organes, et présentant différentes spécificités fonctionnelles. Dans le cœur, l’expression et la fonction de ces complexes intégrines particuliers commencent à être compris. Le dimère αVβ6 est exprimé exclusivement par les cellules épithéliales. Sa surexpression est corrélée au développement des fibroses rénale, hépatique et pulmonaire. Dans le foie sain, son expression est relativement faible, mais elle augmente au cours d’une maladie hépatique fibrosante, telle que la cirrhose hépatique [20]. C’est également le cas dans des modèles de fibrose rénale [21] ou pulmonaire [22, 23]. L’inhibition de cette intégrine permet de diminuer significativement le processus de fibrose par un mécanisme qui réduit l’activation du TGF-β et des fibroblastes [24]. Le dimère αVβ1 semble également jouer un rôle dans la fibrose. Il est en effet retrouvé à la surface des fibroblastes lorsqu’ils sont activés. Les sous-unités aV et b1 peuvent chacune s’associer à d’autres sous-unités, formant ainsi de nombreux dimères d’intégrines, ce qui a rendu difficile la compréhension de l’effet réel du dimère αVβ1, les stratégies d’extinction de gènes ciblant en effet chaque sous-unité individuellement et non leur association. Dean Sheppard et son équipe ont néanmoins développé un antagoniste spécifique de αVβ1 qu’ils ont testé dans des modèles de fibroses pulmonaire et hépatique. Ils ont ainsi pu examiner l’implication de ce dimère dans l’activation du TGF-β dans ces fibroses et ont montré que son inhibition spécifique diminuait la fibrose et l’expression des gènes pro-fibrosants, en lien avec la réduction de l’activation du TGF-β [25]. Les cellules stromales cardiaques exprimant le gène Pw1, qui se différencient en fibroblastes, contribuent, en partie, à la fibrose cardiaque. Ces cellules présentent à leur surface la sous-unité aV et des analyses de séquences d’ARN en cellule unique (single-cell RNA sequencing) ont mis en évidence l’expression prédominante par ces cellules de l’ARN messager (ARNm) du gène Itgb1, qui code la sous-unité b1, par rapport aux ARNm des autres sous-unités b. Néanmoins, des analyses réalisées sur des cœurs de souris sains ou après infarctus (par ligature complète de l’artère inter-ventriculaire antérieure) ont relevé la présence d’autres sous-unités associées à aV : b1 mais aussi b3. Il semble donc que l’intégrine aV soit impliquée dans le remodelage cardiaque post-infarctus, en association soit avec la sous-unité b1, soit avec la sous-unité b3 [26]. À l’exception de l’intégrine αVβ8, qui active le TGF-β en coopérant avec les métalloprotéinases (MMP pour matrix metalloproteinase) [27], les intégrines de la famille aV (αVβ1, αVβ3, αVβ5 et αVβ6) activent le TGF-β directement, via un clivage d’origine mécanique. Ce clivage mécanique dépend des forces de traction, mais aussi de la rigidité de la MEC dans laquelle est ancrée la LTBP. La contraction des myofibroblastes, qui expriment à leur surface les intégrines, faciliterait ce clivage mécanique [28]. Les conditions de rigidité de la MEC permettraient ainsi la libération du TGF-β et son activation [29]. |
Cibler les intégrines aV pour limiter la fibrose L’utilisation d’inhibiteurs de la sous-unité aV, notamment des molécules telles que le CWHM-122, un inhibiteur pan-aV, ou le cilengitide, un inhibiteur ciblant plus spécifiquement les dimères αVβ3 et αVβ5, est apparue comme une piste pour limiter le développement de la fibrose cardiaque. Ces molécules ciblent spécifiquement les intégrines aV en mimant le motif RGD présent à la surface du complexe latent associant le LAP et le TGF-β, ce qui permet d’inhiber son activation [30, 31]. Les premières données pharmacologiques concernant ces molécules ont été obtenues dans des modèles de fibroses qui ne concernent pas les maladies cardiovasculaires. Dans un modèle murin de fibrose pancréatique, l’utilisation du CWHM-12 a permis de réduire la fibrose et de diminuer l’expression des gènes régulés par le TGF-β [32]. Dans un modèle de stéatohépatite non alcoolique, le CWHM-12 a provoqué une diminution de la fibrose et des dommages hépatiques associés. Dans ce modèle, cette réduction de la fibrose semble reposer, notamment, sur une diminution de la quantité de cellules de Kupffer (les macrophages résidants du foie) activées et sur la réduction des signaux pro-fibrosants induits par le TGF-β [33]. L’importance de l’intégrine aV a été démontrée par ailleurs dans un modèle de fibrose hépatique induite par le tétrachlorure de carbone chez des souris dont le gène Itgav (integrin subunit alpha v) qui code la protéine a été inactivé. En effet, l’absence d’expression d’aV protège les animaux de la fibrose hépatique, mais aussi de fibroses touchant d’autres organes comme le poumon [34]. Des résultats similaires ont été obtenus dans un modèle de fibrose cardiaque induite par l’angiotensine II, avec une réduction de la fibrose interstitielle et une diminution de l’activation du TGF-β [35]. Cette dernière étude confirme en outre l’absence du dimère αVβ6 dans le cœur. L’effet de la délétion du gène Itgav a été comparé à celui de l’inhibition pharmacologique de l’aV induite par le CWHM-12, et une réduction équivalente de la fibrose cardiaque a été observée, validant ainsi l’intérêt thérapeutique des inhibiteurs des intégrines aV. Dans un modèle murin de sclérodermie systémique3, un effet bénéfique du cilengitide a été constaté sur les fibroses cutanée et pulmonaire, mais également sur la fibrose cardiaque, avec une diminution du dépôt de collagène interstitiel [36]. Cependant, dans ce modèle, le développement de la fibrose cardiaque est limité et correspond essentiellement à une fibrose réactionnelle et interstitielle. Le potentiel anti-fibrosant du cilengitide a néanmoins été montré in vitro en utilisant des fibroblastes cardiaques isolés de cœurs de rats spontanément hypertendus, avec la réduction de l’activation des fibroblastes en myofibroblastes et la diminution de l’expression de l’intégrine αVβ3 corrélée à celles du collagène de type 1 et de l’αSMA [37]. Il s’agit néanmoins d’un modèle in vitro qui ne correspond pas à une diminution de la fibrose telle qu’elle est observée in vivo. L’effet du cilengitide a été examiné, dans notre laboratoire, dans un modèle d’infarctus du myocarde. L’identification de la forte expression des intégrines aV par les cellules stromales Pw1+ et l’implication de ces dernières dans le remodelage fibrosant post-infarctus nous ont conduits à examiner l’effet de cet inhibiteur spécifique des intégrines aV dans ce modèle. In vitro, le cilengitide inhibe significativement la capacité des cellules cardiaques Pw1+ isolées à activer le TGF-β. La différenciation des fibroblastes en myofibroblastes est également diminuée. In vivo, le cilengitide réduit le processus de fibrose, notamment la taille de l’infarctus et la fibrose interstitielle, sans provoquer de rupture cardiaque. La mortalité des animaux traités par le cilengitide est ainsi diminuée et la dysfonction ventriculaire gauche est améliorée [26]. Le cilengitide aurait par ailleurs un effet vasculo-protecteur, en préservant la densité capillaire dans les zones bordures de l’infarctus. Le ciblage des intégrines aV se traduit donc par un potentiel effet anti-fibrosant après un infarctus, mais cette approche thérapeutique réduit également la mortalité et améliore la fonction cardiaque, contrairement aux stratégies plus globales d’inhibition du TGF-β qui conduisent, dans ce même modèle, à une augmentation de la mortalité des animaux [38]. |
De nombreuses molécules sont actuellement en phase d’essai clinique pour le traitement des fibroses hépatique, pulmonaire et rénale [39]. Les résultats que nous avons présentés montrent que l’inhibition des intégrines aV pourrait remédier à la fibrose cardiaque, notamment en inhibant l’activation du TGF-β, bien que d’autres mécanismes également liés à la fonction des intégrines puissent expliquer ces effets favorables. L’utilisation de différents inhibiteurs dans les modèles murins de fibrose cardiaque a révélé un réel effet bénéfique de ces molécules sur la réduction de la fibrose et sur l’amélioration de la fonction cardiaque. Les mécanismes exacts conduisant à ces améliorations, en cours d’étude dans notre laboratoire, restent néanmoins à élucider. Mais des premiers résultats encourageants permettent d’envisager des possibles applications cliniques dans les prochaines années. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Millard M, Odde S, Neamati N, Integrin Targeted Therapeutics . Theranostics. 2012; ; 1 : :154.–188. 2. Nguyen TP, Qu Z, Weiss JN, Cardiac fibrosis and arrhythmogenesis: The road to repair is paved with perils . J Mol Cell Cardiol. 2014; ; 70 : :83.–91. 3. de Boer RA, de Keulenaer G, Bauersachs J, et al. Towards better definition, quantification and treatment of fibrosis in heart failure. A scientific roadmap by the Committee of Translational Research of the Heart Failure Association (HFA) of the European Society of Cardiology . Eur J Heart Fail. 2019; ; 21 : :272.–285. 4. González A, Ravassa S, López B, et al. Myocardial remodeling in hypertension toward a new view of hypertensive heart disease . Hypertension. 2018; ; 72 : :549.–558. 5. Cleutjens JPM, Verluyten MJA, Smits JFM, et al. Collagen remodeling after myocardial infarction in the rat heart . Am J Pathol. 1995; ; 147 : :325.–338. 6. Möllmann H, Nef HM, Kostin S, et al. Bone marrow-derived cells contribute to infarct remodelling . Cardiovasc Res. 2006; ; 71 : :661.–671. 7. Kramann R, Schneider RK, Dirocco DP, et al. Perivascular Gli1+ progenitors are key contributors to injury-induced organ fibrosis . Cell Stem Cell. 2015; ; 16 : :51.–66. 8. Von Gise A, Pu WT., Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease . Circ Res. 2012; ; 110 : :1628.–1645. 9. Travers JG, Kamal FA, Robbins J, et al. Cardiac fibrosis: The fibroblast awakens . Circ Res. 2016; ; 118 : :1021.–1040. 10. Yaniz-Galende E, Roux M, Nadaud S, et al. Fibrogenic Potential of PW1/Peg3 Expressing Cardiac Stem Cells . J Am Coll Cardiol. 2017; ; 70 : :728.–741. 11. Wynn TA, Ramalingam TR, Mechanisms of fibrosis: Therapeutic translation for fibrotic disease . Nat Med. 2012; ; 18 : :1028.–1040. 12. Ma ZG, Yuan YP, Wu HM, et al. Cardiac fibrosis: New insights into the pathogenesis . Int J Biol Sci. 2018; ; 14 : :1645.–1657. 13. Kai H, Kuwahara F, Tokuda K, et al. Diastolic dysfunction in hypertensive hearts: Roles of perivascular inflammation and reactive myocardial fibrosis . Hypertens Res. 2005; ; 28 : :483.–490. 14. Westermann D, Lindner D, Kasner M, et al. Cardiac inflammation contributes to changes in the extracellular matrix in patients with heart failure and normal ejection fraction . Circ Hear Fail. 2011; ; 4 : :44.–52. 15. Idris-Khodja N, Mian MOR, Paradis P, et al. Dual opposing roles of adaptive immunity in hypertension . Eur Heart J. 2014; ; 35 : :1238.–1244. 16. Patel B, Bansal SS, Ismahil MA, et al. CCR2+ Monocyte-Derived Infiltrating Macrophages Are Required for Adverse Cardiac Remodeling During Pressure Overload . JACC Basic to Transl Sci. 2018; ; 3 : :230.–244. 17. Bansal R, Nakagawa S, Yazdani S, et al. Integrin alpha 11 in the regulation of the myofibroblast phenotype: Implications for fibrotic diseases . Exp Mol Med. 2017 ; :49.. 18. Henderson NC, Sheppard D, Integrin-mediated regulation of TGFβ in fibrosis . Biochim Biophys Acta - Mo Basis Dis. 2013; ; 1832 : :891.–896. 19. Bujak M, Ren G, Kweon HJ, et al. Essential role of Smad3 in infarct healing and in the pathogenesis of cardiac remodeling . Circulation. 2007; ; 116 : :2127.–2138. 20. Popov Y, Patsenker E, Stickel F, et al. Integrin αvβ6 is a marker of the progression of biliary and portal liver fibrosis and a novel target for antifibrotic therapies . J Hepatol. 2008; ; 48 : :453.–464. 21. Hahm K, Lukashev ME, Luo Y, et al. Avβ6 Integrin Regulates Renal Fibrosis and Inflammation in Alport Mouse . Am J Pathol. 2007; ; 170 : :110.–125. 22. John AE, Graves RH, Pun KT, et al. Translational pharmacology of an inhaled small molecule αvβ6 integrin inhibitor for idiopathic pulmonary fibrosis . Nat Commun. 2020;; 11 : :1.–14. 23. Horan GS, Wood S, Ona V, et al. Partial inhibition of integrin αvβ6 prevents pulmonary fibrosis without exacerbating inflammation . Am J Respir Crit Care Med. 2008; ; 177 : :56.–65. 24. Munger JS, Huang X, Kawakatsu H, et al. The integrin αvβ6 binds and activates latent TGFβ1: A mechanism for regulating pulmonary inflammation and fibrosis . Cell. 1999; ; 96 : :319.–328. 25. Reed NI, Jo H, Chen C, et al. The αvβ1 integrin plays a critical in vivo role in tissue fibrosis . Sci Transl Med. 2015; :7.. 26. Bouvet M, Claude O, Roux M, et al. Anti-integrin αv therapy improves cardiac fibrosis after myocardial infarction by blunting cardiac PW1+ stromal cells . Sci Rep. 2020;; 10 : :1.–15. 27. Mu D, Cambier S, Fjellbirkeland L, et al. The integrin ανβ8 mediates epithelial homeostasis through MT1-MMP-dependent activation of TGF-β1 . J Cell Biol. 2002; ; 157 : :493.–507. 28. Klingberg F, Chow ML, Koehler A, et al. Prestress in the extracellular matrix sensitizes latent TGF-β1 for activation . J Cell Biol. 2014; ; 207 : :283.–297. 29. Hinz B., The extracellular matrix and transforming growth factor-β1: Tale of a strained relationship . Matrix Biol. 2015; ; 47 : :54.–65. 30. Wipff PJ, Hinz B, Integrins and the activation of latent transforming growth factor β1 - An intimate relationship . Eur J Cell Biol. 2008; ; 87 : :601.–615. 31. Hinz B., It has to be the αv: Myofibroblast integrins activate latent TGF-β1 . Nat Med. 2013; ; 19 : :1567.–1568. 32. Ulmasov B, Neuschwander-Tetri BA, Lai J, et al. Inhibitors of Arg-Gly-Asp-Binding Integrins Reduce Development of Pancreatic Fibrosis in Mice . Cmgh. 2016; ; 2 : :499.–518. 33. Ulmasov B, Noritake H, Carmichael P, et al. An Inhibitor of Arginine-Glycine-Aspartate-Binding Integrins Reverses Fibrosis in a Mouse Model of Nonalcoholic Steatohepatitis . Hepatol Commun. 2019; ; 3 : :246.–261. 34. Henderson NC, Arnold TD, Katamura Y, et al. Targeting of αv integrin identifies a core molecular pathway that regulates fibrosis in several organs . Nat Med. 2013; ; 19 : :1617.–1624. 35. Murray IR, Gonzalez ZN, Baily J, et al. Av Integrins on Mesenchymal Cells Regulate Skeletal and Cardiac Muscle Fibrosis . Nat Commun. 2017; :8.. 36. Bagnato GL, Irrera N, Pizzino G, et al. Dual αvβ3 and avβ5 blockade attenuates fibrotic and vascular alterations in a murine model of systemic sclerosis . Clin Sci. 2018; ; 132 : :231.–242. 37. Perrucci GL, Barbagallo VA, Corlianò M, et al. Integrin ανβ5 in vitro inhibition limits pro-fibrotic response in cardiac fibroblasts of spontaneously hypertensive rats . J Transl Med. 2018; ; 16 : :1.–13. 38. Ikeuchi M, Tsutsui H, Shiomi T, et al. Inhibition of TGF-β signaling exacerbates early cardiac dysfunction but prevents late remodeling after infarction . Cardiovasc Res. 2004; ; 64 : :526.–535. 39. Schnittert J, Bansal R, Storm G, et al. Integrins in wound healing, fibrosis and tumor stroma: High potential targets for therapeutics and drug delivery . Adv Drug Deliv Rev. 2018; ; 129 : :37.–53. 40. Eijgenraam TR, Silljé HHW, de Boer RA. Current understanding of fibrosis in genetic cardiomyopathies . Trends Cardiovasc Med. 2020;; 30 : :353.–61. |