| |
| Med Sci (Paris). 38(5): 431–437. doi: 10.1051/medsci/2022054.Pronostiquer tôt les troubles du spectre autistique : Un défi ? Yehezkel Ben-Ari,1,2* Hugues Caly,3 Hamed Rabiei,1 and Éric Lemonnier4 1B&A Biomedical, bâtiment Beret-Delaage, parc scientifique et technologique de Luminy, zone Luminy biotech entreprises, 163 avenue de Luminy, 13273Marseille, France 2Neurochlore, bâtiment Beret-Delaage, parc scientifique et technologique de Luminy, zone Luminy biotech entreprises, 163 avenue de Luminy, 13273Marseille, France 3CHU Limoges, 23 avenue Dominique Larrey, 87042Limoges, France 4Centre ressources autisme, CHU Limoges, 23 avenue Dominique Larrey, 87042Limoges, France |
Vignette, © dessin de Bianca Van Dijk (Pixabay). Le terme « autisme » vient du grec « autos » qui signifie « soi-même ». Il a été introduit pour la première fois par le psychiatre suisse Eugen Bleuler en 1911, pour décrire un aspect de la symptomatologie schizophrénique chez des patients adultes (retrait social avec repli sur soi). On parle maintenant de troubles du spectre de l’autisme (TSA) en référence aux nombreux syndromes qui se rattachent à ces troubles particuliers du comportement. Les troubles du spectre de l’autisme se traduisent par des difficultés importantes de la communication sociale, avec des comportements répétitifs et restreints d’une grande hétérogénéité. Ces troubles ont une prévalence élevée (actuellement d’environ 1 enfant sur 50) qui augmente sans que les raisons de cette croissance soient élucidées [1, 2]. Malgré les efforts importants de recherche, il n’existe aucun traitement pharmaceutique des symptômes cardinaux des TSA qui ait été accepté par les autorités européennes ou américaines. Des données expérimentales ont néanmoins suggéré que certaines molécules antagonistes de récepteurs de la vasopressine ou l’ocytocine pourraient atténuer la sévérité des TSA. La bumétanide – un antagoniste de l’importateur de chlore NKCC1 (sodium, potassium, chloride cotransporter 1), qui réduit les concentrations de chlore intracellulaire ([Cl-]i), permet de restaurer l’inhibition cérébrale1, et atténue la sévérité de nombreuses maladies neurologiques et psychiatriques et, notamment, la sévérité des TSA [3]. Plusieurs essais cliniques pilotes et des essais en double aveugle randomisés de phase IIa/b ont confirmé ces effets bénéfiques de la bumétanide [4-7] : cette molécule atténue en effet la sévérité des syndromes autistiques, mais n’a pas d’effet sur les crises d’épilepsie associées à la sclérose tubéreuse de Bourneville2 [8]. Des données d’imagerie cérébrale et d’oculométrie (eye tracking)3 ont confirmé les promesses de la bumétanide [9, 10]. Cependant, malgré ces résultats encourageants, un essai de phase III, réalisé par les laboratoires Servier et Neurochlore, avec des enfants âgés de 2 à 18 ans, a échoué, ne permettant pas de mettre en évidence de différences significatives entre les enfants traités par la bumétanide et les enfants recevant un placebo. Cet échec pourrait être lié à l’hétérogénéité des TSA, qui limite l’utilisation d’un traitement unique pour les différents syndromes. Il est donc nécessaire de modifier, dans ces études, les conditions d’inclusions des enfants, afin qu’elles soient plus restrictives. Il est également important de définir des biomarqueurs qui permettaient d’identifier les différents syndromes. Récemment Bruining et al. ont montré qu’il était possible de prédire chez quels enfants la bumétanide aura un effet, en se fondant sur des données d’électroencéphalographie, les enregistrements différant selon que les enfants sont neurotypiques ou atteints de troubles du spectre de l’autisme [11]. Chez ces enfants, la bumétanide restaure un électroencéphalogramme normal et diminue les syndromes cliniques cardinaux des TSA. En parallèle de ces développements de traitements pharmaceutiques, il reste donc crucial d’identifier le plus tôt possible les enfants qui présenteront des TSA, afin de leur appliquer très tôt les techniques psycho-éducatives connues pour atténuer la sévérité de leur syndrome et, si cela est possible, les traitements pharmacologiques. |
Les TSA « naissent » in utero Bien que parfois controversées pour certaines d’entre elles, de nombreuses données suggèrent que les TSA auraient pour origine des évènements pathologiques génétiques ou environnementaux survenus in utero. Chez les femmes, des épisodes fébriles ou des infections virales ou bactériennes pendant la grossesse ont ainsi été associés à une augmentation de l’incidence de l’autisme [12-17]. Chez la souris, l’administration, pendant la gestation, du virus de la grippe ou l’injection de LPS (lipopolysaccharide), une endotoxine bactérienne, sont à l’origine d’anormalités comportementales et neuropathologiques attestant d’un syndrome de type TSA ou de schizophrénique [18-21]. Des résultats similaires ont été obtenus chez des primates non humains [15]. L’exposition à certains polluants, notamment des pesticides [22, 23], ou l’administration de médicaments, comme le valproate de sodium (la dépakine produite par Sanofi) à des mères, ont également été incriminées dans l’apparition de TSA chez leurs enfants [24]. Le valproate de sodium est d’ailleurs utilisé comme modèle expérimental de TSA chez la souris [24]. Des épisodes de stress pendant la grossesse, des césariennes programmées, des complications lors de la naissance, des naissances prématurées ou des déficits en vitamine D, ont également été associés à un développement cérébral anormal et à une augmentation de l’incidence des TSA chez les bébés [25-28]. Dans les analyses post mortem de cerveaux d’enfants ayant présenté des TSA, des proliférations cellulaires ainsi que des zones cérébrales désorganisées ont été relatées, suggérant là encore des atteintes intra-utérines [29, 30]. Dans sa revue, Moriah Elizabeth Thomason (New York University Medical Center, New York, États-Unis) souligne combien les conséquences de cette agression inaugurale sont complexes, avec des séquelles qui apparaissent des années plus tard [16]. Il est donc important de compenser le plus tôt possible les effets de cet évènement inaugural de la maladie [31]. En effet, des interventions précoces, notamment avec des approches psycho-éducatives, ont montré leur efficacité pour réduire la gravité du syndrome, voire y remédier, si l’enfant est pris en charge très tôt et est suivi attentivement [32-34] (voir aussi [35]) avec de telles approches (ABA [applied behaviour analysis], Teacch [treatment and education of autistic and related communication handicapped children], etc). Mais comment identifier, dès la naissance, les bébés à risque ? |
Établir un diagnostic chez les très jeunes enfants Il existe plusieurs approches permettant d’identifier des signes précurseurs et d’établir un diagnostic précoce des TSA chez le jeune enfant. Elles peuvent être cliniques, biologiques (marqueurs sanguins), neurologiques ou génétiques. Chacun des critères définis par ces approches est important et peut faire l’objet d’une évaluation précoce. Les évaluations cliniques Lors de sa première description du syndrome d’autisme, le plus jeune des 11 enfants étudiés en 1943 par le pédopsychiatre américain Léo Kanner (1894-1981) avait deux ans 4. Kanner parlait alors de troubles innés du contact affectif. Depuis cette définition d’une atteinte « innée », la recherche de signes chez l’enfant qui permettraient un diagnostic précoce de ces troubles a donc été privilégiée. Les premiers travaux cherchant à identifier ces signes précurseurs ont consisté en des observations de films produits par les familles d’enfants autistes. Ces observations confirmèrent que des signes d’autisme étaient effectivement observables dès les premiers mois de vie de l’enfant. Des tests permettent désormais la détection précoce de ces signes chez les enfants à risque d’autisme de moins de trois ans (par exemple les enfants issus de fratrie présentant des TSA), sans toutefois pouvoir établir un diagnostic définitif. Ils peuvent cependant être utilisés par les professionnels de la petite enfance afin de donner un nom aux troubles des enfants auxquels ils sont confrontés. Certains travaux se sont appuyés sur des modèles développementaux. Ainsi, se fondant sur la théorie de l’esprit5, le psychologue Simon Baron-Cohen (Autism Research Centre, Cambridge, Grande-Bretagne) a proposé le CHAT (quantitative checklist for autism in toddlers), un test qui devait permettre de repérer les enfants autistes dès 18 mois [36, 37]. Cependant, le nombre d’enfants identifiés comme autistes alors qu’ils n’ont aucun syndrome (ou faux positifs) donné par ce test étant élevé, le CHAT a par la suite été modifié pour aboutir à une nouvelle version conduisant à des résultats plus fiables [38]. La symptomatologie et son expression chez le nourrisson ont également été le fondement de certains travaux. Le early screening of autism, qui s’adresse à des enfants de 14 mois, consiste en l’observation, lorsque l’enfant joue, de ses contacts par le regard, de son attention conjointe, de sa communication verbale et non verbale, et de son intérêt aux autres et à leurs réactions [39, 40]. Amy M Wetherby et al. ont proposé une liste de critères, la infant toddler check list (ITC), qui vise à repérer les TSA en se fondant sur les troubles de la communication et du langage des enfants âgés de 18 à 24 mois [41]. Le first year inventory (FYI) s’adresse, lui, aux enfants de 12 mois [42], mais ce test n’a reçu aucune validation scientifique. Les enfants à risque ayant été identifiés avec ces différents tests, le degré de gravité de leur trouble pourra être alors déterminé par des échelles d’évaluation. Il en existe plusieurs, s’adressant à des enfants d’âges différents. L’autism diagnositc observation schedule (ADOS) et l’autism diagnostic interview (ADI-R) sont les échelles standardisées, malgré le nombre de faux positifs que ces tests donnent, un nombre qui augmente en fonction de l’âge de l’enfant : plus l’enfant est jeune, plus le risque de faux positif est important. D’autres tests ont été proposés, comme le screening test for autism in 2 years-olds (STAT), pour les enfants de 12 à 24 mois, le parent observation of early milestones scale (POEMS), qui s’adresse aux bébés de 3 à 24 mois et repose sur l’observation des parents. L’autism observation for infants (AOSI) concerne, lui, des enfants de 6 à 18 mois, et l’autism detection in early childhood (ADEC), des enfants de 12 à 36 mois. Cependant, si ces différents tests permettent de révéler des particularités comportementales de l’enfant dès son plus jeune âge, ils n’ont pas permis de définir une approche globale de l’autisme chez tous les enfants, quel que soit leur âge. Les marqueurs sanguins Des modifications importantes de certains biomarqueurs ont été mises en évidence dans le sérum des enfants présentant des TSA. L’équipe de Simon Baron-Cohen a ainsi observé, pendant la grossesse, des taux élevés de stéroïdes chez les mères et chez les enfants présentant des TSA [ 37], avec des augmentations significatives des taux de marqueurs d’oxydation et des produits de la glycation de protéines, chez des enfants de sept ans [ 43]. De même, Daniel Howsmon a mis en évidence des différences de concentrations sanguines de métabolites du folate et des voies de transulfuration entre des enfants, âgés de 3 à 10 ans, présentant des TSA (83 enfants) et des enfants neurotypiques (76 enfants) [ 44]. Dans cette étude, 96 % des enfants autistes avaient pu être identifiés ; ce test sérologique semble également permettre de prédire la survenue des comportements adaptatifs des enfants, mesurés par le test de Vineland 6. Une étude protéomique réalisée sur le sang d’enfants autistes et neurotypiques (âgés de 18 mois à 8 ans) a par ailleurs montré, en analysant plus de mille protéines, des augmentations (52 protéines) et des diminutions (86 protéines) de concentrations sanguines, avec des différences significatives pour neuf d’entre elles chez les enfants présentant des TSA [ 51]. Des études menées chez la souris ont montré que la diminution significative d’une hormone placentaire, impliquée dans le développement cérébral, dans la seconde moitié de la gestation, pourrait favoriser le risque d’apparition de troubles comportementaux apparentés aux troubles du spectre de l’autisme [52]. Ces approches fondées sur la détection de biomarqueurs sériques semblent donc prometteuses pour identifier les enfants souffrant de TSA. Cependant, les mesures de métabolites qui ont été réalisées ont concerné, pour l’essentiel, des bébés qui ne sont pas nés à terme, ce qui rend difficile de conclure si les marqueurs identifiés sont une cause ou une conséquence de la pré-maturité et si les TSA en sont responsables. Des réponses sensorielles La mesure de réponses sensorielles a été proposée comme test pour identifier de façon précoce des enfants présentant des TSA [ 45]. Le test de réponse du tronc cérébral à la stimulation sonore (ABR, pour auditory brain stem responses), un potentiel évoqué auditif mesurant les signaux électriques du tronc cérébral en réponse à un son, a ainsi été utilisé. La réponse est enregistrée par des électrodes de surface et se traduit par la succession de différentes ondes (I à V) 7. Chez des enfants autistes, âgés de deux à six ans, l’onde I a une plus grande amplitude que l’onde V, contrairement à ce que l’on observe chez des enfants neurotypiques [ 46, 47]. Des différences de réponses électriques ont également été observées chez des nouveau-nés : ceux ayant présenté des TSA plus tard ont en effet montré une réponse aux sons plus tardive que celle des autres nouveau-nés [ 47]. D’autres approches ont été testées, en particulier, l’exploration de la réaction faciale, qui s’avère plus longue chez les enfants atteints de TSA, avec un processus exploratoire atypique [ 48], ou la perception du langage, de la voix, etc. (pour revue, voir [ 45]). Ces travaux présentent un intérêt indiscutable pour comprendre les altérations du développement chez les enfants atteints de TSA et pour mettre en évidence de possibles biomarqueurs chez ces enfants dès leur plus jeune âge. Il est néanmoins difficile de considérer ce type d’approches comme des outils diagnostiques utilisables chez les nouveau-nés dans la population générale. Les mutations génétiques Nous ne pourrons, dans le cadre de cette revue, résumer l’ensemble des données concernant l’identification de mutations génétiques qui ont été associées à la survenue de TSA et les avancées spectaculaires qu’elles ont permises [ 53] ( →). (→) Voir la Synthèse de A. Munnich et al., m/s n° 11, novembre 2019, page 843 L’autisme est une maladie neuro-développementale complexe. Il faut ainsi distinguer l’autisme syndromique et l’autisme non syndromique. Dans le cadre de l’autisme syndromique, certaines formes monogéniques (syndromes de Rett, de l’X fragile, de Down) peuvent être détectées par un diagnostic génétique prénatal. Cependant, la plupart des cas d’autisme ont une origine polygénique, et les gènes qui y contribuent sont très nombreux. Il est néanmoins important de noter que si la maladie monogénique peut être diagnostiquée tôt, l’association à un autisme ne concerne qu’une faible partie de ces enfants (seuls 10 % d’enfants présentant un syndrome de Down ou un syndrome de l’X fragile sont atteints d’autisme). Le diagnostic spécifique de l’autisme reste donc plus tardif. Notons également qu’un diagnostic anténatal de l’autisme reste, à ce jour, inenvisageable. Plusieurs centaines de mutations ont été identifiées chez les enfants présentant des TSA. Elles n’ont souvent qu’une faible pénétrance. Ces mutations sont en effet associées majoritairement à des désordres généraux du développement cérébral ; les modifications qu’elles entraînent, susceptibles d’induire des TSA, restent à déterminer. Elles sont également souvent sporadiques, rendant difficile un pronostic dès la naissance. Dans sa revue récente, le pédiatre américain Scott Myers (Autism and developmental medicine institute, Danville, États-Unis) concluait en fait à l’absence de mutations spécifiquement liées aux TSA [49]. Des tests de micro-réseaux chromosomiques, qui permettent de détecter certains variants liés à l’autisme, ont néanmoins été développés, mais ils montrent leurs limites, d’où l’intérêt de développer d’autres approches pour pronostiquer le plus tôt possible les cas d’autisme. |
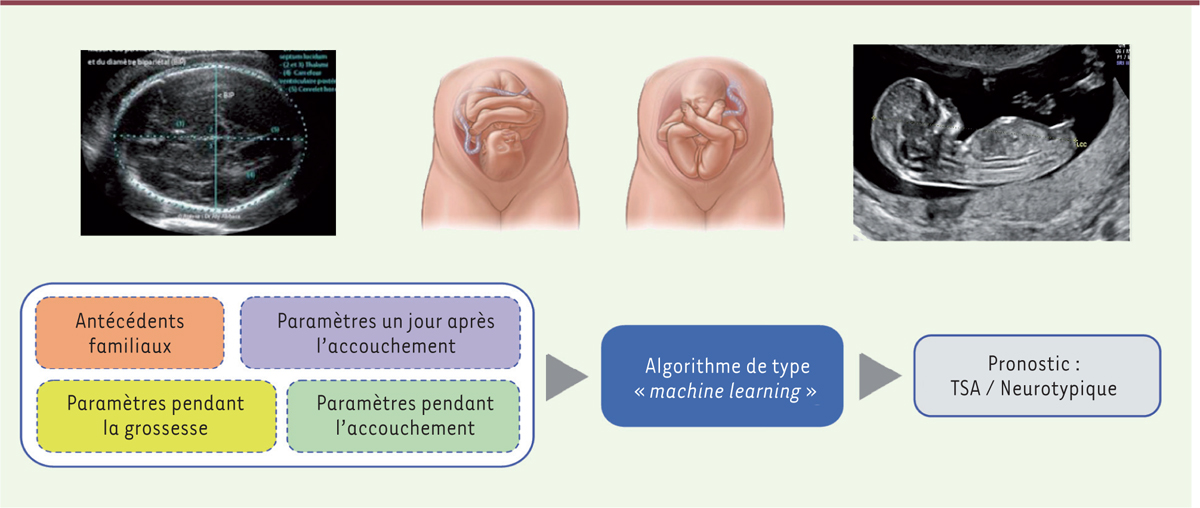
Le machine learning pour identifier des bébés à risque dès la naissance Si les TSA « naissent » in utero, il devrait être possible d’identifier les enfants autistes dès la naissance, en analysant certains paramètres mesurés durant la grossesse. Nous avons entrepris l’identification a posteriori de ces paramètres, en utilisant les données au cours de la grossesse et à la naissance, d’enfants présentant des TSA ou d’enfants neurotypiques, nés à l’Hôpital de la mère et de l’enfant de Limoges. Les données qui étaient disponibles concernaient des paramètres enregistrés depuis le premier trimestre de la grossesse jusqu’au premier jour après la naissance. Étant donné le nombre de paramètres qui ont été ainsi recueillis (plus de 115, allant de la taille de la croissance du fémur à la différence de température au cours des jours suivant la naissance, auprès de 65 enfants diagnostiqués autistes et 190 enfants neurotypiques), il était donc nécessaire de disposer d’un outil d’analyse, tel que ceux utilisés pour les données massives (« Big Data »), fondé sur l’intelligence artificielle et l’apprentissage automatique ou machine learning (ML). Le programme Genesis ML, développé dans le cadre de la start-up B&A Biomedical, a permis cette analyse innovante des données. Afin d’en valider les résultats, une approche fondée sur des paramètres connus pour leur association avec la survenue de TSA (infection par le cytomégalovirus, sexe, inflammation, etc.) a été utilisée en parallèle. Dans cette étude princeps, le programme a permis non seulement d’identifier des bébés autistes, mais aussi de déterminer des paramètres, parmi tous ceux examinés, permettant ensemble d’établir un pronostic (Figure 1). Grâce à ce progamme, il a été possible d’identifier les bébés neurotypiques (96 %). Les conditions appliquées pour déterminer le pronostic ont été définies afin de minimiser le nombre de faux positifs avec, cependant, 4 % d’erreurs : des enfants diagnostiqués porteurs de TSA alors qu’ils étaient neurotypiques. Néanmoins, environ la moitié des enfants qui seront diagnostiqués plus tard porteurs de TSA (41 %) ont pu être identifiés par cette approche, un pourcentage relativement important et qui pourrait être accru [50].
 | Figure 1. Utilisation du programme pour identifier les bébés à risque de TSA dès la naissance. Un ensemble de paramètres est analysé jusqu’à la naissance, allant des antécédents familiaux aux paramètres de la grossesse. L’algorithme défini permet l’identification des bébés à risque de TSA. |
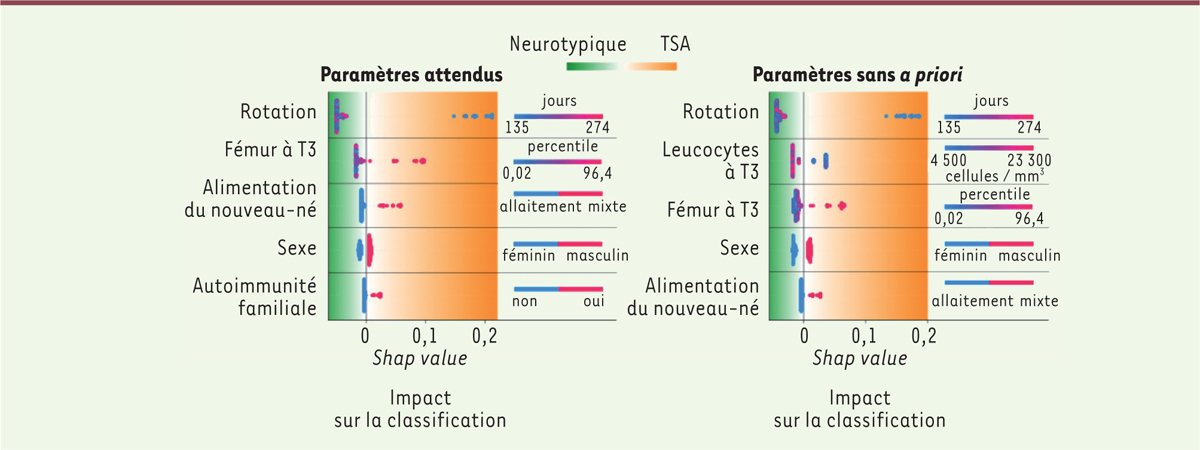
Certains paramètres permettant de distinguer les enfants à risque, qui sont ressortis de cette étude, étaient attendus, comme le sexe du bébé (4 fois plus de garçons que de filles présentent des TSA), les infections virales, ou les paramètres suggérant une inflammation lors de la grossesse [17]. D’autres, par contre, sont ressortis sans qu’aucune explication, dans l’état actuel de nos connaissances, ne puisse en rendre compte, comme la taille du fémur au troisième trimestre de grossesse, ou l’adoption précoce d’une position tête en bas des fœtus futurs autistes, 2 à 3 semaines avant les fœtus futurs neurotypiques (Figure 2). Aucun de ces paramètres n’a présenté en fait de valeur individuelle suffisante pour établir un pronostic. L’analyse complète, jusqu’à la naissance (comprise), de tous les paramètres reste donc indispensable. Notons qu’une interuption volontaire de grossesse qui se fonderait sur ces données n’est ni possible, ni justifiable.
 | Figure 2.Quelques-uns des paramètres impactant le pronostic. À gauche : paramètres impactants, fondés sur une analyse semi-automatique utilisant des paramètres attendus d’après nos connaissances actuelles. À droite : analyse automatique effectuée sans a priori. La couleur des points est fonction de l’échelle pour chaque mesure. Chaque point représente les valeurs obtenues pour un bébé. Ainsi, pour ce qui est de la rotation du bébé tête en bas, plus celle-ci est précoce (en bleu), plus le risque de TSA est élevé. Pour la taille du fémur au troisième trimestre (fémur à T3), plus elle est importante (en rouge), plus le risque est élevé (le chiffre indique le percentile de répartition des tailles). Les paramètres sont classés de haut en bas d’après l’importance de leur impact. Notez par exemple que la rotation tête en bas est dans les deux cas un facteur impactant important (figure adaptée avec la permission de Caly et al. [ 50]). |
Parmi les paramètres étudiés, la mesure du périmètre crânien, réalisée par échographie lors des examens périodiques de la grossesse, montre que les embryons de près de 40 % des enfants qui se révèleront autistes par la suite - et pas les futurs enfants neurotypiques - ont un périmètre crânien significativement plus grand que la moyenne, dès les deuxième et troisième trimestres de grossesse [50, 55]. Cette observation valide ainsi la pathogenèse in utero des TSA, et suggère que l’ensemble du processus de maturation cérébrale est altéré chez les enfants autistes et cela dès le 2e trimestre de grossesse, voire plus précocément. Bien que prometteuse, l’analyse que nous avons réalisée pose des problèmes conceptuels. Que peut-on conclure quant à ces paramètres qui ressortent, mais qui n’ont pas de lien apparent avec les TSA ? Il est possible que certains d’entre eux, identifiés dans l’étude, soient également observés chez des enfants souffrant d’autres syndromes neurodéveloppementaux, et pas uniquement chez les enfants atteints de TSA. Il nous semble que la faible compréhension des évènements intra-utérins susceptibles d’être à l’origine des TSA justifie d’amplifier ce type d’étude afin de pouvoir conclure avec certitude. Reste aussi un problème éthique : la connaissance d’un possible diagnostic de TSA – qui, répétons le, ne peut se faire qu’après la naissance - peut être source de stress pour les parents et pour l’enfant. La multiplication de ce type d’approches devrait permettre d’accroître sa fiabilité, réduire les faux positifs et faciliter l’utilisation d’approches psychoéducatives afin d’atténuer autant que faire se peut la sévérité des TSA. Les données de la maternité pourraient être également incorporées dans le diagnostic pédopsychiatrique, ce qui permettrait une meilleure compréhension de l’hétérogénéité des TSA. |
L’ensemble des travaux que nous avons présentés confirment que les TSA ont une origine intra-utérine. La possibilité d’identifier, même de façon partielle, les bébés à risque à la naissance ouvre d’importantes possibilités de prise en charge de ces bébés, dès les premiers mois de vie, et ainsi d’atténuer l’évolution de leur syndrome. Ce type de diagnostic pourrait cependant avoir des conséquences néfastes sur l’état psychique des parents. Des résultats ambigus pourraient également avoir un impact à long terme. Dans une enquête réalisée en 2019, l’équipe de Ronald Wapner, professeur d’obstétrique et de gynécologie au Columbia Institute for Genomic Medicine (New York, États-Unis), a en effet constaté que les parents qui avaient reçu des résultats de tests prénatals ambigus jugeaient leur bébé moins compétent à l’âge de 12 mois que ceux qui étaient rentrés chez eux avec un résultat normal [54]. Afin d’accroître la significativité de l’identification des enfants à risque d’autisme, et de diminuer la possibilité d’un faux diagnostic, l’étude princeps que nous avons présentée sera suivie d’une analyse incluant plus d’enfants et nés dans plusieurs maternités, afin de déterminer les paramètres les plus discriminants. Cette seconde étude, en cours de réalisation, devrait ensuite ouvrir la voie à une vaste étude prospective, associée à une analyse des facteurs de risques. Sans doute sera-t-il alors possible d’envisager la généralisation de cet outil de pronostic, dès la naissance. Cela permettra de mieux identifier les paramètres prédictifs des TSA les plus importants et de déterminer leur(s) rôle(s) dans le déclenchement de ces troubles. Un diagnostic précoce de l’autisme nécessitera aussi le suivi de l’enfant dès sa naissance, ainsi que de ses parents, par un personnel médical et éducatif qualifié. Peut-être la conclusion la plus évidente est que nous avons besoin de ce type d’approche afin de mieux comprendre la pathogenèse et l’hétérogénéité des TSA. |
Yehezkel Ben-Ari est fondateur et directeur général de Neurochlore, une start-up dédiée au traitement de l’autisme, et fondateur et directeur général de B&A Biomedical, une start-up dédiée à l’utilisation de l’intelligence artificielle pour établir un pronostic précoce des TSA. Hamed Rabiei est salarié de B&A Biomedical. Hughes Caly et Éric Lemonnier déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. Idring S, Lundberg M, Sturm H, et al. Changes in Prevalence of Autism Spectrum Disorders in 2001–2011: Findings from the Stockholm Youth Cohort . J Autism Dev Disord. 2015; ; 45 : :1766.–1773. 2. Elsabbagh M, Divan G, Koh YJ, et al. Global Prevalence of Autism and Other Pervasive Developmental Disorders . Autism Res. 2012; ; 5 : :160.–179. 3. Ben-Ari Y.. NKCC1 Chloride Importer Antagonists Attenuate Many Neurological and Psychiatric Disorders . Trends Neurosci. 2017; ; 40 : :536.–554. 4. Lemonnier E, Degrez C, Phelep M, et al. A randomised controlled trial of bumetanide in the treatment of autism in children . Transl Psychiatry. 2012; ; 2 : :e202.. 5. Lemonnier E, Villeneuve N, Sonie S, et al. Effects of bumetanide on neurobehavioral function in children and adolescents with autism spectrum disorders . Transl Psychiatry. 2017; ; 7 : :1.–9. 6. Zhang L, Huang CC, Dai Y, et al. Symptom improvement in children with autism spectrum disorder following bumetanide administration is associated with decreased GABA/glutamate ratios . Transl Psychiatry. 2020;; 10 : :63.. 7. Sprengers JJ, Andel DM van, Zuithoff NPA, et al. Bumetanide for Core Symptoms of Autism Spectrum Disorder (BAMBI): A Single Center, Double-Blinded, Participant-Randomized, Placebo-Controlled, Phase-2 Superiority Trial . J Am Acad Child Adolesc Psychiatry. 2021;; 60 : :865.–76. 8. Andel DM Van, Sprengers JJ, Oranje B, et al. Effects of bumetanide on neurodevelopmental impairments in patients with tuberous sclerosis complex: An open-label pilot study . Mol Autism. 2020;; 11 : :30.. 9. Hadjikhani N, Zürcher NR, Rogier O, et al. Improving emotional face perception in autism with diuretic bumetanide: A proof-of-concept behavioral and functional brain imaging pilot study . Autism. 2015; ; 19 : :149.–157. 10. Hadjikhani N, Åsberg Johnels J, Lassalle A, et al. Bumetanide for autism: More eye contact, less amygdala activation . Sci Rep. 2018; ; 8 : :3602.. 11. Juarez-Martinez EL, Sprengers JJ, Cristian G, et al. Prediction of behavioral improvement through resting-state EEG and clinical severity in a randomized controlled trial testing bumetanide in autism spectrum disorder . Biol Psychiatry Cogn Neurosci Neuroimaging. 2021 Sep 8 : S2451–9022(21)00251–2.. 12. Kim JY, Son MJ, Son CY, et al. Environmental risk factors and biomarkers for autism spectrum disorder: an umbrella review of the evidence . Lancet Psychiatry. 2019; ; 6 : :590.–600. 13. Estes ML, McAllister AK. Immune mediators in the brain and peripheral tissues in autism spectrum disorder . Nat Rev Neurosci. 2015; ; 16 : :469.–486. 14. Atladóttir HÓ, Henriksen TB, Schendel DE, et al. Using maternally reported data to investigate the association between early childhood infection and autism spectrum disorder: The importance of data source . Paediatr Perinat Epidemiol. 2012; ; 26 : :373.–385. 15. Bauman MD, Iosif AM, Smith SEP, et al. Activation of the maternal immune system during pregnancy alters behavioral development of rhesus monkey offspring . Biol Psychiatry. 2014; ; 75 : :332.–341. 16. Thomason ME. Development of Brain Networks In Utero: Relevance for Common Neural Disorders . Biol Psychiatry. 2020;; 88 : :40.–50. 17. Han VX, Patel S, Jones HF, et al. Maternal immune activation and neuroinflammation in human neurodevelopmental disorders . Nat Rev Neurol. 2021;; 17 : :564.–79. 18. Shi L, Tu N, Patterson PHMaternal influenza infection is likely to alter fetal brain development indirectly: The virus is not detected in the fetus . Int J Dev Neurosci. 2005; ; 23 : :299.–305. 19. Hsiao EY, McBride SW, Hsien S, et al. Microbiota modulate behavioral and physiological abnormalities associated with neurodevelopmental disorders . Cell. 2013; ; 155 : :1451.–1463. 20. Choi GB, Yim YS, Wong H, et al. The maternal interleukin-17a pathway in mice promotes autism-like phenotypes in offspring . Science. 2016; ; 351 : :933.–939. 21. Fernandez A, Dumon C, Guimond D, et al. The GABA Developmental Shift Is Abolished by Maternal Immune Activation Already at Birth . Cereb Cortex. 2019; ; 29 : :3982.–3992. 22. Shelton JF, Geraghty EM, Tancredi DJ, et al. Neurodevelopmental disorders and prenatal residential proximity to agricultural pesticides: The charge study . Environ Health Perspect. 2014; ; 122 : :1103.–1109. 23. Hertz-Picciotto I, Schmidt RJ, Walker CK, et al. A prospective study of environmental exposures and early biomarkers in autism spectrum disorder: Design, protocols, and preliminary data from the MARBLES study . Environ Health Perspect. 2018; ; 126 : :117004.. 24. Christensen J, Gronborg TK, Sorensen MJ, et al. Prenatal valproate exposure and risk of autism spectrum disorders and childhood autism . JAMA. 2017; ; 309((16)): :1696.–1703. 25. Wu Y, Kapse K, Jacobs M, et al. Association of Maternal Psychological Distress with in Utero Brain Development in Fetuses with Congenital Heart Disease . JAMA Pediatr. 2020;; 174 : :e1919940.. 26. Say GN, Karabekirog˘lu K, Babadag˘i Z, et al. Maternal stress and perinatal features in autism and attention deficit/hyperactivity disorder . Pediat Int. 2016; ; 58 : :265.–269. 27. Principi N, Esposito SVitamin D Deficiency During Pregnancy and Autism Spectrum Disorders Development . Front Psychiatry. 2019; ; 10 : :987.. 28. Curran EA, O’Neill SM, Cryan JF, et al. Research Review: Birth by caesarean section and development of autism spectrum disorder and attention-deficit/hyperactivity disorder: A systematic review and meta-analysis . J Child Psychol Psychiatry. 2015; ; 56 : :500.–508. 29. Stoner R, Chow ML, Boyle MP, et al. Patches of disorganization in the neocortex of children with autism . N Engl J Med. 2014; ; 370 : :1209.–1219. 30. Amaral DG, Li D, Libero L, et al. In pursuit of neurophenotypes: The consequences of having autism and a big brain . Autism Res. 2017; ; 10 : :711.–722. 31. Ben-Ari Y.Neuro-archaeology: pre-symptomatic architecture and signature of neurological disorders . Trends Neurosci. 2008; ; 31 : :626.–636. 32. Kasari C, Gulsrud A, Paparella T, et al. Randomized comparative efficacy study of parent-mediated interventions for toddlers with autism . J Consult Clin Psychol. 2015; ; 83 : :554.–563. 33. Downs J, Rodger J, Li C, et al. Environmental enrichment intervention for Rett syndrome: An individually randomised stepped wedge trial . Orphanet J Rare Dis. 2018; ; 13 : :3.. 34. Wallace KS, Rogers SJIntervening in infancy: Implications for autism spectrum disorders . J Child Psychol Psychiatry. 2010; ; 51 : :1300.–1320. 35. Fuller EA, Oliver K, Vejnoska SF, et al. The Effects of the Early Start Denver Model for Children with Autism Spectrum Disorder : A Meta-Analysis . Brain Sci. 2020;; 10 : :368.. 36. Baron-Cohen S, Allen J, Gillberg CCan Autism be Detected at 18 Months? The needle, the haystack, and the CHAT . B J Psychiatry. 1992; ; 161 : :839.–843. 37. Tsompanidis A, Aydin E, Padaigaitè E, et al. Maternal steroid levels and the autistic traits of the mother and infant . Mol Autism. 2021;; 12 : :51.. 38. Charman T, Baron-Cohen S, Baird G, et al. Commentary: The Modified Checklist for Autism in Toddlers . J Autism Dev Disord. 2001; ; 31 : :145.–148. 39. Kas MJ, Glennon JC, Buitelaar J, et al. Assessing behavioural and cognitive domains of autism spectrum disorders in rodents: Current status and future perspectives . Psychopharmacology. 2014; ; 231 : :1125.–1146. 40. Oosterling IJ, Wensing M, Swinkels SH, et al. Advancing early detection of autism spectrum disorder by applying an integrated two-stage screening approach . J Child Psychol Psychiatry. 2010; ; 51 : :250.–258. 41. Wetherby AM, Woods J, Allen L, et al. Early indicators of autism spectrum disorders in the second year of life . J Autism Dev Disord. 2004; ; 34 : :473.–493. 42. Watson LR, Baranek GT, Crais ER, et al. The First Year Inventory: Retrospective parent responses to a questionnaire designed to identify one-year-olds at risk for autism . J Autism Dev Disord. 2007; ; 37 : :49.–61. 43. Anwar A, Abruzzo PM, Pasha S, et al. Advanced glycation endproducts, dityrosine and arginine transporter dysfunction in autism - A source of biomarkers for clinical diagnosis . Mol Autism. 2018; ; 9 : :3.. 44. Howsmon DP, Kruger U, Melnyk S, et al. Classification and adaptive behavior prediction of children with autism spectrum disorder based upon multivariate data analysis of markers of oxidative stress and DNA methylation . PLoS Comput Biol. 2017; ; 13 : :e1005385.. 45. Bonnet-Brilhault F, Tuller L, Prévost P, et al. A strategic plan to identify key neurophysiological mechanisms and brain circuits in autism . J Chem Neuroanat. 2018; ; 89 : :69.–72. 46. Santos M, Marques C, Nóbrega Pinto A, et al. Autism spectrum disorders and the amplitude of auditory brainstem response wave I . Autism Res. 2017; ; 10 : :1300.–1305. 47. Miron O, Delgado RE, Delgado CF, et al. Prolonged Auditory Brainstem Response in Universal Hearing Screening of Newborns with Autism Spectrum Disorder . Autism Res. 2021;; 14 : :46.–52. 48. Guimard-Brunault M, Hernandez N, Roché L, et al. Back to Basic: Do Children with Autism Spontaneously Look at Screen Displaying a Face or an Object? . Autism Res Treat. 2013; ; 2013 : :835247.. 49. Myers SM, Challman TD, Bernier R, et al. Insufficient Evidence for “Autism-Specific” Genes . Amn Jf Hum Genet. 2020;; 106 : :587.–95. 50. Caly H, Rabiei H, Coste-Mazeau P, et al. Machine learning analysis of pregnancy data enables early identification of a subpopulation of newborns with ASD . Sci Rep. 2021;; 11 : :6877.. 51. Hewitson L, Mathews JA, Devlin M, et al. Blood biomarker discovery for autism spectrum disorder: A proteomic analysis . PLoS One. 2021;; 16 : :e0246581.. 52. Vacher CM, Lacaille H, O’Reilly JJ, et al. Placental endocrine function shapes cerebellar development and social behavior . Nat Neurosci. 2021;; 24 : :1392.–401. 53. Munnich A, Demily C, Frugère L, et al. Vingt ans de consultations de génétique clinique sur site dans les hôpitaux de jour pour les personnes atteintes de troubles du spectre autistique de la région parisienne . Med Sci (Paris). 2019; ; 35 : :843.–851. 54. Petrovski S, Aggarwal V, Giordano JL, et al. Whole-exome sequencing in the evaluation of fetal structural anomalies: a prospective cohort study . Lancet. 2019;; 393 : :758.–67. 55. Bonnet-Brilhault F, Rajerison TA, Paillet C, et al. Autism is a prenatal disorder: Evidence from late gestation brain overgrowth . Autism Res. 2018; ; 11 : :1635.–1642. |