| |
| Med Sci (Paris). 38(5): 428–430. doi: 10.1051/medsci/2022047.Les neurones produisant la gonadolibérine sculptent leur environnement neuroglial dans la petite enfance Ariane Sharif1* and Vincent Prévot1** 1Univ. Lille, Inserm, CHU Lille, Équipe Développement et plasticité du cerveau neuroendocrine, FHU 1000 jours pour la santé, Lille neuroscience et cognition, UMR-S1172, 1 place de Verdun, 59045Lille Cedex, France MeSH keywords: Matrice extracellulaire, Fibrose, Humains, Intégrines, Myocarde, anatomopathologie |
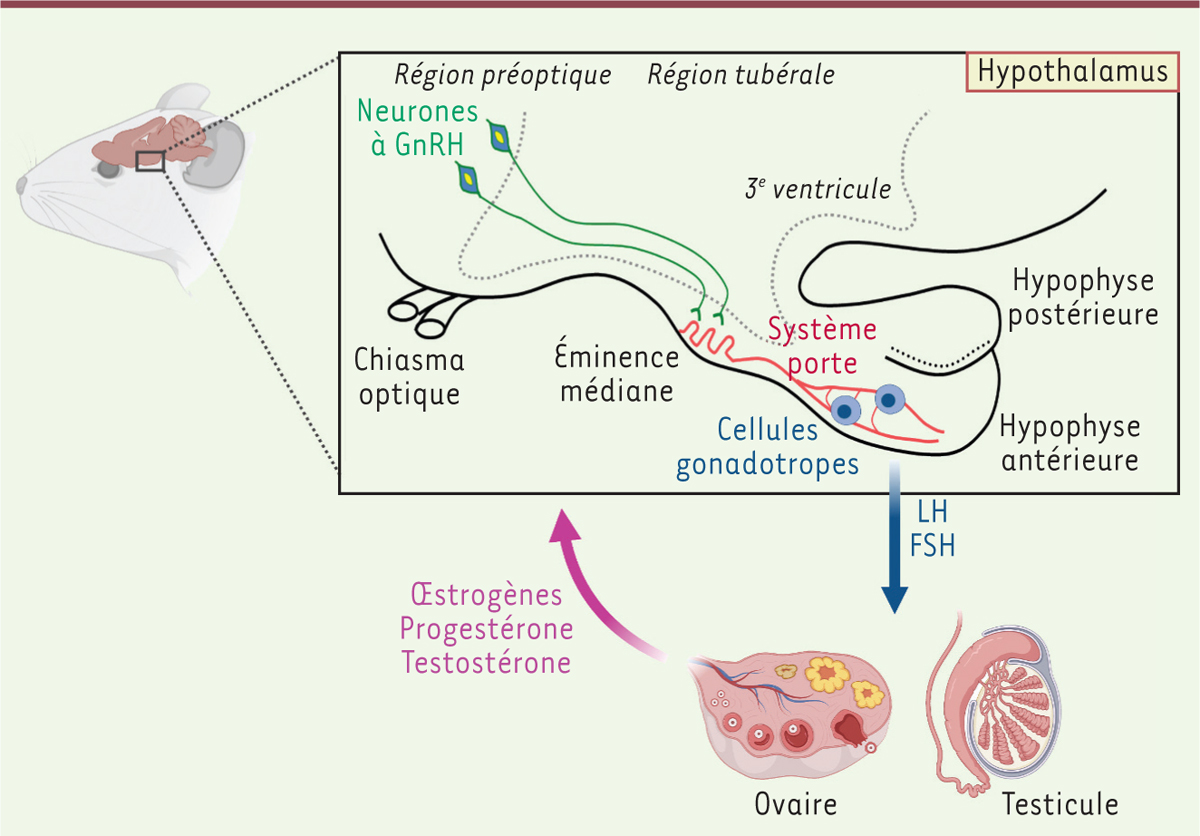
Les neurones produisant la GnRH : chefs d’orchestre de l’axe gonadotrope La fonction de reproduction des mammifères est contrôlée par une petite population de neurones produisant la gonadolibérine (GnRH, pour gonadotropin-releasing hormone), l’hormone qui contrôle la maturation sexuelle à la puberté, puis la fertilité. Ces neurones, dont les corps cellulaires sont principalement localisés dans l’aire préoptique de l’hypothalamus1, chez le rongeur, projettent leurs axones dans l’éminence médiane2,, où ils libèrent la GnRH dans le système porte hypothalamo-hypophysaire3. La GnRH atteint ainsi l’hypophyse antérieure, où elle stimule la libération des gonadotrophines, l’hormone lutéinisante (LH) et l’hormone folliculo-stimulante (FSH), responsables de la production par les gonades (testicules ou ovaires) des gamètes (spermatozoïdes ou ovocytes) et des hormones sexuelles (testostérone ou œstrogènes et progestérone). Ces dernières exercent un rétrocontrôle sur l’hypothalamus et l’hypophyse pour contrôler finement la libération de la GnRH et des hormones gonadotropes (Figure 1) [1].  | Figure 1. Représentation schématique de l’axe hormonal gonadotrope chez le rongeur. LH : hormone lutéinisante ; FSH : hormone folliculo-stimulante (figure créée avec Biorender). |
La libération de la GnRH dans le système porte hypothalamo-hypophysaire résulte de la mise en jeu de divers mécanismes impliquant les corps cellulaires des neurones qui la produisent et leurs neurites, et qui conditionnent l’activité électrique de ces cellules, l’exocytose de l’hormone, ou encore l’accès des terminaisons axonales aux capillaires du système porte, en réponse à des signaux internes (hormones sexuelles, statut métabolique, etc.) ou environnementaux, tels que la photopériode. Les neurones produisant la GnRH font partie d’un réseau fonctionnel constitué non seulement de différentes populations neuronales (glutamatergiques, GABAergiques, kisspeptinergiques, etc.), mais également de cellules gliales [1, 2]. Par exemple, le glutamate libéré par les afférences excitatrices des neurones à GnRH stimule leur activité électrique directement, mais aussi par l’intermédiaire des astrocytes environnants, qui y répondent en produisant le gliotransmetteur excitateur prostaglandine E2 (PGE2) [3]. |
Pendant la vie embryonnaire, les neurones synthétisant la GnRH, d’abord situés dans les placodes olfactives, donc en dehors du cerveau, migrent vers le cerveau pour gagner ensuite la région hypothalamique, où ils s’établissent [4] (→). (→) Voir la Nouvelle de A.L. Barbotin et al., m/s n° 4, avril 2017, page 376 Si le système est structurellement en place à la naissance, un long processus de maturation postnatale est requis pour permettre à ces neurones d’acquérir l’activité électrique et sécrétoire nécessaire au déclenchement de la puberté et à l’acquisition de la fertilité [5]. Ce processus de maturation débute par un évènement survenant au cours des premières semaines de vie postnatale, la « minipuberté », qui correspond à la première activation d’origine centrale de l’axe gonadotrope, indépendante des gonades et nécessaire à leur maturation [6, 7]. Un des enjeux majeurs de la recherche sur la fonction reproductrice est d’identifier les mécanismes moléculaires et cellulaires qui contrôlent la maturation de l’axe gonadotrope et le déclenchement de la puberté au moment opportun. Des travaux récents ont révélé certains des déterminants génétiques qui permettent l’augmentation postnatale de la sécrétion de GnRH nécessaire à la maturation sexuelle [8] (→). (→) Voir la Synthèse de A. Messina et al., m/s n° 5, mai 2017, page 506 Cependant, les mécanismes contrôlant l’intégration des neurones à GnRH dans leur réseau neuroglial au cours de la période infantile (qui est caractérisée par une synaptogenèse et une gliogenèse très active dans le système nerveux central [9]) et l’importance de ce processus pour la survenue de la puberté et pour la fertilité restaient inexplorés. |
La période infantile : mise en place d’un partenariat étroit entre neurones produisant la GnRH et astrocytes Nous avons montré que les deux premières semaines de vie postnatale sont marquées par une intense gliogenèse dans la région préoptique de l’hypothalamus chez le rat femelle [10]. En s’intéressant plus spécifiquement aux relations morphologiques entre neurones à GnRH et cellules nouvellement formées, nous avons observé que les cellules qui naissent à proximité des corps cellulaires des neurones à GnRH pendant la deuxième semaine de vie postnatale se différencient principalement en astrocytes et restent associées à leur partenaire neuronal jusqu’à l’âge adulte. Pour évaluer l’importance physiologique de ce phénomène, nous avons perfusé localement un agent antimitotique grâce à un système de microparticules biodégradables, et avons montré que l’inhibition de la gliogenèse infantile dans l’environnement des neurones à GnRH retarde la survenue de la puberté et perturbe la cyclicité œstrale4 à l’âge adulte. |
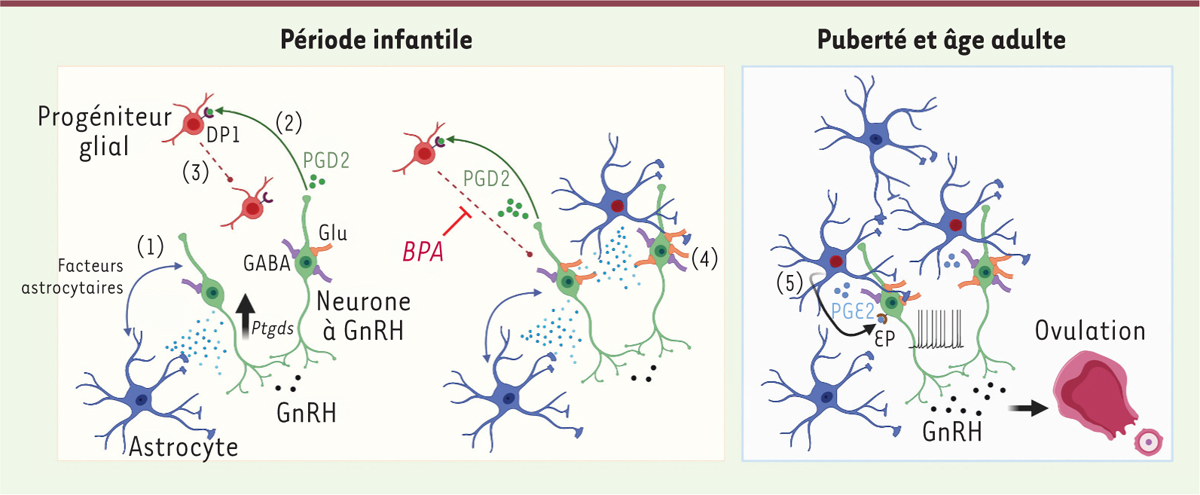
Les neurones synthétisant la GnRH : des recruteurs actifs Étonnamment, nous avons observé que les neurones à GnRH enrichissent leur environnement glial au cours de la période infantile par un processus de recrutement actif impliquant la prostaglandine D2 (PGD2), qui exerce une chimioattraction sur les progéniteurs gliaux environnants en se liant à son récepteur DP1. Cette activité résulte de l’augmentation sélective de l’expression de l’enzyme de synthèse de PGD2, la prostaglandine D2 synthase (PGDS), par les neurones à GnRH en réponse à des facteurs astrocytaires environnants pas encore identifiés (Figure 2) [10].  | Figure 2.Un dialogue précoce entre les neurones produisant la GnRH et les astrocytes, impliqué dans la maturation sexuelle et la fertilité. Au début de la période infantile, les astrocytes situés dans l’entourage des neurones produisant la GnRH sécrètent des facteurs qui stimulent l’expression de Ptgds, le gène codant l’enzyme de synthèse de la prostaglandine D2 (PGD2) dans ces neurones (1). La PGD2 libérée par les neurones à GnRH (2) se lie à son récepteur DP1 sur les progéniteurs gliaux pour les attirer à proximité des corps cellulaires neuronaux (3). Ce processus de recrutement est fortement affecté par une exposition précoce au bisphénol A (BPA). À mesure que les progéniteurs recrutés se différencient en astrocytes, ils fournissent plus de facteurs astrocytaires, contribuant ainsi à amplifier le phénomène d’attraction. La mise en place de la couverture astrocytaire augmente l’activité électrique des neurones à GnRH en favorisant le développement de synapses glutamatergiques sur leurs corps cellulaires (4), en leur fournissant plus d’un gliotransmetteur excitateur, la prostaglandine E2 (PGE2) (5), et en augmentant le nombre de récepteurs EP de PGE2. Tous ces mécanismes contribuent à la maturation de l’activité électrique et sécrétoire des neurones à GnRH, permettant la survenue de la première ovulation, qui marque la puberté, puis la mise en route des cycles œstraux. Glu : afférence glutamatergique ; GABA : afférence GABAergique (figure adaptée de [ 10]). |
|
Des partenaires astrocytaires indispensables pour une maturation sexuelle correcte Afin d’évaluer l’importance du recrutement astrocytaire par les neurones à GnRH pour leur maturation, nous avons bloqué ce processus en perfusant localement un inhibiteur pharmacologique du récepteur DP1 durant la période infantile. Ce traitement a affecté l’intégration des neurones à GnRH dans leur circuit neuronal en diminuant le nombre de synapses glutamatergiques sur leurs corps cellulaires. Il a également perturbé la communication des neurones à GnRH avec les astrocytes environnants car, outre la diminution du nombre de ces cellules gliales, il a induit une diminution d’expression des récepteurs du gliotransmetteur excitateur PGE2 qu’elles libèrent. Cette baisse des influences neurogliales excitatrices sur les neurones à GnRH s’est traduite par une réduction de leur activité électrique spontanée, probablement responsable de l’atténuation de la libération de FSH marquant la survenue de la minipuberté. Ultérieurement, cette perturbation du recrutement astrocytaire par les neurones à GnRH durant la période infantile a également entraîné un retard dans la mise en place de cycles œstraux réguliers (Figure 2) [10]. |
Le recrutement astrocytaire, cible d’un perturbateur endocrinien Les perturbateurs endocriniens sont des substances naturelles ou artificielles qui interfèrent avec le fonctionnement des systèmes endocriniens par des mécanismes encore mal connus. L’exposition à certains polluants environnementaux tels que les bisphénols ou les phtalates perturbe le déclenchement de la puberté, la fertilité ou le comportement de reproduction [11, 12] (→). (→) Voir la Nouvelle de N. Adam et S. Mhaouty-Kodja, m/s n° 11, novembre 2021, page 973 Le bisphénol A, un agent plastifiant communément utilisé dans l’industrie, est un perturbateur endocrinien5. Une étude réalisée chez le rat a montré que l’exposition à de très faibles doses de bisphénol A pendant la période postnatale affecte le profil de libération de la GnRH et tend à retarder la puberté [13]. Nos travaux ont montré que le même traitement diminue fortement la capacité des neurones à GnRH à recruter des astrocytes dans leur entourage immédiat pendant la période infantile [10]. Par analogie avec les effets de la diminution du recrutement astrocytaire induite par l’inhibition pharmacologique de DP1, on peut supposer que l’exposition postnatale au bisphénol A perturbe l’intégration des neurones à GnRH dans leur circuit neuroglial, ce qui entraîne une diminution de la libération de l’hormone, qui perturbe la maturation sexuelle. |
Le déclenchement de la puberté et la fertilité dépendent d’une succession de processus qui se mettent en place très tôt au cours du développement. Nos résultats ont contribué à lever le voile sur les mécanismes sous-jacents, en révélant une voie de communication, inconnue jusqu’alors, entre neurones et progéniteurs gliaux, et en montrant que la formation de nouveaux astrocytes pendant la période infantile est impliquée dans le contrôle de la maturation sexuelle et l’acquisition de la fertilité. Ces travaux suggèrent également qu’une exposition précoce à de faibles doses de bisphénol A perturbe la maturation de l’axe hormonal gonadotrope, au moins en partie en empêchant l’acquisition, par les neurones à GnRH, d’un environnement neuroglial approprié pendant la période infantile. Il reste à identifier le mécanisme moléculaire de cet effet délétère du bisphénol A et à rechercher si cet effet peut être également lié à d’autres perturbateurs endocriniens. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1.
Herbison AE. Control of puberty onset and fertility by gonadotropin-releasing hormone neurons . Nat Rev Endocrinol. 2016; ; 12 : :452.–466. 2.
Prevot V, Sharif A. The polygamous GnRH neuron: astrocytic and tanycytic communication with a neuroendocrine neuronal population . J Neuroendocrinol. 2022; doi : 10.1111/jne.13104. 3.
Clasadonte J, Poulain P, Hanchate NK, et al. Prostaglandin E2 release from astrocytes triggers gonadotropin-releasing hormone (GnRH) neuron firing via EP2 receptor activation . Proc Natl Acad Sci USA. 2011; ; 108 : :16104.–16109. 4.
Barbotin AL, Prévot V, Giacobini P. Développement des neurones à GnRH dans le cerveau d’embryons humains . Med Sci (Paris). 2017; ; 33 : :376.–379. 5.
Prevot V. Puberty in mice and rats . In: Knobil and Neill’s Physiology of reproduction. (Fourth edition) , Fourth edition . New York: : Elsevier; , 2015 : :1395.–439. 6.
Kuiri-Hänninen T, Sankilampi U, Dunkel L. Activation of the hypothalamic-pituitary-gonadal axis in infancy: minipuberty . Horm Res Paediatr. 2014; ; 82 : :73.–80. 7.
François CM, Petit F, Giton F, et al. A novel action of follicle-stimulating hormone in the ovary promotes estradiol production without inducing excessive follicular growth before puberty . Sci Rep. 2017; ; 7 : :46222.. 8.
Messina A, Langlet F, Prévot V. Les micro-ARN : nouveaux acteurs du contrôle hypothalamique de la fertilité . Med Sci (Paris). 2017; ; 33 : :506.–511. 9.
Allen NJ, Lyons DA. Glia as architects of central nervous system formation and function . Science. 2018; ; 362 : :181.–185. 10.
Pellegrino G, Martin M, Allet C, et al. GnRH neurons recruit astrocytes in infancy to facilitate network integration and sexual maturation . Nat Neurosci. 2021;; 24 : :1660.–72. 11.
Lopez-Rodriguez D, Franssen D, Bakker J, et al. Cellular and molecular features of EDC exposure: consequences for the GnRH network . Nat Rev Endocrinol. 2021;; 17 : :83.–96. 12.
Adam N, Mhaouty-Kodja S. Perturbation sexuelle par les phtalates : les souris femelles sont plus vulnérables que les souris mâles . Med Sci (Paris). 2021;; 37 : :973.–6. 13.
Franssen D, Gérard A, Hennuy B, et al. Delayed neuroendocrine sexual maturation in female rats after a very low dose of bisphenol A through altered GABAergic neurotransmission and opposing effects of a high dose . Endocrinology. 2016; ; 157 : :1740.–1750. |