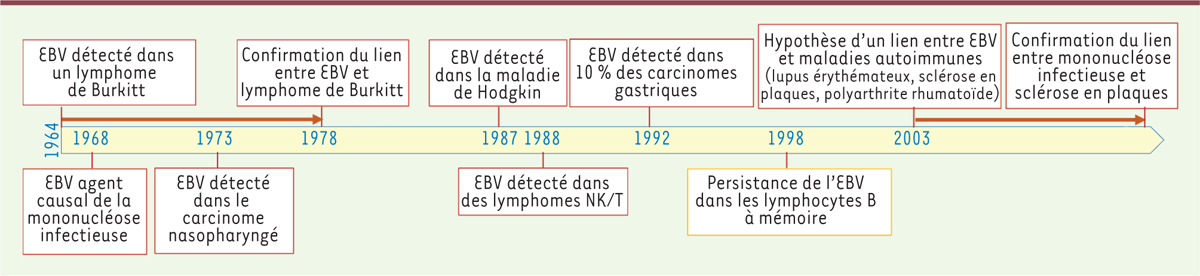
La découverte, en 1964, du virus d’Epstein-Barr (EBV) dans des cellules issues d’un lymphome de Burkitt a constitué une avancée majeure en accréditant pour la première fois l’idée qu’un cancer humain pouvait être d’origine virale. Cependant, le lien a été difficile à établir car l’EBV infecte de manière persistante plus de 90 % de la population adulte, et ce n’est qu’en 1978 que l’association entre EBV et lymphome de Burkitt a pu être démontrée grâce à une étude épidémiologique de grande ampleur [1]. Par la suite, l’EBV a été associé à d’autres cancers, notamment le carcinome nasopharyngé, la maladie de Hodgkin, le lymphome immunoblastique chez les personnes immunodéprimées, un sous-groupe de carcinomes gastriques, de rares lymphomes à lymphocytes T et cellules NK (natural killer), et le léiomyosarcome. Depuis 2003, le virus est également suspecté d’être impliqué dans des maladies auto-immunes comme le lupus érythémateux ou la sclérose en plaques (Figure 1). En effet, on a trouvé des titres élevés d’anticorps anti-EBV chez les individus atteints de ces maladies, et des anticorps dirigés contre certaines protéines virales peuvent réagir de façon croisée avec des protéines du soi, comme la myéline. Par ailleurs, le virus a pu être détecté dans des lésions de sclérose en plaques actives [2]. Comme dans le cas du lymphome de Burkitt, le taux élevé d’infection par l’EBV dans la population adulte rend difficile la démonstration de son rôle dans ces maladies. Or, au début de l’année 2022, les résultats de deux études majeures sont venus renforcer la suspicion d’un rôle important dans la survenue d’une sclérose en plaques [3, 4].
La sclérose en plaques est une maladie chronique inflammatoire qui affecte le système nerveux central en altérant la gaine de myéline qui entoure les axones de nombreux neurones du cerveau et de la moelle épinière. Première cause de handicap non traumatique chez le jeune adulte, elle touche préférentiellement les femmes. Des symptômes souvent peu spécifiques, tels que fatigue et difficulté à marcher, conduisent au diagnostic de la maladie, qui peut ensuite évoluer vers une paralysie. La sclérose en plaques atteint environ 2,8 millions d’individus dans le monde, avec une distribution géographique inégale : maladie commune en Europe, aux États-Unis, au Canada, en Australie et en Nouvelle-Zélande, elle est rare en Afrique et en Asie. Les causes de la maladie sont mal connues, mais de nombreuses études épidémiologiques ont permis d’identifier certains facteurs de risque : facteurs génétiques, comme la prépondérance du variant HLA(human leukocyte antigen)-DR15, et facteurs environnementaux, comme le manque d’exposition à la lumière conduisant à un déficit en vitamine D, ainsi que l’infection par des virus, notamment l’EBV [2].
La primo-infection par l’EBV a lieu le plus souvent pendant la petite enfance de manière asymptomatique, mais lorsqu’elle survient plus tardivement, elle peut provoquer une maladie lymphoproliférative bénigne : la mononucléose infectieuse. Après l’infection, l’EBV persiste sous forme latente dans des lymphocytes B à mémoire, mais il se réactive périodiquement, induisant ainsi une réponse immunitaire, cruciale pour contrôler la capacité du virus à induire la prolifération des lymphocytes B [5]. L’équipe de recherche dirigée par Ascherio [3] vient d’apporter une importante contribution à la démonstration d’un lien entre EBV et sclérose en plaques, grâce à une étude longitudinale de grande envergure menée de 1993 à 2013 sur une cohorte de plus de 10 millions de jeunes adultes engagés dans l’armée américaine, et pour lesquels les chercheurs ont pu disposer d’échantillons sanguins prélevés au moment de leur intégration dans l’armée, puis tous les deux ans. Un total de 955 individus ayant développé une sclérose en plaques ont été diagnostiqués dans cette population, dont 801 ont pu être intégrés dans l’étude. Parmi ceux-ci, 35 étaient séronégatifs pour l’EBV au moment du premier prélèvement. À l’exception d’un seul individu, tous ont été infectés par l’EBV au cours de l’étude, et dans tous les cas, avant l’apparition de la sclérose en plaques. En outre, la recherche d’un marqueur précoce de la sclérose en plaques, le taux sérique de neurofilaments à chaîne légère, dont l’augmentation peut précéder jusqu’à six ans l’apparition de la maladie, indique que l’infection par l’EBV a toujours été antérieure à l’apparition des premiers indicateurs biologiques de la maladie. En revanche, au cours de la même période, seulement la moitié des 107 individus témoins restés exempts de sclérose en plaques ont eu une séroconversion pour l’EBV. Ainsi, les chercheurs ont conclu que l’infection par l’EBV multiplie par 32 le risque de développer une sclérose en plaques, tandis qu’aucune corrélation n’a pu être établie entre la survenue de la sclérose en plaques et les autres infections virales testées par ces chercheurs. Ce résultat suggère que l’infection par l’EBV est une étape critique pour le développement de la sclérose en plaques.
Cependant, la grande majorité des personnes infectées par l’EBV ne développent pas de sclérose en plaques, ce qui indique que l’infection par l’EBV, si elle est nécessaire, n’est pas suffisante. D’autres facteurs doivent être impliqués, comme la présence de l’allèle HLA-DR15, qui semble agir en synergie avec une primo-infection symptomatique par l’EBV [6]. En 2021, l’équipe dirigée par Münz a confirmé la possibilité d’une telle synergie dans un modèle de souris humanisées, en montrant que la réponse immunitaire des animaux portant l’haplotype HLA-DR15 à l’infection par l’EBV était plus faible. De plus, une réactivité croisée contre des cibles allogéniques et un autoantigène de la sclérose en plaques a été mise en évidence dans ce modèle [7].
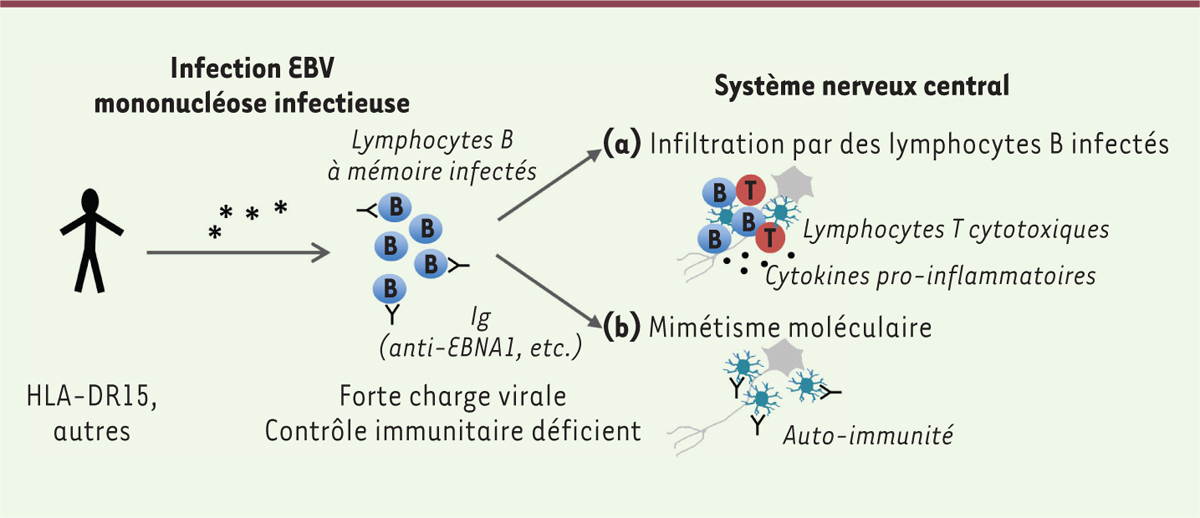
Les mécanismes par lesquels l’infection par l’EBV pourrait participer à l’induction d’une sclérose en plaques restent hypothétiques, mais certaines pièces du puzzle commencent à se mettre en place. De multiples études ont rapporté la présence post-mortem de lymphocytes B infectés par l’EBV dans le cerveau de patients atteints de sclérose en plaques. Ces cellules pourraient être à l’origine d’une réponse innée contribuant à l’environnement inflammatoire, comme la production d’interféron α [8]. Un contrôle défectueux par les lymphocytes T CD8+ cytotoxiques pourrait prédisposer à la sclérose en plaques en permettant aux lymphocytes B auto-réactifs infectés par l’EBV de s’accumuler dans le système nerveux central [9] (Figure 2a). Cette hypothèse est étayée par le constat d’une amélioration clinique et d’une diminution de la production d’immunoglobulines intrathécales chez un patient atteint d’une sclérose en plaques traité avec des lymphocytes T CD8+ spécifiques de l’EBV (vaccin thérapeutique) [10].
| Figure 2. Implication du virus d’Epstein-Barr (EBV) dans le développement de la sclérose en plaques. Après la primo-infection par l’EBV, le virus persiste sous forme latente dans des lymphocytes B à mémoire circulants. Cette persistance s’accompagne de phases de réactivation, qui sont contrôlées très efficacement par le système immunitaire. Dans certaines conditions, des lymphocytes B à mémoire infectés semblent capables d’infiltrer le système nerveux central et d’y induire une inflammation chronique (a) ; en outre, certains anticorps dirigés contre des protéines virales, telles que la protéine EBNA1, s’avèrent capables de reconnaître des protéines du soi exprimées dans le système nerveux central, comme la myéline ou la molécule d’adhérence cellulaire gliale (GlialCAM), induisant ainsi une réaction auto-immune (b). |
Une autre hypothèse, non exclusive de la précédente, est le mimétisme moléculaire entre les antigènes viraux et les antigènes du soi. Cette hypothèse se trouve renforcée par les résultats d’une étude récente de l’équipe dirigée par Robinson [4]. À partir du liquide cérébrospinal d’un patient atteint de sclérose en plaques, ces chercheurs ont isolé un clone de lymphocytes B produisant un anticorps monoclonal qui reconnaît un épitope spécifique de la protéine EBNA1 de l’EBV avec une forte affinité et qui réagit de manière croisée avec la molécule d’adhérence cellulaire gliale (GlialCAM) exprimée dans le système nerveux central (Figure 2b). Cette présence d’anticorps reconnaissant à la fois EBNA1 et GlialCAM (réaction « croisée ») est retrouvée chez 20 à 25 % des individus atteints de sclérose en plaques, mais pas chez des individus sains, qui présentent une réactivité plasmatique uniquement contre EBNA1. De surcroît, l’immunisation de souris modèles pour la sclérose en plaques avec cet épitope particulier de EBNA1 exacerbe la démyélinisation auto-immune induite chez ces souris, démontrant l’existence d’un lien mécanistique entre l’infection par l’EBV et la sclérose en plaques.
Ainsi, il semble qu’il existe un lien entre l’infection par l’EBV et l’apparition d’une sclérose en plaques. Cependant, les cofacteurs impliqués dans le développement de cette maladie neurodégénérative sont encore loin d’être identifiés, et la raison pour laquelle les femmes y sont plus susceptibles reste mystérieuse. À ce jour, il n’existe pas de traitement curatif ou prophylactique de l’infection par l’EBV. La mise au point d’un vaccin ciblant les jeunes adultes non encore infectés par l’EBV pourrait être déterminante dans la prévention de la sclérose en plaques.