| |
| Med Sci (Paris). 38(5): 419–422. doi: 10.1051/medsci/2022048.Le virus SARS-CoV-2 utilise différentes voies d’entrée pour infecter les cellules Jana Koch,1a Zina M. Uckeley,1b and Pierre-Yves Lozach1,2c 1CellNetworks - Cluster of excellence and department of infectious diseases, virology, University Hospital Heidelberg, Heidelberg, Allemagne 2Univ. Lyon, INRAE, EPHE, IVPC, Lyon, France MeSH keywords: Fécondité, Hormone de libération des gonadotrophines, Humains, Névroglie, Neurones, Maturation sexuelle, physiologie |
Le virus SARS-CoV-2 (severe acute respiratory syndrome coronavirus 2) n’a plus besoin d’être présenté tant est grand l’impact sociétal de la pandémie de COVID-19 (coronavirus disease 2019) causée par ce nouveau coronavirus [1] (→). (→) Voir l’Éditorial de C. Bréchot, m/s n° 12, décembre 2020, page 117 Depuis son émergence à la fin de l’année 2019, la souche originale a été supplantée par de nombreux variants qui, collectivement, ont infecté près de 500 millions de personnes dans le monde, dont plus de 6 millions ont succombé à l’infection1. Idéalement, prévenir la dissémination virale et l’infection nécessite des approches ciblant les interactions précoces entre le virus et son hôte, avant que le virus commence à se répliquer. Il est donc important d’élucider les mécanismes moléculaires régissant l’attachement du virus aux cellules hôtes et sa pénétration dans le cytoplasme. Notre équipe de recherche a contribué à caractériser le processus d’entrée cellulaire de particules virales issues de la souche originale du SARS-CoV-2, celle circulant au début de la pandémie en 2020 [2]. |
L’activation du virus SARS-CoV-2 s’achève lors de son entrée dans les cellules cibles Nous nous sommes d’abord intéressés aux particules virales et à la protéine spike du SARS-CoV-2. Comme les autres coronavirus, le SARS-CoV-2 est enveloppé et exprime à sa surface des trimères de la protéine spike, elle-même constituée de deux sous-unités, S1 et S2 (Figure 1A) [3, 4]. La sous-unité S1 contient le domaine de liaison au récepteur ACE2 (angiotensin-converting enzyme 2), impliqué dans l’attachement du virus à la surface de divers types cellulaires. La sous-unité S2 contient la séquence peptidique impliquée dans la fusion de l’enveloppe des particules virales avec les membranes cellulaires, un prérequis au transfert du génome viral dans le cytosol. La protéine spike ne devient active qu’à la suite de son clivage aux sites S1/S2 et S2’ par des protéases cellulaires (Figure 1A), comme la furine dans les cellules produisant de nouvelles particules virales, ou encore TMPRSS2 (transmembrane serine protease 2) et certaines cathepsines dans les cellules que ces particules virales vont infecter [5]. 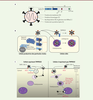 | Figure 1. Interactions précoces entre le virus SARS-CoV-2 et les cellules hôtes. A) Particule virale de SARS-CoV-2 et sa protéine spike. B) Le cycle du virus SARS-CoV-2 dépend étroitement de l’activation protéolytique de la protéine spike, à la fois dans les cellules productrices des particules virales et dans leurs cellules cibles. C) Le virus SARS-CoV-2 utilise deux voies distinctes et mutuellement exclusives pour entrer dans les cellules hôtes. aa : acide aminé ; DLR : domaine de liaison aux récepteurs ; DNT : domaine N-terminal ; PF : peptide de fusion ; TM : domaine transmembranaire ; ACE2 : angiotensin-converting enzyme 2 ; TMPRSS2 : transmembrane serine protease 2. |
Nous avons montré que seulement un tiers des protéines spike sont clivées à la surface du SARS-CoV-2, avant que le virus ne rencontre ses cellules cibles, ce qui est en accord avec les résultats d’une étude structurale suggérant que la furine ne clive qu’une seule molécule dans les trimères de spike [6]. L’exposition des particules virales à un excès de furine exogène n’a pas permis d’obtenir une plus grande maturation protéolytique de spike. À l’inverse, une exposition à des protéases mimant l’activité protéolytique de TMPRSS2 et de la cathepsine L a conduit à un clivage complet de spike au site S1/S2. Afin d’évaluer l’importance de la maturation protéolytique de spike pour sa capacité fusogénique, nous avons utilisé un modèle expérimental dans lequel des protéines spike présentes à la surface des cellules infectées provoquent, si elles sont actives, la fusion entre cellules voisines, et in fine, la formation de cellules multinucléées ou syncytia [7]. Dans cette approche fonctionnelle, seule l’expression de TMPRSS2 à la membrane des cellules cibles, ou un prétraitement des cellules par une protéase exogène mimant l’activité protéolytique de TMPRSS2, mais pas par de la furine exogène, a permis d’obtenir de nombreux syncytia. Ces résultats semblent donc confirmer que, si l’activation des particules virales du SARS-CoV-2 débute probablement par l’action de la furine des cellules qui les produisent, elle s’achève avec le clivage protéolytique de la protéine spike par TMPRSS2 ou la cathepsine L des cellules qu’elles vont ensuite infecter (Figure 1B). |
Le virus SARS-CoV-2 peut utiliser deux voies distinctes pour atteindre le cytoplasme La protéase TMPRSS2 est présente à la surface de la membrane plasmique, où elle est active à pH neutre, alors que la cathepsine L est active dans les endolysosomes, à un pH très acide (Figure 1C). Nous avons cherché à savoir si, pour permettre la fusion du SARS-CoV-2 avec les membranes cellulaires, l’activation de la protéine spike requiert un clivage protéolytique d’abord par TMPRSS2 puis par la cathepsine L. Nous avons sélectionné deux groupes de cellules épithéliales pourvues de la cathepsine L et connues pour leur sensibilité à l’infection par le SARS-CoV-2, mais qui différaient, entre autres, par l’expression ou l’absence de TMPRSS2. Nous avons constaté que l’ajout d’un agent chimique neutralisant le pH des endosomes, comme la chloroquine, ou l’ajout d’un inhibiteur des cathepsines, bloquait l’infection uniquement dans les cellules dépourvues de TMPRSS2. Par ailleurs, l’ajout d’un inhibiteur de TMPRSS2 à des cellules exprimant cette protéase les rendait insensibles à l’infection, malgré la présence de la cathepsine L. Ces résultats indiquent que, dans le cas où TMPRSS2 est inhibée à la surface cellulaire, la cathepsine L des endolysosomes ne suffit pas à activer les particules virales de SARS-CoV-2. D’où l’hypothèse que TMPRSS2 aiguillerait ces particules virales vers une voie spécifique, indépendante de celle de la cathepsine L. Nous avons observé que l’activation et la pénétration des particules virales dans les cellules exprimant TMPRSS2 est beaucoup plus rapide (5 à 10 minutes) que dans les cellules qui en sont dépourvues (40 à 60 minutes). Notre étude suggère donc que le virus SARS-CoV-2 peut utiliser au moins deux voies distinctes pour pénétrer dans ses cellules cibles et les infecter : une voie rapide, indépendante de l’acidité des endosomes, dans les cellules produisant TMPRSS2, et une voie lente, nécessitant un pH acide, dans les cellules dépourvues de cette protéase. |
La présence de la protéase membranaire TMPRSS2 conditionne la voie d’entrée du SARS-CoV-2 dans les cellules En l’absence de TMPRSS2, nos résultats suggèrent que le virus SARS-CoV-2 a besoin d’atteindre les endolysosomes pour être activé par la cathepsine L (Figure 1C). Nous avons donc examiné l’effet de perturbateurs du trafic des endolysosomes [8] sur l’infection de cellules dépourvues de TMPRSS2. Nous avons observé que l’inactivation transitoire de la petite GTPase Rab7, un acteur clé des endosomes tardifs, inhibe l’infection par le virus. Nous avons ensuite testé l’effet du colcémide, qui interfère avec la polymérisation des microtubules, et du composé MG-132, un inhibiteur du protéasome qui déplète le cytosol de l’ubiquitine libre. Ces substances, qui agissent sur des mécanismes cellulaires cruciaux pour le trafic et la maturation des endolysosomes, ont toutes deux bloqué l’infection par le virus SARS-CoV-2, avec, pour MG-132, une très grande efficacité à de très faibles concentrations (IC502 de l’ordre de la dizaine de nM). Ces résultats ont confirmé le passage de SARS-CoV-2 par les endolysosomes pour infecter les cellules dépourvues de TMPRSS2, c’est-à-dire lorsque l’activation de la protéine spike dépend de l’activité de la cathepsine L. Pour corréler la présence de TMPRSS2 avec la voie d’entrée du SARS-CoV-2, nous avons surexprimé de manière stable la protéase dans les cellules épithéliales qui en étaient originellement dépourvues, ce qui a restauré non seulement la sensibilité de l’infection par SARS-CoV-2 aux inhibiteurs de TMPRSS2, mais aussi l’indépendance du virus vis-à-vis de l’acidification des endosomes et de la cathepsine L pour pénétrer dans la cellule hôte. Globalement, notre travail a permis de montrer le rôle central de la protéase transmembranaire TMPRSS2 dans l’entrée cellulaire du virus SARS-CoV-2. TMPRSS2 est le principal déterminant de la voie rapide, indépendante de l’acidité des endosomes, empruntée par SARS-CoV-2 pour pénétrer dans les cellules qui produisent cette protéase. Il reste à déterminer si le virus entre dans le cytosol depuis la membrane plasmique ou via les endosomes précoces (Figure 1C). Incidemment, les résultats d’une étude récente ont montré que les variants les plus pathogènes d’un autre coronavirus humain infectent leurs cellules cibles préférentiellement grâce à l’action de la protéase TMPRSS2 [10]. |
L’activation protéolytique de la protéine spike est nécessaire et suffisante pour la fusion membranaire du virus SARS-CoV-2 Il apparaît que la protéine spike du SARS-CoV-2 achève la fusion membranaire sans nécessiter une exposition à un milieu acide, comme nous l’avons montré dans le modèle de fusion cellule-cellule, où la protéine spike promeut la formation de syncytia à la suite de son activation protéolytique à un pH neutre. Nous l’avons ensuite confirmé en activant les particules virales avec un traitement protéolytique avant d’infecter les cellules : le virus prétraité et complètement activé ne dépendait plus de l’acidification des endosomes pour pénétrer dans les cellules dépourvues de TMPRSS2. Nos résultats indiquent que le clivage protéolytique de la protéine spike est à la fois suffisant et nécessaire pour la fusion membranaire du SARS-CoV-2. Dans ce scénario, le milieu acide des endolysosomes est important pour l’activité de la cathepsine L qui active la protéine spike du SARS-CoV-2 dans les cellules dépourvues de TMPRSS2, et non pas pour la fusion du virus. |
Les résultats de nos travaux suggèrent donc que les particules virales de SARS-CoV-2 peuvent pénétrer dans les cellules par deux voies distinctes, mutuellement exclusives (Figure 1C). Ils montrent également qu’il existe un lien étroit entre les cellules productrices et les cellules cibles de ces particules virales pour leur activation complète. Après l’action des protéases qui, dans les cellules productrices du virus, commencent à cliver la protéine spike pour l’activer, d’autres protéases peuvent achever l’activation de cette protéine dans les cellules cibles. L’aptitude du virus SARS-CoV-2 à être activé par diverses protéases est vraisemblablement à l’origine de la capacité de ce virus à utiliser plusieurs voies d’entrée et à infecter une grande variété d’organes et de tissus. Au cours de la pandémie actuelle, la souche originale du virus SARS-CoV-2 a été supplantée par de nombreux variants comportant diverses mutations du gène codant la protéine spike. Quels sont les mécanismes impliqués dans la pénétration de ces variants dans leurs cellules cibles? Existe-t-il un lien entre les voies d’entrée cellulaire de ces variants, leur tropisme et leur virulence ? Qu’en est-il du variant omicron apparu à la fin de l’année 2021, et qui semble infecter les cellules essentiellement par la voie de l’endocytose, indépendamment de la protéase membranaire TMPRSS2 [9] ? Des travaux de recherche portant sur différents variants du virus SARS-CoV-2 sont en cours pour tenter de répondre à ces questions. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1.
Bréchot C. La pandémie due au SARS-CoV-2 : plus qu’une grave crise sanitaire, un changement d’époque et des leçons à en tirer d’urgence . Med Sci (Paris). 2020;; 36 : :1107.–8. 2.
Koch J, Uckeley ZM, Doldan P, et al. TMPRSS2 expression dictates the entry route used by SARS-CoV-2 to infect host cells . EMBO J. 2021;; 40 : :e107821.. 3.
Ke Z, Oton J, Qu K, et al. Structures and distributions of SARS-CoV-2 spike proteins on intact virions . Nature. 2020;; 588 : :498.–502. 4.
Cai Y, Zhang J, Xiao T, et al. Distinct conformational states of SARS-CoV-2 spike protein . Science. 2020;; 369 : :1586.–92. 5.
Tang T, Jaimes JA, Bidon MK, et al. Proteolytic activation of SARS-CoV-2 Spike at the S1/S2 boundary: Potential role of proteases beyond furin . ACS Infect Dis. 2021;; 7 : :264.–72. 6.
Wrobel AG, Benton DJ, Xu P, et al. SARS-CoV-2 and bat RaTG13 spike glycoprotein structures inform on virus evolution and furin-cleavage effects . Nat Struct Mol Biol. 2020;; 27 : :763.–7. 7.
Koch J, Uckeley ZM, Lozach PY. SARS-CoV-2 variants as super cell fusers: cause or consequence of COVID-19 severity? EMBO J. 2021;; 40 : :e110041.. 8.
Lozach PY, Huotari J, Helenius A. Late-penetrating viruses . Curr Opin Virol. 2011; ; 1 : :35.–43. 9.
Willett BJ, Grove J, MacLean OA, et al. The hyper-transmissible SARS-CoV-2 Omicron variant exhibits significant antigenic change, vaccine escape and a switch in cell entry mechanism . medRxiv. 2022 : 2022.01.03.21268111.. 10.
Shirato K, Kanou K, Kawase M, Matsuyama S. Clinical isolates of human coronavirus 229E bypass the endosome for cell entry . J Virol. 2017; ; 91 : |