| |
| Med Sci (Paris). 38(5): 416–418. doi: 10.1051/medsci/2022049.Rôles de l’immaturité des barrières épithéliales et du microbiote intestinal dans la susceptibilité néonatale à la méningite Laetitia Travier1* and Marc Lecuit1,2,3** 1Institut Pasteur, Université Paris Cité, Inserm U1117, Biology of Infection Unit, 75015Paris, France 2Institut Pasteur, Centre national de référence des Listeria et Centre collaborateur de l'OMS sur les Listeria75015Paris, France 3Hôpital Necker-Enfants malades AP-HP, Service des maladies infectieuses et tropicales, Institut Imagine, 75015Paris, France MeSH keywords: Microbiome gastro-intestinal, Humains, Nouveau-né, Méningite |
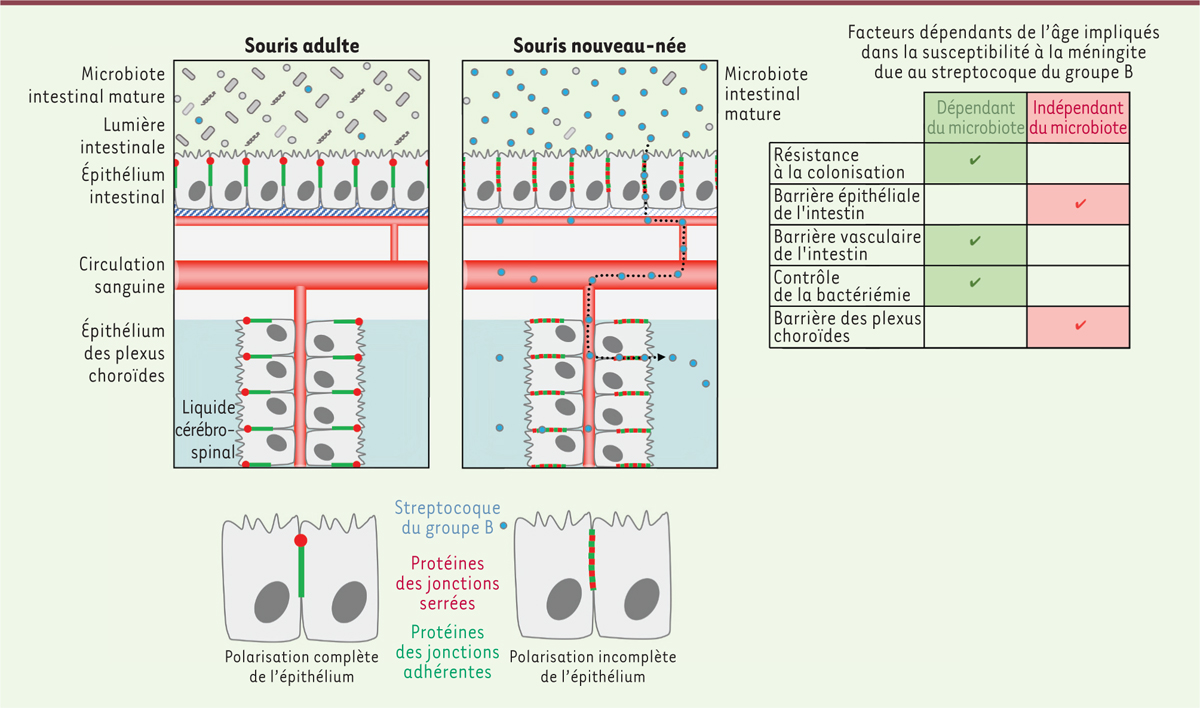
Les méningites bactériennes sont la conséquence de l’accès au système nerveux central de bactéries pathogènes qui ont traversé la barrière hémato-encéphalique au niveau des micro-vaisseaux cérébraux, de la barrière hémato-méningée et/ou des plexus choroïdes (barrière sang-liquide cérébro-spinal) [1]. Les nouveau-nés ont une susceptibilité plus grande que les adultes aux méningites bactériennes, et l’infection méningée est une complication fréquente des bactériémies néonatales. Les méningites bactériennes néonatales sont presque toutes causées par des bactéries commensales intestinales, au premier rang desquelles Streptococcus agalactiae (streptocoque du groupe B) et Escherichia coli [2, 3]. Il existe deux types d’infection néonatale par le streptocoque du groupe B : le syndrome précoce qui survient au cours de la première semaine de vie et résulte de l’inhalation de cette bactérie pendant l’accouchement, et le syndrome tardif qui se développe de sept jours à trois mois après la naissance et résulte de la transmission de la bactérie de la mère à l’enfant par voie orale, suivie d’une colonisation intestinale [3, 4]. La majorité des cas de méningite néonatale due au streptocoque du groupe B correspond au syndrome tardif [2]. |
La sensibilité à la méningite due au streptocoque du groupe B dépend de l’âge et du microbiote intestinal Le mise en place du microbiote intestinal est progressive. Il est d’abord constitué d’espèces bactériennes d’origine maternelle acquises à la naissance, puis sa composition évolue en réponse aux changements du régime alimentaire et à l’ingestion de bactéries environnementales. Le microbiote intestinal contribue à l’absorption des nutriments et confère une résistance à la colonisation de la lumière intestinale par les bactéries ingérées [5]. Il est également impliqué dans l’homéostasie de la barrière intestinale [6] et la maturation du système immunitaire [7]. Nous avons cherché à comprendre les raisons de la susceptibilité néonatale à la méningite due au streptocoque du groupe B dans le cadre du syndrome tardif. Notre première hypothèse était que l’immaturité du microbiote des nouveau-nés pourrait jouer un rôle dans leur susceptibilité accrue à ce type de méningite. Pour tester cette hypothèse, nous avons utilisé des souris d’âge croissant chez lesquelles le microbiote évolue avec celui-ci (souris conventionnelles) ou dépourvues de microbiote (souris axéniques), auxquelles nous avons inoculé par voie orale le streptocoque du groupe B. Ces expériences ont montré que la charge en streptocoque du groupe B diminue avec l’âge dans les tissus intestinaux et le cerveau des souris conventionnelles. Chez les souris adultes, l’infection des tissus intestinaux et du cerveau des animaux axéniques est plus importante que celle des souris conventionnelles, ce qui montre que le microbiote joue un rôle protecteur vis-à-vis de la méningite due au streptocoque du groupe B. Toutefois, la charge en streptocoque du groupe B chez les animaux adultes conventionnels et les les animaux adultes axéniques est plus faible que chez les nouveau-nés, ce qui suggère que la sensibilité néonatale au streptocoque du groupe B n’est pas uniquement liée à l’immaturité du microbiote et qu’elle dépend également de l’âge en tant que tel. |
Impact du microbiote intestinal sur la sensibilité néonatale à l’infection par le streptocoque du groupe B Pour tenter de comprendre l’impact du microbiote intestinal sur la sensibilité néonatale à la méningite, nous avons d’abord évalué la résistance à la colonisation intestinale par le streptocoque du groupe B en fonction de l’âge et du microbiote. La quantité de streptocoques du groupe B dans la lumière intestinale, cinq jours après inoculation orale, est plus faible chez les souris conventionnelles que chez les souris axéniques. De plus, elle diminue avec l’âge, parallèlement à la maturation du microbiote. La quantité de streptocoques du groupe B dans la lumière intestinale est corrélée avec celle mesurée dans le tissu intestinal, ce qui montre que le microbiote réduit la colonisation de la lumière intestinale par le streptocoque du groupe B et tend ainsi à limiter l’invasion des tissus par cette bactérie. L’analyse du tissu intestinal par microscopie et la mesure de l’expression des protéines de jonctions de l’épithélium et de l’endothélium du tissu intestinal montrent qu’alors que le microbiote n’influe pas sur les jonctions épithéliales, il module la perméabilité des vaisseaux sanguins de la lamina propria de l’intestin, ce qui peut favoriser le passage dans la circulation sanguine des streptocoques du groupe B ayant franchi l’épithélium intestinal [8, 9]. Nous avons ensuite étudié la capacité de souris d’âge croissant, conventionnelles ou axéniques, à contrôler l’infection générale par le streptocoque du groupe B, en leur inoculant la bactérie par voie intrapéritonéale. Nous avons ainsi montré que le contrôle de l’infection générale par ce streptocoque dépend de la maturité du microbiote. L’absence de microbiote intestinal mature chez les souriceaux conventionnels et chez les souris axéniques contribue à produire une charge bactérienne globale plus élevée et favorise le transfert du streptocoque du groupe B du sang vers le système nerveux central. |
Permissivité de la barrière intestinale en fonction de l’âge L’inoculation par voie orale du streptocoque du groupe B ou de dextran conjugué à une molécule fluorescente a montré que la permissivité de la barrière intestinale est modulée avec l’âge, indépendamment du microbiote. L’analyse par microscopie, après immuno-marquage, des jonctions intercellulaires de l’épithélium intestinal a révélé que la E-cadhérine, une protéine des jonctions adhérentes, est moins abondante, et que la localisation polarisée de cette protéine et des protéines des jonctions serrées adjacentes est altérée chez les souris nouveau-nées par rapport aux souris adultes (Figure 1). Ces résultats suggèrent que les jonctions adhérentes et serrées de l’épithélium intestinal des animaux nouveau-nés sont moins cohésives que celles des animaux adultes, ce qui concorde avec une moindre fonction barrière de l’épithélium intestinal au cours de la période néonatale. Après inoculation par voie orale, le streptocoque du groupe B est observé au sein des jonctions intercellulaires de l’intestin des souris nouveau-nées, ce qui suggère que la bactérie tire parti de l'étanchéité moindre de ces jonctions pour traverser la barrière intestinale par voie paracellulaire.  | Figure 1. Facteurs impliqués dans la sensibilité des nouveau-nés au syndrome tardif de méningite due au streptocoque du groupe B.
|
La localisation polarisée de la E-cadhérine aux jonctions adhérentes nécessite son interaction avec la β-caténine. L’activation de la voie de signalisation Wnt permet la translocation nucléaire de la β-caténine et l’induction de la transition épithélio-mésenchymateuse, par l’expression de gènes qui contrôlent négativement l’expression et la polarisation de la E-cadhérine et des autres protéines de jonction [9]. Compte tenu de la quantité plus faible de E-cadhérine dans les jonctions intercellulaires de l’épithélium intestinal en période néonatale, nous avons analysé la localisation de la β-caténine et l’activité de la voie Wnt dans l’intestin des souris nouveau-nées et adultes. Chez les animaux nouveau-nés, la b-caténine et la E-cadhérine sont davantage concentrées dans le cytoplasme des entérocytes qu’aux jonctions intercellulaires par rapport aux adultes. L’expression des facteurs impliqués dans la transition épithélio-mésenchymateuse est également plus élevée dans l’intestin des nouveau-nés que dans celui des adultes, reflétant une activation de la voie Wnt, comme attendu pour un tissu à croissance rapide. Cette activité accrue de la voie Wnt dans l’épithélium intestinal en période néonatale coïncide avec la moindre polarisation de l’épithélium intestinal à cette période de la vie et une moindre fonction barrière de cet épithélium. |
Permissivité des plexus choroïdes en fonction de l’âge Nous avons ensuite cherché à savoir si la barrière hémato-encéphalique néonatale (micro-vaisseaux cérébraux, barrière hémato-méningée et plexus choroïdes) est plus perméable au streptocoque du groupe B que celle des adultes. À l’aide d’une modélisation mathématique des charges infectieuses dans les différents compartiments anatomiques infectés et d’observations par microscopie, nous avons déterminé que les plexus choroïdes sont la principale interface de la barrière hémato-encéphalique ciblée par le streptocoque du groupe B, et que les bactéries atteignent en majorité la barrière hémato-méningée via le liquide cérébro-spinal, dans lequel elles s’accumulent. De plus, la perméabilité des plexus choroïdes au bleu d’Evans est plus élevée chez les souris nouveau-nées que chez les animaux adultes, de façon indépendante de leur microbiote intestinal. L’analyse des jonctions épithéliales des plexus choroïdes par microscopie a révélé que durant la période néonatale, les jonctions intercellulaires des plexus choroïdes sont moins structurées qu’à l’âge adulte, semblent être localement disjointes, et que la localisation de la E-cadhérine y est différente de celle à l’âge adulte. Les gènes codant la E-cadhérine et les protéines de jonctions serrées sont moins transcrits que chez les animaux adultes, tandis que ceux codant les facteurs de la transition épithélio-mésenchymateuse le sont davantage. Ces observations indiquent que les jonctions adhérentes et serrées des plexus choroïdes ne sont pas aussi polarisées et cohésives durant la période néonatale que chez l’adulte, ce que reflète, comme dans l’intestin, une activité plus élevée de la voie de signalisation Wnt (comme attendu pour un tissu à croissance rapide). Un traitement des souris nouveau-nées par la metformine, qui stabilise les jonctions serrées [10], permet une diminution de la charge bactérienne en streptocoques du groupe B dans les plexus choroïdes et la barrière hémato-méningée, par le biais d’un renforcement de la fonction barrière des plexus choroïdes. En résumé, nous avons montré l’implication de l’immaturité du microbiote intestinal ainsi que d’autres facteurs liés au jeune âge dans la grande sensibilité néonatale au syndrome tardif de méningite due au streptocoque du groupe B. L’immaturité du microbiote facilite la colonisation de la lumière intestinale par ces bactéries, leur passage à travers la paroi des vaisseaux de la muqueuse intestinale, et favorise donc la bactériémie. De plus, la moindre polarisation des jonctions intercellulaires de l’épithélium intestinal et des plexus choroïdes au cours de la période néonatale, en raison d’une activité plus élevée de la voie de signalisation Wnt, favorise le passage de ces bactéries à travers la barrière intestinale et les plexus choroïdes (Figure 1). |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1.
Disson O, Lecuit M. Targeting of the central nervous system by Listeria monocytogenes . Virulence. 2012; ; 3 : :213.–221. 2.
Romain AS, Cohen R, Plainvert C, et al. Clinical and laboratory features of group B Streptococcus meningitis in infants and newborns : Study of 848 cases in France, 2001–2014 . Clin Infect Dis. 2018; ; 66 : :857.–864. 3.
Tazi A, Plainvert C, Anselem O, et al. Risk factors for infant colonization by hypervirulent CC17 group B Streptococcus: Toward the understanding of late-onset disease . Clin Infect Dis. 2019; ; 69 : :1740.–1748. 4.
Tazi A, Disson O, Bellais S, et al. The surface protein HvgA mediates group B streptococcus hypervirulence and meningeal tropism in neonates . J Exp Med. 2010; ; 207 : :2313.–2322. 5.
Keith JW, Pamer EG. Enlisting commensal microbes to resist antibiotic-resistant pathogens . J Exp Med. 2019; ; 216 : :10.–19. 6.
Belkaid Y, Hand TW. Role of the microbiota in immunity and inflammation . Cell. 2014; ; 157 : :121.–141. 7.
Gensollen T, Iyer SS, Kasper DL, Blumberg RS. How colonization by microbiota in early life shapes the immune system . Science. 2016; ; 352 : :539.–544. 8.
Spadoni I, Zagato E, Bertocchi A, et al. A gut-vascular barrier controls the systemic dissemination of bacteria . Science. 2015; ; 350 : :830.–834. 9.
Coopman P, Djiane A. Adherens junction and E-cadherin complex regulation by epithelial polarity . Cell Mol Life Sci. 2016; ; 73 : :3535.–3553. 10.
Kalsi KK, Garnett JP, Patkee W, et al. Metformin attenuates the effect of Staphylococcus aureus on airway tight junctions by increasing PKCζ-mediated phosphorylation of occludin . J Cell Mol Med. 2019; ; 23 : :317.–327. |