| |
| Med Sci (Paris). 38(4): 366–373. doi: 10.1051/medsci/2022040.Les granulocytes basophiles et les IgE dans l’autoimmunité Mécanismes et cibles thérapeutiques John Tchen1,2 and Nicolas Charles1,2* 1Université Paris Cité, Centre de recherche sur l’inflammation, Inserm UMR1149, CNRS ERL8252, Faculté de médecine site Bichat
,
Paris
,
France 2Université Paris Cité, Laboratoire d’excellence Inflamex
,
Paris
,
France |
Vignette (© Nicolas Charles).
Les maladies autoimmunes résultent d’un dysfonctionnement du système immunitaire menant à une perte de tolérance pour certains constituants de l’organisme. Les acteurs de l’autoimmunité menant aux manifestations des maladies autoimmunes peuvent être cellulaires et/ou humoraux. Les maladies autoimmunes présentant des autoanticorps (AAc) (ou MAPA) se caractérisent par la présence dans le sang des patients d’AAc dirigés contre différents antigènes du soi dont les spécificités et les isotypes varient d’une MAPA à l’autre, même si certains de ces anticorps sont communs à plusieurs MAPA [
1
,
2
]. Des AAc sont également détectés dans une grande proportion de la population générale, sans que ceux-ci ne soient associés à des manifestations cliniques [
3
]. Chez les patients développant une MAPA, des facteurs environnementaux, génétiques et/ou hormonaux contribuent à l’accumulation de lymphocytes T (LT) et de lymphocytes B (LB) autoréactifs (AR) promouvant la survie et la maturation de cellules sécrétrices d’AAc (les plasmocytes) autoréactives. Associés à leurs autoantigènes et/ou à des facteurs du complément, ces AAc peuvent former des complexes immuns circulants (CIC) capables d’activer différentes cellules du système immunitaire inné
via
des interactions de type ligand/récepteur. Ces cellules activées stimulent à leur tour la production des AAc par différents mécanismes, instaurant une boucle d’amplification de la dérive autoimmune à l’origine des manifestations cliniques des MAPA. Les cellules dendritiques plasmacytoïdes (pDC), les monocytes/macrophages, les granulocytes neutrophiles ou les granulocytes basophiles promeuvent cette amplification de la production des AAc au cours des MAPA,
via
la synthèse de cytokines (BAFF [
B cell-activating factor of the TNF family
], IFN [interféron]-α, IL [interleukine]-6, IL-4, etc.) ou par l’apport d’autoantigènes par NETose
1
[
4
-
6
] (
→
).
(→) Voir la Synthèse de B. Terrier et L. Mouthon,
m/s
n° 1, janvier 2013, page 65
Ces dernières années, des immunothérapies ont été développées avec, notamment, des approches visant les lymphocytes B et leur maturation (immunothérapies par anticorps anti-CD20 et anti-BAFF), afin de limiter, voire de supprimer, la production d’AAc chez les patients atteints de MAPA. Si ces approches ont montré leur efficacité dans certaines MAPA, elles se sont révélées peu efficaces dans d’autres maladies autoimmunes [
7
]. Ces immunothérapies au long cours peuvent cependant altérer la capacité du système immunitaire des patients à répondre efficacement contre des pathogènes courants, les rendant susceptibles à certaines infections [
6
,
7
]. Lors des poussées de MAPA, les atteintes d’organes sévères sont généralement traitées par de fortes doses de corticoïdes et d’immunosuppresseurs qui, également, ne sont pas dépourvus d’effets secondaires [
8
]. Briser les boucles d’amplification de la synthèse d’AAc chez les patients devrait donc permettre de prévenir le déclenchement des manifestations cliniques et les atteintes d’organes qui y sont associées, en limitant le recours aux traitements lourds. Aussi, est-il nécessaire de connaître les mécanismes d’emballement des processus autoimmuns, afin d’identifier de nouvelles cibles thérapeutiques et de bloquer ces boucles d’amplification dans les MAPA.
Si les atteintes tissulaires des MAPA ont été clairement associées aux sous-groupes de lymphocytes T auxiliaires (
T helper [Th] cells
) Th1 et Th17, la composante Th2 de ces maladies, qui contribue à la production des Ac, et donc des AAc, a longtemps été ignorée. Nous résumerons dans cette revue les travaux qui ont permis de révéler l’importance des granulocytes basophiles et des immunoglobulines de type E (IgE) dans l’amplification et l’instauration de conditions autoimmunes, notamment dans deux MAPA, le lupus érythémateux disséminé (LED) et la connectivite mixte (
mixed connective tissue disease
ou MCTD) [
9
-
11
].
|
Granulocytes basophiles, environnement Th2, et IgE
Les granulocytes basophiles sont des cellules myéloïdes granulocytaires qui représentent environ 0,5 % des leucocytes circulants. Ces cellules, matures lorsqu’elles sortent de la moelle osseuse, ont une demi-vie limitée et ne sont habituellement pas retrouvées dans les tissus. Les granulocytes basophiles sont connus pour leur implication dans des maladies parasitaires et dans certaines maladies allergiques, telles que l’asthme allergique ou les rhinites allergiques [
12
,
13
]. Tout comme les mastocytes, les granulocytes basophiles expriment à leur surface le récepteur de haute affinité des IgE (le RFcεI), les rendant susceptibles aux activations par les complexes que forment ces immunoglobulines avec les allergènes qu’elles reconnaissent. La liaison de ces complexes au récepteur des IgE induit une libération immédiate par le granulocyte basophile du contenu de granules pré-existants dans leur cytoplasme constitué, entre autres, d’histamine et de protéases. Cette activation va mener, dans un deuxième temps, à la synthèse et à la libération de nombreux autres médiateurs, tels que des cytokines et des dérivés de l’acide arachidonique. Ces deux phases d’activation des granulocytes basophiles qui dépendent des IgE, sont responsables, comme c’est le cas pour les mastocytes, de l’inflammation et des symptômes des maladies atopiques dans lesquelles ces cellules interviennent [
13
].
Les granulocytes basophiles détectent,
via
l’expression à leur surface de nombreux récepteurs, une grande variété de médiateurs de l’inflammation et de molécules dérivées de pathogènes [
14
]. Ils ont ainsi un rôle de sentinelle dans la circulation et dans les tissus dans lesquels ils sont recrutés. En réponse à divers stimulus, les granulocytes basophiles sont reconnus pour leur capacité inégalée à produire de l’IL-4, une cytokine essentielle à l’activation, la maturation et la différenciation de nombreux types cellulaires (lymphocytes T, lymphocytes B, monocytes/macrophages, cellules épithéliales, etc.) [
13
]. Certains stimulus entraîneront, en plus d’une production massive d’IL-4, la libération d’autres cytokines et médiateurs, comme l’IL-13, l’IL-6 ou encore des eicosanoïdes. L’IL-4 et l’IL-6 ont des effets majeurs sur la régulation tant des lymphocytes T que des lymphocytes B. En effet, sous l’influence de l’IL-4, les lymphocytes T CD4
+
naïfs vont se différencier en lymphocyte de type Th2 qui sont eux-mêmes capables,
via
la synthèse d’IL-4 et leur interaction avec les lymphocytes B, d’induire une commutation istotypique des IgM vers les IgG, les IgA et les IgE, et la maturation des lymphocytes B en cellules sécrétrices d’anticorps [
13
,
15
,
16
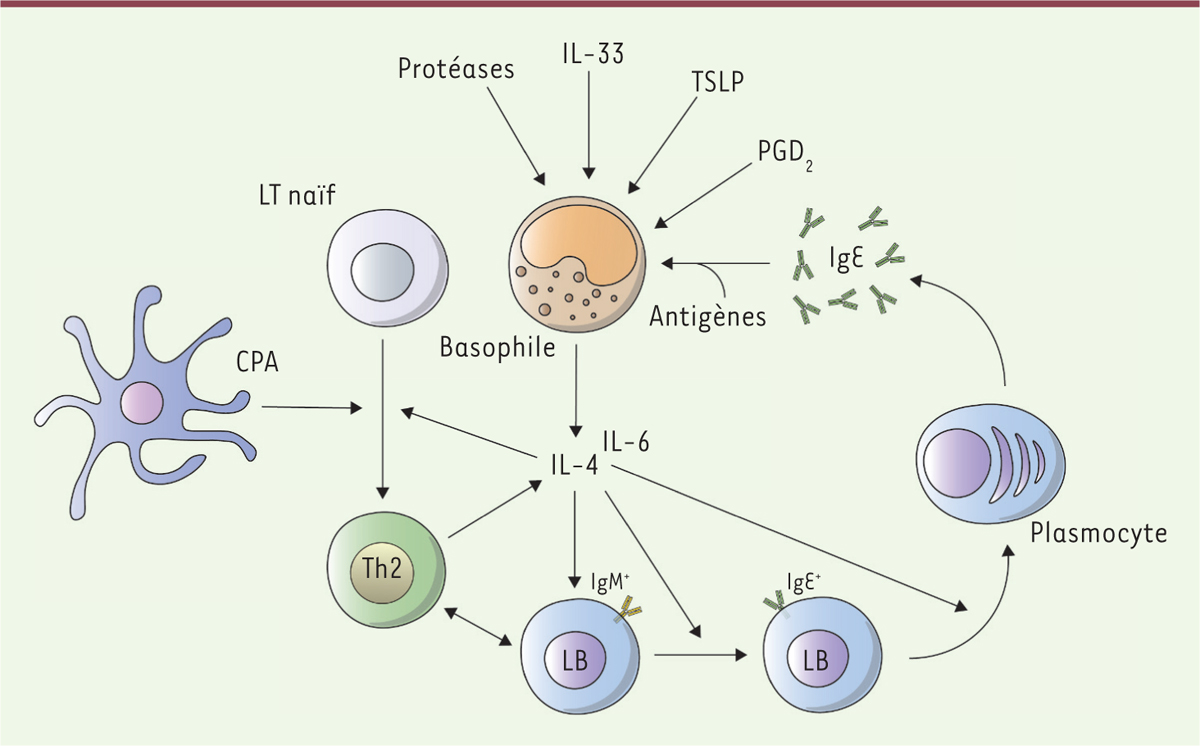
]. Cette orientation vers l’immunité de type Th2, déclenchée par l’IL-4 produite par le granulocyte basophile, est à l’origine de la création d’un environnement spécifique du type Th2, notamment dans les organes lymphoïdes secondaires (OLS) dans lesquels se déroulent les différenciations des lymphocytes T et B. Le granulocyte basophile, en produisant de l’IL-4 et de l’IL-6, promeut ainsi la synthèse par les lymphocytes B d’IgE, qui pourront activer les granulocytes basophiles
(
Figure 1
)
. L’IL-4 influe également sur le phénotype des macrophages dans les tissus inflammatoires en orientant leur différenciation vers un phénotype pro-résolutif appelé M2 (le phénotype M1 étant pro-inflammatoire). La mise en évidence de la capacité des granulocytes basophiles à produire de l’IL-4 et de l’IL-6 a permis de révéler le rôle central de ces cellules dans les réponses humorales mémoires ainsi que dans la différenciation et la survie des cellules sécrétrices d’anticorps [
15
-
18
]. En effet, la préexistence dans le sang d’IgE spécifiques d’un antigène va permettre, suite à une réexposition au même antigène, de recruter les granulocytes basophiles dans les OLS drainant le site où l’antigène a été injecté, et d’induire une réactivation rapide des lymphocytes T et B, menant à une réponse humorale mémoire rapide et efficace [
13
,
15
-
19
].
 | Figure 1.
Granulocytes basophiles et environnement Th2.
Suite à leur activation par différents stimulus, les granulocytes basophiles vont promouvoir l’établissement d’un environnement pro-Th2, notamment grâce à leur capacité à produire et à sécréter de l’IL(interleukine)-4 et de l’IL-6. L’IL-4 participe à la polarisation des lymphocytes T (LT) CD4
+
naïfs vers un phénotype de lymphocytes T Th2. Ces lymphocytes Th2 sécrètent de l’IL-4. En synergie avec l’IL-6, l’IL-4 induit la commutation isotypique des lymphocytes B (LB) vers l’isotype IgE et stimule leur maturation en plasmocytes sécréteurs d’IgE. Ces IgE contribueront à l’activation des granulocytes basophiles, créant ainsi une amplification de la réponse humorale et de l’environnement Th2. PGD
2
: prostaglandine D2 ; TSLP :
thymic stromal lymphopoietin
; CPA : cellule présentatrice de l’antigène.
|
Un modèle de souris déficientes pour la kinase Lyn de la famille Src a fourni un exemple du rôle des granulocytes basophiles dans la différenciation Th2. Lyn est exprimée dans toutes les cellules hématopoïétiques à l’exception des lymphocytes T ; elle est impliquée dans la transduction du signal d’un grand nombre d’immunorécepteurs (récepteur antigénique des lymphocytes B [BCR], récepteurs de la région Fc des immunoglobulines, intégrines, etc.) [
15
]. Les souris dépourvues d’expression de
Lyn
(les souris
Lyn
-/–
) développent dès leur plus jeune âge une sensibilité accrue aux stimulus allergiques. Ces souris développent en effet une basophilie périphérique (nombre accru de granulocytes basophiles dans le sang et les OLS) qui est associée à l’orientation de type Th2 des lymphocytes T. Cette orientation dépend des granulocytes basophiles, des IgE et de l’IL-4 qui est sécrétée. En effet, des souris doubles déficientes, qui n’expriment pas
Lyn
et ne produisent pas d’IgE, ou qui n’expriment pas
Lyn
et ne produisent pas d’IL-4, ne présentent pas cette orientation Th2 [
15
]. De plus, la déplétion des granulocytes basophiles dans les souris
Lyn
-/–
, permet de perdre ce biais Th2. La réorientation de type Th2 de ces souris est à l’origine d’une réponse anticorps de type IgE, quelle que soit l’immunisation, qui est très rapide, contrairement aux souris sauvages, expliquant la sensibilité des souris
Lyn
-/–
à tout type de rappel allergique dès leur plus jeune âge [
15
]. Plus tard, les souris
Lyn
-/–
développeront une maladie autoimmune qui ressemble au lupus érythémateux disséminé humain, en produisant des AAc anti-ADN double brin (ADNdb) et en présentant une atteinte rénale proche de la néphropathie lupique. Ce modèle a permis d’étudier la contribution de l’environnement Th2, des granulocytes basophiles et des IgE, dans la pathogénie lupique [
11
,
17
].
|
Granulocytes basophiles, IgE autoréactives et lupus érythémateux disséminé
Le lupus érythémateux disséminé (LED) est une maladie autoimmune rare, avec une prévalence de 1/2 500, qui affecte, à 90 %, des femmes en âge d’enfanter. Son étiologie est multifactorielle [
5
]. Le LED peut cibler différents organes tels que la peau, les articulations, le système nerveux central ou les reins. La néphropathie lupique peut conduire à une insuffisance rénale terminale nécessitant une transplantation [
8
]. La maladie évolue par poussées qui sont habituellement contenues par de fortes doses de traitements non spécifiques, tels que des corticostéroïdes et des immunosuppresseurs, non dénués d’effets secondaires [
6
]. Le LED est caractérisé par la présence chez les patients d’auto-anticorps (AAc) qui reconnaissent principalement des antigènes nucléaires comme l’ADNdb ou des ribonucléoprotéines (RNP), sans que l’origine de la perte de tolérance à ces antigènes ne soit comprise à ce jour [
5
]. Dans la circulation sanguine, ces AAc vont se complexer à leurs antigènes et à des composants du complément pour former des complexes immuns circulants (CIC). Ces derniers se déposent ensuite dans les organes cibles, induisant une inflammation pouvant être à l’origine d’une perte de fonction de l’organe [
4
,
5
,
8
]. Parallèlement, les CIC vont activer les cellules du système immunitaire inné
via
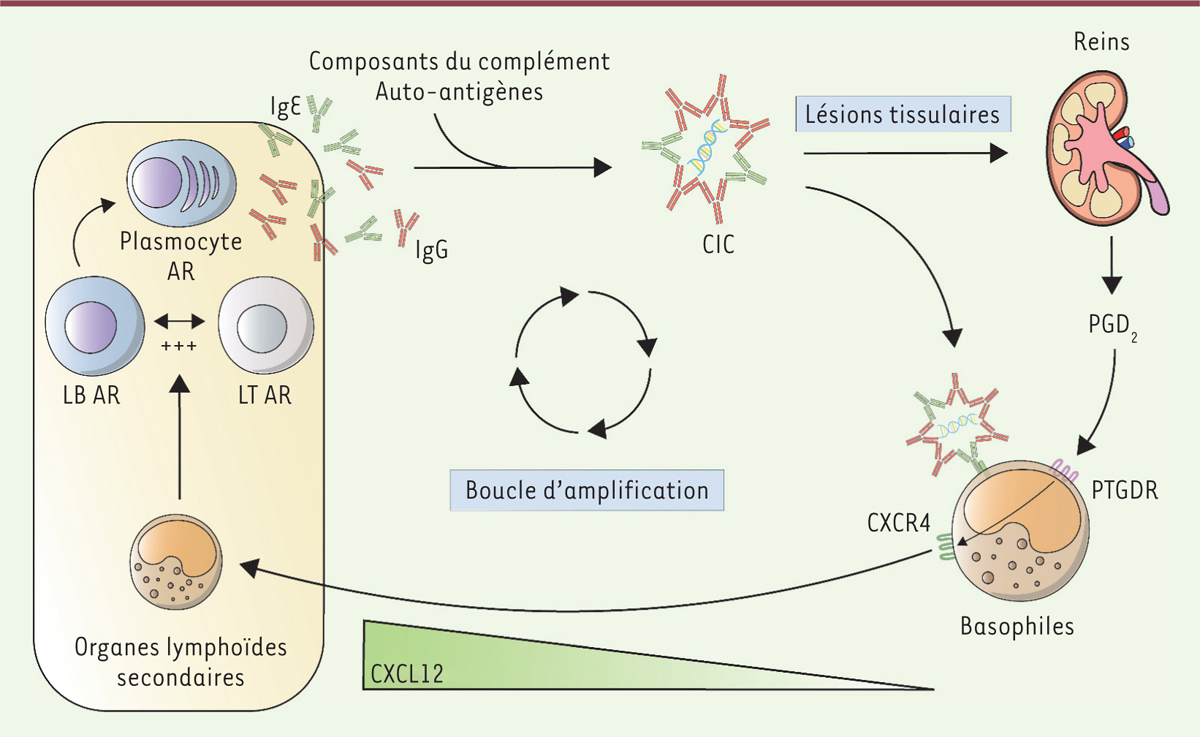
les récepteurs des régions Fc des immunoglobulines et les récepteurs de composants du complément. L’activation de ces cellules (neutrophiles, pDC, monocytes et granulocytes basophiles) va conduire à une amplification de la production des AAc par les plasmocytes autoréactifs, établissant ainsi une boucle d’amplification de la maladie
(
Figure 2
)
[
4
,
6
].
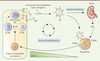 | Figure 2.
Granulocytes basophiles et lupus érythémateux disséminé (LED).
Au cours du LED, les lymphocytes B (LB) et les lymphocytes T (LT) autoréactifs (AR) sont à l’origine de l’accumulation de plasmocytes AR synthétisant des autoanticorps (AAc) de différents isotypes (notamment des IgG et des IgE). Ces AAc s’associent avec des composants du complément et des autoantigènes (ADN double brin [dsDNA], ribonucléoprotéines [RNP]), ce qui conduit à la formation de complexes immuns circulants (CIC). Ces CIC se déposent dans les organes cibles (comme le rein) où ils induisent une inflammation pouvant conduire à une perte de fonction de l’organe. Les CIC activent également des cellules de l’immunité innée, dont les granulocytes basophiles, qui stimulent,
via
la sécrétion de certaines cytokines, la production d’AAc et la formation de nouveaux CIC. Les IgE autoréactives contenues dans les CIC contribuent, avec la prostaglandine D2 (PGD
2
) produite au niveau des sites inflammatoires, à l’activation des granulocytes basophiles et à l’expression à leur surface de CXCR4 (
C-X-C motif chemokine receptor 4
), le récepteur de la chimiokine CXCL12 (
C-X-C motif chemokine ligand 12
) produite dans les organes lymphoïdes secondaires (OLS). Attirés par la chimiokine, les granulocytes basophiles migrent dans les OLS et s’y accumulent, promouvant la survie et la maturation des plasmocytes AR, établissant ainsi une boucle d’amplification de la production des AAc au cours du LED.
|
Comme nous l’avons vu, les souris
Lyn
-/–
développent à partir de 20 semaines d’âge, des atteintes similaires à celles observées dans le LED [
17
]. Dans ce modèle murin, les granulocytes basophiles, de manière dépendante des IgE et de l’IL-4, promeuvent le développement de la maladie. Les souris doubles déficientes (Lyn et IgE et Lyn et IL-4) développent une maladie beaucoup plus légère que les souris dépourvues uniquement de l’expression de
Lyn
(
Lyn
-/–
), ce qui montre l’importance des IgE et de l’IL-4 dans la pathogenèse du lupus dans ce modèle. Chez les souris ayant déjà développé la maladie (âgées de 30 semaines), la déplétion des granulocytes basophiles entraîne une diminution rapide et marquée des titres d’AAc, de CIC, et des niveaux d’inflammation rénale et des dépôts de complexes immuns dans les glomérules [
11
,
17
]. La présence d’IgE autoréactives dans les CIC de ces souris explique, au moins en partie, comment les granulocytes basophiles sont activés au cours du LED. Les complexes contenant des IgE induisent en effet une agrégation du récepteur des IgE de haute affinité (RFcεI) présent à la surface des granulocytes basophiles qui est suivie d’une production d’IL-4 [
17
]. Chez les patients lupiques, la rencontre par les granulocytes basophiles d’autoantigènes induit également leur activation qui dépend des IgE [
20
]. D’ailleurs, l’ajout de sérums de patients lupiques à des cultures de granulocytes basophiles humains purifiés induit l’activation de ces cellules et leur production d’IL-4 ; inversement, la déplétion des IgE du sérum prévient cette activation [
21
]. Chez les patients lupiques, on retrouve une forte prévalence d’IgE autoréactives (jusqu’à 82 % des patients ayant une néphropathie lupique active présentent des IgE autoréactives), associée à une forte activation des granulocytes basophiles, suggérant que, comme dans les modèles animaux, les granulocytes basophiles et les IgE autoréactives sont impliqués dans la physiopathologie lupique
(
Figure 2
)
[
9
,
22
,
23
].
Les IgE, quelle que soit leur spécificité, et donc l’environnement Th2, semblent également avoir un rôle immunorégulateur puissant au cours du lupus. En effet, dans trois modèles murins de lupus spontané, l’agressivité de la maladie a pu être diminuée en réalisant des croisements de ces souris avec des souris déficientes en IgE, produisant des souris lupiques dépourvues d’IgE [
17
,
24
].
Dans des modèles murins de LED, les granulocytes basophiles s’accumulent au cours du développement de la maladie dans les OLS, où ils promeuvent directement la survie et la maturation des cellules sécrétrices d’AAc. Ce rôle des granulocytes basophiles a également été mis en évidence dans différents modèles murins de LED, induits ou spontanés, dans lesquels la déplétion des granulocytes basophiles permet d’arrêter la production d’AAc et l’inflammation rénale qui en découle [
11
,
17
].
Chez l’homme, les granulocytes basophiles de patients lupiques présentent un phénotype activé (défini par les marqueurs CD203c et CD62L), sans qu’il y ait dégranulation (ils n’expriment pas le marqueur spécifique CD63/LAMP-3 [
lysosomal-associated membrane protein 3
]). Chez les patients présentant une néphropathie lupique grave, les niveaux d’expression de certains de ces marqueurs d’activation (en particulier CD62L) permettent de prédire la réponse au traitement [
25
]. Cette activation des granulocytes basophiles à laquelle est associée l’activité du LED, est accompagnée d’une basopénie périphérique, en raison de l’accumulation de ces cellules dans les OLS (la rate et les ganglions, comme dans les modèles animaux) [
9
,
11
,
17
,
22
,
23
] L’analyse de différents récepteurs chimiotactiques exprimés à la surface des granulocytes basophiles de patients lupiques a permis de comprendre les mécanismes de leur accumulation dans les OLS au cours du LES [
11
]. En effet, tant dans les modèles animaux que chez les patients, des niveaux élevés de prostaglandine D
2
(PGD
2
) circulante induisent dans le granulocyte basophile une surexpression de CXCR4 (
C-X-C motif chemokine receptor 4
), le récepteur de la chimiokine CXCL12 (
C-X-C motif chemokine ligand 12
) qui est produite dans les OLS dans le contexte lupique
(
Figure 2
)
[
11
] et qui a un effet positif sur la survie des granulocyte basophiles [
11
,
14
]. L’IL-3 promeut également la survie des granulocytes basophiles et son abondance et ses effets sont augmentés au cours du lupus, tant chez l’homme que chez la souris [
11
,
14
,
26
,
27
]. Ces deux médiateurs, IL-3 et CXCL12, pourraient donc contribuer à la survie, à l’accumulation et à l’activation des granulocytes basophiles dans les OLS au cours de la maladie. Mais cela reste à démontrer.
Dans les modèles murins de LED, l’utilisation d’antagonistes des récepteurs de la PGD
2
permet de prévenir l’accumulation des granulocytes basophiles dans les OLS, et ainsi de briser la boucle d’amplification de la production des AAc
(
Figure 2
)
[
11
]. Les granulocytes basophiles, les IgE et les récepteurs de la PGD
2
ont ainsi été identifiés comme des biomarqueurs et des cibles thérapeutiques potentielles
(
Figure 2
)
[
11
,
17
,
21
-
24
,
28
,
29
].
|
Granulocytes basophiles, IgE et connectivite mixte
La connectivite mixte, encore appelée syndrome de Sharp, ou, en anglais,
mixed connective tissue disease
(MCTD), est une maladie autoimmune rare. Sa prévalence est d’environ 1/50 000. Comme le LED, cette maladie affecte principalement des femmes jeunes [
9
,
10
,
30
]. Les manifestations cliniques de la maladie peuvent être retrouvées dans d’autres connectivites autoimmunes, comme le LED, la sclérodermie systémique ou des myosites autoimmunes. Plus de 70 % des patients développent une atteinte pulmonaire (maladie interstitielle et/ou hypertension pulmonaire) qui peut engager le pronostic vital [
30
]. La MCTD est caractérisée par la présence dans le sérum des patients d’AAc dirigés contre la sous-unité de 70 kDa de la U1-snRNP (
small nuclear ribonucleoprotein
) et par l’absence quasi-systématique des AAc que l’on retrouve dans le LED, comme les anti-ADNdb ou les anti-Sm
2,
[
10
,
30
]. La physiopathologie de la MCTD, moins décrite que celle du LED, est associée à l’accumulation de lymphocytes T CD4
+
et de lymphocytes B autoréactifs, à la pathogénicité des AAc anti-U1-snRNP, et aux lésions vasculaires qui leur sont associées [
10
,
31
,
32
].
Comme chez les patients lupiques, les patients atteints de MCTD présentent une basopénie périphérique. Leurs granulocytes basophiles ont un phénotype activé qui diffère cependant du phénotype retrouvé pour les granulocytes basophiles des patients lupiques. Une différence majeure consiste en la surexpression à leur surface de CCR3 (
C-C chemokine receptor type 3
), le récepteur des chimiokines CCL (
C-C motif chemokine ligand
)11 et 5, entre autres [
10
]. En plus des IgG anti-U1-snRNP, présentes chez tous les patients, des IgE autoréactives anti-U1-snRNP ont été également retrouvées chez plus de 80 % des patients atteints de MCTD, suggérant que, comme dans le LED, les granulocytes basophiles et les IgE autoréactives pourraient être impliqués dans la physiopathologie de la maladie [
10
].
Cette hypothèse a été testée dans un modèle murin de MCTD, adapté à partir d’un modèle qui avait été développé par Greidinger et son équipe de l’université de Miami aux États-Unis. Ce modèle consiste à immuniser des souris avec l’autoantigène U1-snRNP afin qu’elles produisent des AAc anti-U1-snRNP d’isotypes IgG et IgE [
10
,
31
]. Six semaines après l’immunisation, les souris développent une atteinte pulmonaire légère, associée à des infiltrats inflammatoires interstitiels, péri-bronchiques et péri-vasculaires. Les granulocytes basophiles de ces animaux ont un phénotype activé qui est similaire à celui observé chez les patients atteints de MCTD, suggérant que ce modèle est adapté pour étudier le rôle de ces cellules et des IgE dans cette maladie [
10
]. La maladie observée chez les souris est associée, dans les poumons, à une accumulation de granulocytes basophiles et de lymphocytes T CD4
+
, et à la production d’IL-4, de CCL11 et de collagène. Les granulocytes basophiles s’accumulent également dans les ganglions lymphatiques supérieurs
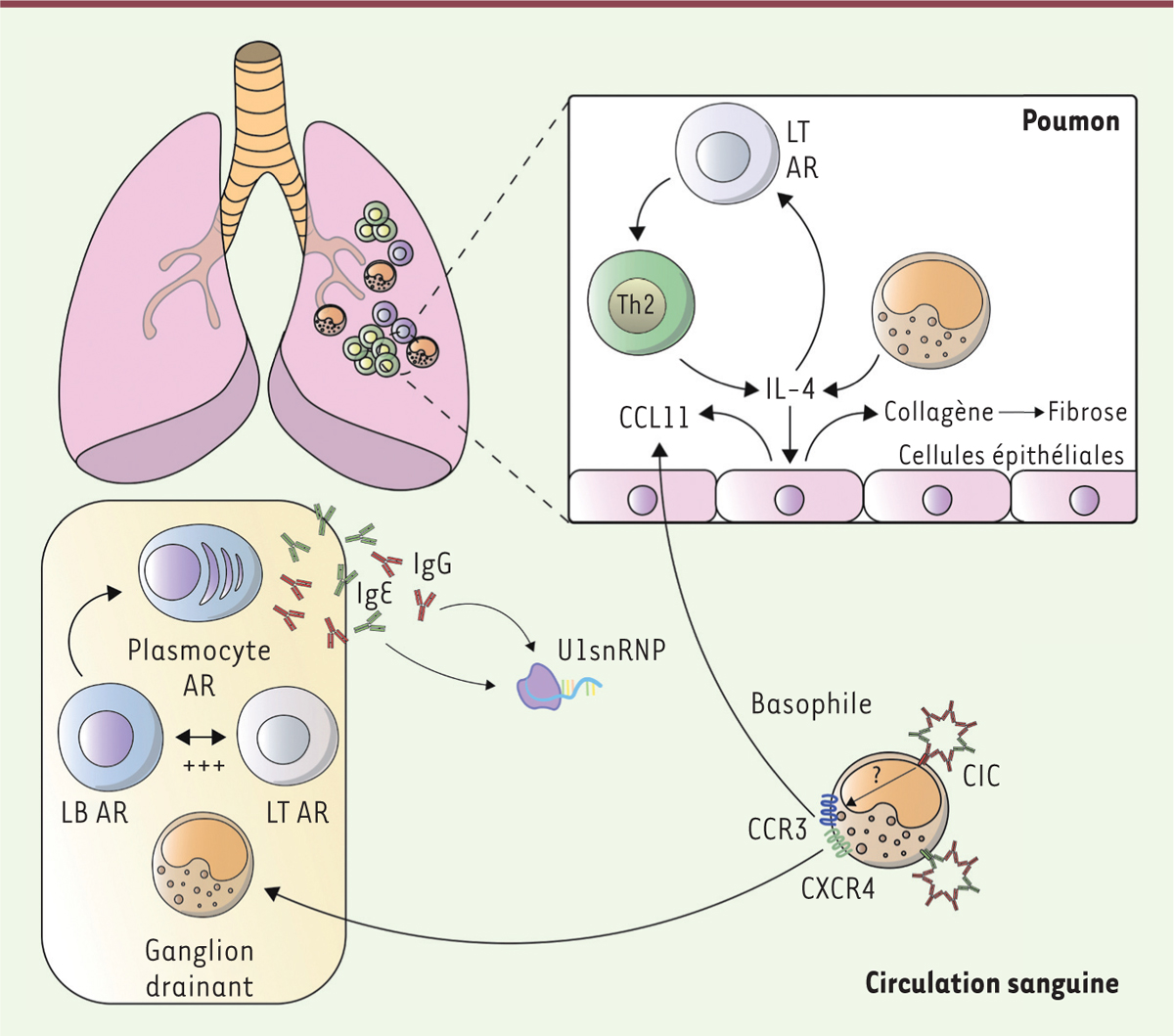
(
Figure 3
)
[
10
]. Dans ce modèle, la déplétion des granulocytes basophiles permet de réduire tous les marqueurs de la maladie (infiltrats, collagène, IL-4 et CCL11 pulmonaires), suggérant l’implication de ces cellules dans les dommages tissulaires induits par la maladie [
10
]. Le rôle des IgE a été examiné en utilisant des souris déficientes pour la production d’IgE, immunisées avec l’autoantigène humain. L’examen de différents paramètres de la maladie, six semaines après immunisation, n’a révélé, contrairement aux souris capables d’une réponse IgE, aucune atteinte pulmonaire, aucune activation périphérique et aucune accumulation des granulocytes basophiles dans les poumons et les ganglions. Également, aucune élévation de collagène, d’IL-4 ou de CCL11 n’a été détectée, confirmant la contribution majeure des IgE dans l’activation des granulocytes basophiles et dans l’établissement de la maladie pulmonaire dans ce modèle. Ainsi, comme c’est le cas dans le LED, les granulocytes basophiles et les IgE contribuent à la physiopathologie de la MCTD
(
Figure 3
)
[
10
].
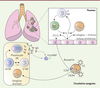 | Figure 3.
Granulocytes basophiles, IgE et connectivite mixte (MCTD).
Au cours de la MCTD, des IgE et des IgG spécifiques de la ribonucléoprotéine U1-snRNP ont des taux augmentés dans la circulation des patients. Activés par ces anticorps, les granulocytes basophiles s’accumulent dans les poumons et dans les ganglions qui les drainent. Cette migration est associée à une surexpression par les granulocytes basophiles des récepteurs CCR3 (
C-C motif chemokine receptor 3
) et CXCR4 (
C-X-C motif chemokine receptor 4
). Dans les ganglions, les granulocytes basophiles pourraient alors promouvoir la synthèse d’autoanticorps (AAc), comme c’est le cas dans le lupus. Cela reste cependant à démontrer. Dans les poumons, les granulocytes basophiles activés produisent de l’IL-4, contribuant à son augmentation et induisant ainsi la différenciation des lymphocytes T (LT) CD4
+
en lymphocytes TH2 et la production, par les cellules épithéliales pulmonaires, de CCL11 (
C-C motif chemokine ligand 11
), à l’origine du recrutement des granulocytes basophiles (
via
CCR3, le récepteur de CCL11) et des lymphocytes Th2 dans le poumon, amplifiant ainsi l’atteinte pulmonaire (fibrose) que l’on observe dans la MCTD.
|
|
Contribution des granulocytes basophiles et des IgE autoréactives dans d’autres MAPA
Les granulocytes basophiles, les IgE et les IgE autoréactives participent à d’autres maladies autoimmunes présentant des autoanticorps (MAPA) [
9
]. Dans ces maladies, l’implication des IgE (autoréactives ou pas) a pu être démontrée, avec une action sur des cellules qui expriment également le RFcεI, comme les mastocytes, les pDC, les cellules de Langerhans, voire les éosinophiles [
9
]. Parmi ces MAPA, on compte, entre autres, la dermatite atopique, l’urticaire chronique idiopathique, ou la pemphigoïde bulleuse. Dans ces maladies, tout comme dans le LED, on retrouve des AAc capables d’agréger le RFcεI (des IgG anti-RFcεI (chaîne a), des IgG anti-IgE et des IgE autoréactives). Ces AAc activent les granulocytes basophiles, mais aussi les autres cellules qui expriment le RFcεI. L’implication des granulocytes basophiles a été suggérée par la présence, chez les patients atteints de ces maladies, d’une basophilie ou d’une basopénie, le recrutement de granulocytes basophiles dans les lésions tissulaires ou dans les OLS, et, également, par la présence d’AAc d’isotype IgE [
9
]. Une élévation des titres d’IgE circulantes est souvent retrouvée chez ces patients. Néanmoins, si les contributions des granulocytes basophiles à la pathogénie du LED, de la MCTD, de la dermatite atopique ou à celle d’une encéphalite auto-immune expérimentale (EAE) ont été montrées dans des modèles murins [
9
,
13
,
33
-
35
], les mécanismes de leurs contributions dans de nombreuses autres MAPA restent à explorer.
|
Conclusion et perspectives thérapeutiques
Si les IgE autoréactives et les granulocytes basophiles contribuent à l’amplification des mécanismes pathogéniques des MAPA, telles que le LED et la MCTD, il est important de noter que ces mécanismes ne reposent pas sur des processus allergiques. Si les granulocytes basophiles sont effectivement activés, en ce qui concerne leurs capacités migratoires et leur aptitude à produire des cytokines, ils ne libèrent pas leurs granules, comme c’est le cas lors d’une réaction allergique [
11
]. Le rôle délétère de ces cellules repose en effet sur leur accumulation dans les OLS et sur les capacités immunorégulatrices qu’ils y exercent. L’absence de dégranulation pourrait être expliquée par la présence d’AAc d’isotypes IgG et IgE dans les CIC. La fixation des CIC à la surface des cellules est à l’origine de signaux activateurs (par exemple
via
le RFcεI) mais également inhibiteurs (
via
le RFcγIIb, un récepteur des IgG inhibiteur). L’intégration de ces différents signaux déterminera donc l’étendue de la réponse des cellules : la production de cytokines, l’expression de récepteurs chimiotactiques, et/ou la dégranulation. Cibler les facteurs activant les granulocytes basophiles, tels que les IgE ou la PGD
2
, ou cibler les granulocytes basophiles eux-mêmes, semblent donc être des approches thérapeutiques prometteuses afin de briser la boucle d’amplification des MAPA [
11
,
36
].
Dans beaucoup de MAPA, les taux d’IgE circulantes sont augmentés et la présence d’IgE autoréactives est établie, ainsi qu’une polarisation Th2 [
9
]. Du fait de l’état d’activation des granulocytes basophiles observé dans certaines MAPA, on peut donc imaginer utiliser des stratégies thérapeutiques développées antérieurement pour le traitement de maladies atopiques. Par exemple, nous avons récemment réalisé un essai clinique de phase Ib utilisant chez les patients lupiques une approche immunothérapeutique anti-IgE avec l’omalizumab, un anticorps monoclonal dirigé contre la région Fc des IgE. Cet essai a montré une très bonne tolérance des patients au traitement ainsi que des résultats cliniques très encourageants [
9
,
36
]. Le ligelizumab est un autre anticorps monoclonal anti-IgE de dernière génération qui a montré une efficacité supérieure à l’omalizumab dans l’urticaire chronique idiopathique [
37
]. Des essais cliniques testant cet anticorps dans le LED pourraient peut-être mettre en évidence un bénéfice clinique pour les patients.
Une autre approche, qui a démontré son efficacité chez la souris, est la déplétion des granulocytes basophiles [
11
,
17
]. Cependant, à notre connaissance, aucune cible spécifique exprimée à la surface de ces cellules chez l’homme n’a pu être identifiée, empêchant un ciblage dans des conditions de sécurité sanitaire satisfaisante. Des immunothérapies ciblant des marqueurs présents à la surface des granulocytes basophiles, mais non spécifiques de ces cellules, ont été néanmoins testées, notamment un anticorps anti-CD123 (le récepteur de l’IL-3). Mais ce récepteur est également exprimé par les pDC et les éosinophiles. Le développement de cet anticorps a été arrêté pour des raisons qui n’ont pas été précisées publiquement (ClinicalTrials.gov NCT02920424). D’autres approches ciblant spécifiquement les granulocytes basophiles humains nécessitent donc d’être développées. La poursuite des études portant sur la composante Th2 des MAPA pourrait également ouvrir la voie à des approches thérapeutiques déjà utilisées dans d’autres maladies telles que les allergies, afin de briser la boucle d’amplification pathologique qui intervient dans la plupart des MAPA.
|
Nicolas Charles détient deux brevets en rapport avec le contenu de ce manuscrit : W020120710042 et WO2016128565A1. Les auteurs déclarent n’avoir aucun autre lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a été soutenu par la Fondation pour la recherche médicale (FRM) [# EQU201903007794], par l’ANR [# ANR-19-CE17-0029 BALUMET Basophiles et Lupus : mécanismes et thérapeutique], par le laboratoire d’excellence INFLAMEX (ANRPIA-10-LABX-0017 INFLAMEX), l’Inserm, le CNRS et l’université de Paris (maintenant université Paris Cité).
|
Footnotes |
1.
Dema
B
,
Charles
N
.
Autoantibodies in SLE: Specificities.
.
Isotypes and Receptors. Antibodies (Basel).
2016;
;
5
:
:2.
.
2.
La Cava
A.
.
Putting together the autoimmunity puzzle.
.
J Clin Invest.
2015;
;
125
:
:2184.
–
2186
.
3.
Neiman
M
,
Hellstrom
C
,
Just
D
,
et al.
Individual and stable autoantibody repertoires in healthy individuals.
.
Autoimmunity.
2019;
;
52
:
:1.
–
11
.
4.
Dema
B
,
Charles
N
.
Advances in mechanisms of systemic lupus erythematosus.
.
Discov Med.
2014;
;
17
:
:247.
–
255
.
5.
Kaul
A
,
Gordon
C
,
Crow
MK
,
et al.
Systemic lupus erythematosus.
.
Nat Rev Dis Primers.
2016;
;
2
:
:16039.
.
6.
Terrier
B
,
Mouthon
L
.
Lupus érythémateux systémique : traitements par anticorps monoclonaux et molécules recombinantes.
.
Med Sci (Paris).
2013;
;
29
:
:65.
–
73
.
7.
Lee
DSW
,
Rojas
OL
,
Gommerman
JL
.
B cell depletion therapies in autoimmune disease: advances and mechanistic insights.
.
Nat Rev Drug Discov.
2021;
;
20
:
:179.
–
99
.
8.
Anders
HJ
,
Saxena
R
,
Zhao
MH
,
et al.
Lupus nephritis.
.
Nat Rev Dis Primers.
2020;
;
6
:
:7.
.
9.
Charles
N
.
Autoimmunity, IgE and FcepsilonRI-bearing cells.
.
Curr Opin Immunol.
2021;
;
72
:
:43.
–
50
.
10.
Lamri
Y
,
Vibhushan
S
,
Pacreau
E
,
et al.
Basophils and IgE contribute to mixed connective tissue disease development.
.
J Allergy Clin Immunol.
2021;
;
147
:
:1478.
–
89 e11
.
11.
Pellefigues
C
,
Dema
B
,
Lamri
Y
,
et al.
Prostaglandin D2 amplifies lupus disease through basophil accumulation in lymphoid organs.
.
Nat Commun.
2018;
;
9
:
:725.
.
12.
Karasuyama
H
,
Miyake
K
,
Yoshikawa
S
,
Yamanishi
Y
.
Multifaceted roles of basophils in health and disease.
.
J Allergy Clin Immunol.
2018;
;
142
:
:370.
–
380
.
13.
Miyake
K
,
Shibata
S
,
Yoshikawa
S
,
Karasuyama
H
.
Basophils and their effector molecules in allergic disorders.
.
Allergy.
2021;
;
76
:
:1693.
–
706
.
14.
Pellefigues
C
,
Mehta
P
,
Chappell
S
,
et al.
Diverse innate stimuli activate basophils through pathways involving Syk and IkappaB kinases.
.
Proc Natl Acad Sci USA.
2021;
;
118
:
:e2019524118.
.
15.
Charles
N
,
Watford
WT
,
Ramos
HL
,
et al.
Lyn kinase controls basophil GATA-3 transcription factor expression and induction of Th2 cell differentiation.
.
Immunity.
2009;
;
30
:
:533.
–
543
.
16.
Denzel
A
,
Maus
UA
,
Rodriguez Gomez
M
,
et al.
Basophils enhance immunological memory responses.
.
Nat Immunol.
2008;
;
9
:
:733.
–
742
.
17.
Charles
N
,
Hardwick
D
,
Daugas
E
,
et al.
Basophils and the T helper 2 environment can promote the development of lupus nephritis.
.
Nat Med.
2010;
;
16
:
:701.
–
707
.
18.
Rodriguez
Gomez M
,
Talke
Y
,
Goebel
N
,
et al.
Basophils support the survival of plasma cells in mice.
.
J Immunol.
2010;
;
185
:
:7180.
–
5
.
19.
Otsuka
A
,
Nakajima
S
,
Kubo
M
,
et al.
Basophils are required for the induction of Th2 immunity to haptens and peptide antigens.
.
Nat Commun.
2013;
;
4
:
:1739.
.
20.
Camussi
G
,
Tetta
C
,
Benveniste
J
.
Detection of basophil sensitization by IgE antibodies to nuclear antigens in connective tissue diseases.
.
Int Arch Allergy Appl Immunol.
1982;
;
69
:
:358.
–
362
.
21.
Pan
Q
,
Gong
L
,
Xiao
H
,
et al.
Basophil Activation-Dependent Autoantibody and Interleukin-17 Production Exacerbate Systemic Lupus Erythematosus.
.
Front Immunol.
2017;
;
8
:
:348.
.
22.
Dema
B
,
Pellefigues
C
,
Hasni
S
,
et al.
Autoreactive IgE is prevalent in systemic lupus erythematosus and is associated with increased disease activity and nephritis.
.
PloS one.
2014;
;
9
:
:e90424.
.
23.
Lamri
Y
,
Charles
N
.
IgE in the Pathogenesis of SLE: From Pathogenic Role to Therapeutic Target.
.
Antibodies (Basel).
2020
;
:9.
.
24.
Dema
B
,
Charles
N
,
Pellefigues
C
,
et al.
Immunoglobulin E plays an immunoregulatory role in lupus.
.
J Exp Med.
2014;
;
211
:
:2159.
–
2168
.
25.
Halfon
M
,
Bachelet
D
,
Hanouna
G
,
et al.
CD62L on blood basophils: a first pre-treatment predictor of remission in severe lupus nephritis.
.
Nephrol Dial Transplant.
2021;
;
12
:
:2256.
–
62
.
26.
Oon
S
,
Monaghan
K
,
Ng
M
,
et al.
A potential association between IL-3 and type I and III interferons in systemic lupus erythematosus.
.
Clin Transl Immunology.
2019;
;
8
:
:e01097.
.
27.
Renner
K
,
Hermann
FJ
,
Schmidbauer
K
,
et al.
IL-3 contributes to development of lupus nephritis in MRL/lpr mice.
.
Kidney Int.
2015;
;
88
:
:1088.
–
1098
.
28.
Dema
B
,
Lamri
Y
,
Pellefigues
C
,
et al.
Basophils contribute to pristane-induced Lupus-like nephritis model.
.
Sci Rep.
2017;
;
7
:
:7969.
.
29.
Henault
J
,
Riggs
JM
,
Karnell
JL
,
et al.
Self-reactive IgE exacerbates interferon responses associated with autoimmunity.
.
Nat Immunol.
2016;
;
17
:
:196.
–
203
.
30.
Sapkota
B
,
Al Khalili
Y
.
Mixed Connective Tissue Disease.
.
StatPearls;
.
Treasure Island (FL):
2021
.
31.
Greidinger
EL
,
Zang
Y
,
Jaimes
K
,
et al.
A murine model of mixed connective tissue disease induced with U1 small nuclear RNP autoantigen.
.
Arthritis Rheum.
2006;
;
54
:
:661.
–
669
.
32.
Greidinger
EL
,
Zang
YJ
,
Jaimes
K
,
et al.
CD4+ T cells target epitopes residing within the RNA-binding domain of the U1–70-kDa small nuclear ribonucleoprotein autoantigen and have restricted TCR diversity in an HLA-DR4-transgenic murine model of mixed connective tissue disease.
.
J Immunol.
2008;
;
180
:
:8444.
–
8454
.
33.
Leyva-Castillo
JM
,
Hener
P
,
Michea
P
,
et al.
Skin thymic stromal lymphopoietin initiates Th2 responses through an orchestrated immune cascade.
.
Nat Commun.
2013;
;
4
:
:2847.
.
34.
Musio
S
,
Costanza
M
,
Poliani
PL
,
et al.
Treatment with anti-FcepsilonRIalpha antibody exacerbates EAE and T-cell immunity against myelin.
.
Neurol Neuroimmunol Neuroinflamm.
2017;
;
4
:
:e342.
.
35.
Pellefigues
C
,
Naidoo
K
,
Mehta
P
,
et al.
Basophils promote barrier dysfunction and resolution in the atopic skin.
.
J Allergy Clin Immunol.
2021;
;
148
:
:799.
–
812 e10
.
36.
Hasni
S
,
Gupta
S
,
Davis
M
,
et al.
Safety and Tolerability of Omalizumab: A Randomized Clinical Trial of Humanized Anti-IgE Monoclonal Antibody in Systemic Lupus Erythematosus.
.
Arthritis Rheumatol.
2019;
;
71
:
:1135.
–
1140
.
37.
Maurer
M
,
Gimenez-Arnau
AM
,
Sussman
G
,
et al.
Ligelizumab for Chronic Spontaneous Urticaria.
.
N Engl J Med.
2019;
;
381
:
:1321.
–
1332
.
|