| |
| Med Sci (Paris). 38(4): 351–358. doi: 10.1051/medsci/2022038.La nétrine-1, une nouvelle cible antitumorale Mélanie Bellina1** and Agnès Bernet1* 1Centre de recherche en cancérologie de Lyon (CRCL), Centre Léon Bérard
,
28 rue Laennec
,
69008Lyon
,
France |
Vignette (© Juan Antonio Moreno Bravo et Alain Chédotal). Ces deux dernières décennies ont vu émerger des traitements révolutionnaires contre les cancers. Les années 1990 ont en effet permis la mise au point des thérapies ciblées qui, comme leur nom l’indiquent, ciblent et bloquent spécifiquement l’anomalie portée par la cellule cancéreuse. Depuis 2013, l’immunothérapie, qui réactive l’infiltrat immunitaire contre les cellules tumorales, est venue offrir une nouvelle arme pour le traitement de nombreux cancers. Cependant, au fil des années, les thérapies ciblées et les immunothérapies semblent avoir atteint un plateau en termes d’efficacité. Le nombre de patients répondeurs à chaque approche thérapeutique n’augmente plus, mettant en évidence la nécessité de combiner différents traitements. Aujourd’hui, 90 % des cas de décès par cancer sont imputables au développement de métastases et aux récidives liées à la résistance de certaines cellules tumorales aux traitements. Il est donc absolument nécessaire de continuer à développer de nouvelles thérapies s’attaquant aux cellules capables d’induire des récidives et à l’origine des métastases. Une nouvelle thérapie, récemment développée par un laboratoire français, pourrait s’adresser à ce type de cellules. Celle-ci cible la nétrine-1, une molécule de guidage sécrétée, active au cours du développement embryonnaire, notamment celui du système nerveux, qui semble être anormalement surexprimée dans la plupart des cancers agressifs. Nous proposons de présenter dans cette revue cette molécule dont l’activité au cours du développement embryonnaire serait réactivée lors de la formation des tumeurs. Nous évoquerons également les effets potentiels d’une telle thérapie ciblée qui pourrait être combinée aux différents traitements conventionnels pour renforcer l’efficacité des thérapies anticancéreuses. |
La nétrine-1 et ses récepteurs
Découverte dans le cerveau embryonnaire de poulet en 1994, la nétrine-1 est l’homologue vertébré de UNC-6 (
uncoordinated-6
) mis en évidence quelques années plus tôt chez le nématode
Caenorhabditis elegans
[
1
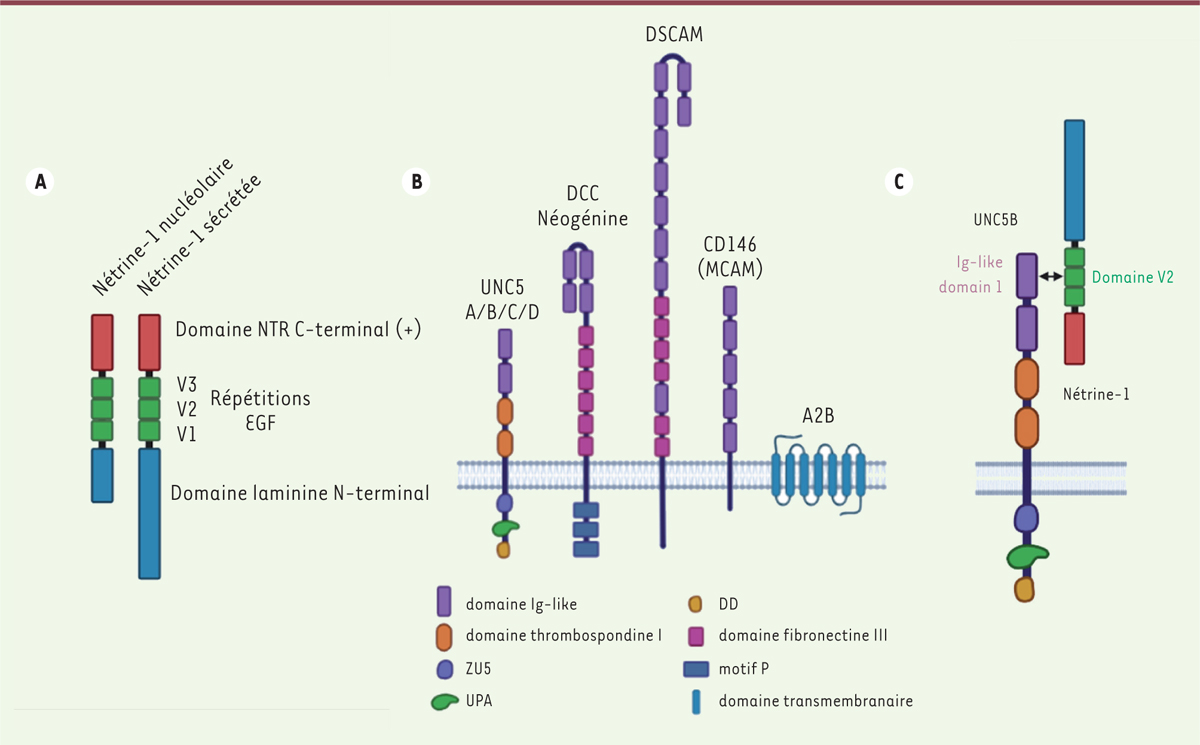
]. La conservation des résidus les plus importants impliqués dans les sites de liaison de la nétrine-1 à ses récepteurs suggère une importance fonctionnelle du couple ligand/récepteur pour l’ensemble des espèces. En effet, la nétrine-1 appartient à une famille de protéines très conservées de la drosophile à l’homme. Codée par le gène
Ntn1
, la nétrine-1 est une protéine de 70 kDa [
2
], composée de trois domaines distincts : un domaine N-terminal et un domaine central (comportant trois répétitions de type
epidermal growth factor-like
, V1, V2 et V3) homologues aux domaines des laminines, et un domaine C-terminal de charge positive, spécifique d’une famille plus large de nétrines (NTR)
(
Figure 1A
)
. Chez les vertébrés, la famille des nétrines est constituée de six membres dont quatre sont sécrétés (nétrine-1, -3, -4 et -5) et deux sont ancrés dans la membrane plasmique (nétrine-G1 et G2) [
2
]. Au sein du domaine NTR spécifique des nétrines, cinq sous-domaines ont été identifiés, dont un motif d’adhérence cellulaire et un motif de localisation nucléolaire aboli dans la nétrine-1 sécrétée. La nétrine-1 possède également une isoforme qui n’est pas sécrétée. Cette isoforme, dont le domaine laminine à son extrémité N-terminale est tronqué, en raison de la présence d’un promoteur alternatif cryptique dans le gène
Ntn1
, se retrouve dans les nucléoles de certaines cellules cancéreuses où elle pourrait jouer un rôle pro-tumoral en altérant la synthèse des ribosomes [
3
].
 | Figure 1.
La nétrine-1 et ses récepteurs. A.
Structure protéique de la nétrine-1 et de son isoforme tronquée à localisation nucléolaire. Les différents domaines sont indiqués.
B.
Structure protéique des récepteurs de la nétrine-1. Les récepteurs fixant la nétrine-1 sont représentés avec leurs différents domaines. DCC (
deleted in colorectal cancer
) et néogénine ont une séquence comprenant 49 % d’identité en acides aminés, et sont composés de quatre domaines immunoglobuline (
Ig-like
) qui, comme pour UNC5B (
unc-6 netrin receptor B
), interagissent avec la nétrine-1. A2B (
adenosine receptor 2B
) est constituée de sept domaines transmembranaires. Son activité est relayée par des protéines G.
C.
Interaction entre UNC5B et nétrine-1
via
le domaine Ig-like 1 de UNC5B et le domaines EGF V2 de la nétrine-1. DD : domaine de mort ; EGF :
epidermal growth factor
; NTR : nétrines.
|
La nétrine-1 est considérée comme une protéine sécrétée qui interagit avec deux familles de récepteurs transmembranaires appartenant à la superfamille des immunoglobulines (Ig) : la famille des
Deleted in Colorectal Cancer
(
DCC
) qui comprend DCC et néogénine, et la famille des récepteurs UNC5 (
uncoordinated-5
) composée de UNC5A, UNC5B, UNC5C et UNC5D
(
Figure 1B
)
[
4
]. La structure cristallographique de l’interaction entre nétrine-1 et UNC5B a été élucidée. Elle a révélé une interaction entre le domaine V2 de la nétrine-1 et le domaine Ig1 d’UNC5B auquel il se lie
(
Figure 1C
)
[
5
]. Certains effets dus à cette interaction pourraient néanmoins impliquer d’autres récepteurs comme A2B (
adenosine receptor 2B
), DSCAM (
down syndrome cell adhesion molecule
) ou CD146 (ou MCAM [
melanoma cell adhesion molecule
] / Muc18 [mucine 18])
(
Figure 1B
)
[
6
-
8
], même si peu de travaux ont finalement confirmé la pertinence de ces possibles récepteurs alternatifs. Outre ces récepteurs, la nétrine-1 peut également se lier à d’autres protéines, comme les intégrines a6b4 et a3b1, ou les protéoglycanes héparanes sulfates [
9
,
10
]
La nétrine-1, un ligand des récepteurs à dépendance
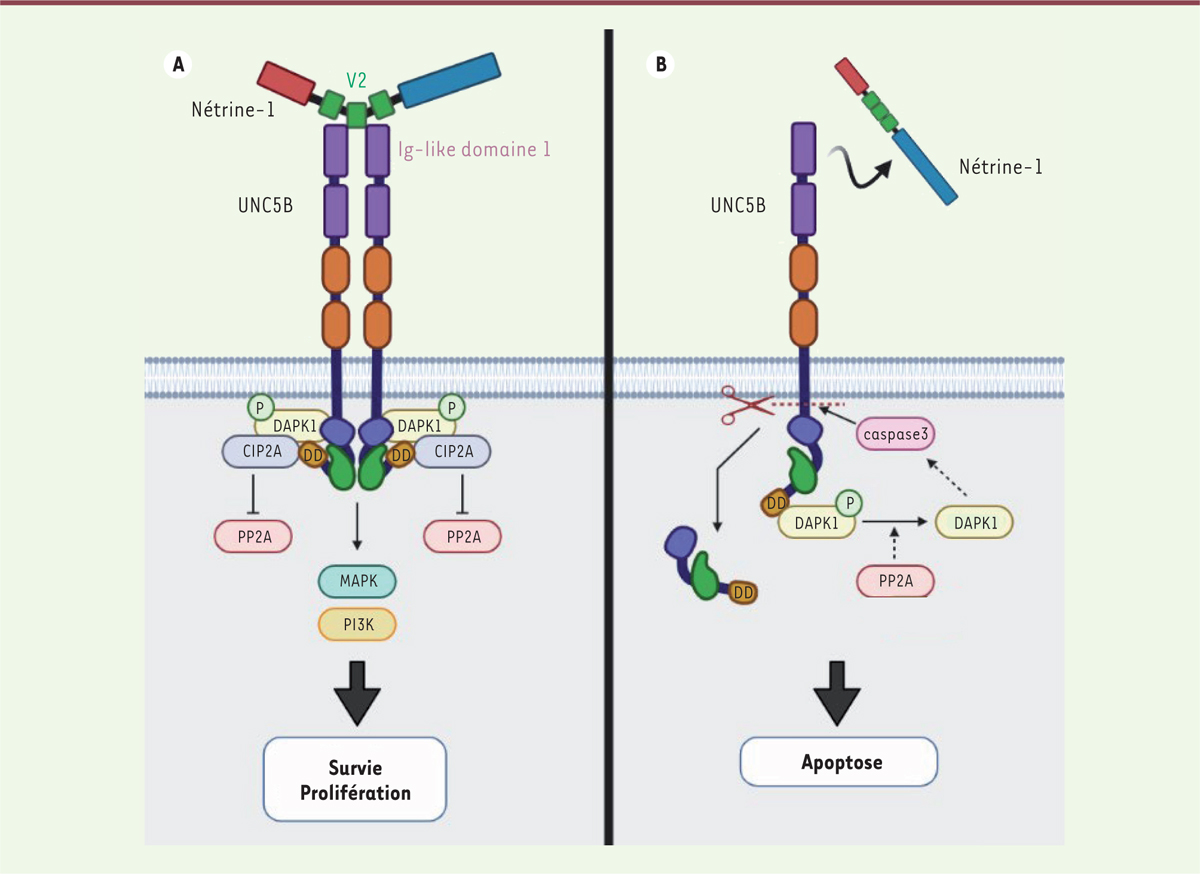
Les récepteurs DCC et UNC5A, -B et -C, sur lesquels se fixe la nétrine-1, ont été décrits comme les prototypes des récepteurs à dépendance, des protéines membres d’une famille à double fonctionnalité, dont un tout dernier membre, c-kit, a récemment été décrit [
11
]. En présence de leurs ligands, ces récepteurs induisent un signal dit « positif » qui conduit la cellule à proliférer ou à migrer. En son absence, ils induisent un signal « négatif » de mort cellulaire par apoptose. La cellule qui exprime ce type de récepteurs à sa surface devient ainsi dépendante de la présence du ligand pour survivre
(
Figure 2
)
[
4
]. Le mécanisme permettant cette dualité de fonction commence à être décrit dans le cas de la nétrine-1 et du récepteur à dépendance UNC5B. En effet, la fixation de la nétrine-1 entraîne la multimérisation de UNC5B qui adopte alors une conformation intracellulaire dite « fermée », bloquant son clivage protéolytique par les caspases, et permettant son interaction avec une forme phosphorylée de DAPK1 (
death-associated protein kinase 1
) inactive. Ainsi liée à DAPK1 phosphorylé, l’extrémité C-terminale intracellulaire de UNC5B interagit avec CIP2A (
cellular inhibitor of PP2A
), ce qui le protège de la déphosphorylation par PP2A (protéine phosphatase 2). L’interaction de la nétrine-1 avec UNC5B stimule les voies des MAPK (
mitogen-activated protein kinases
) et des PI3K (
phosphoinositide 3-kinases
), des voies de survie et de prolifération cellulaires
(
Figure 2A
)
. En l’absence de nétrine-1, UNC5B est sous forme d’un monomère et adopte une conformation intracellulaire dite « ouverte », permettant à son extrémité C-terminale de lier PP2A qui active alors DAPK1 par déphosphorylation, et rend possible le clivage de son domaine intracellulaire par la caspase 3, libérant un domaine de mort (DD)
(
Figure 2B
)
à l’origine de l’apoptose de la cellule [
4
]. Des mécanismes moléculaires assez différents sont observés pour UNC5A, C et la néogénine, mais ils impliquent tous un clivage par les caspases [
4
].
 | Figure 2.
Double signalisation des récepteurs à dépendance : UNC5B et nétrine-1. A.
L’interaction du domaines V2 de la nétrine-1 avec le domaine
Ig-like
1 de UNC5B permet le blocage de l’apoptose et l’activation des voies des MAPK (MAPKinases) et des PI3K (
phosphoinositide 3 kinases
), assurant survie et prolifération cellulaire.
B.
En l’absence de fixation de la nétrine-1, UNC5B (
unc-5 netrin receptor B
) subit un changement de conformation et adopte une organisation intracellulaire ouverte, ce qui permet à la caspase 3 alors activée de cliver le domaine intracellulaire de UNC5B au niveau de l’Asp 412, libérant le domaine de mort (DD) et induisant l’apoptose.
|
La nétrine-1 au cours du développement et chez l’adulte
En raison de son interaction avec les différents récepteurs qui la fixent, la nétrine-1 a été étudiée en ce qui concerne son implication dans le développement embryonnaire. Elle promeut en effet la croissance et l’orientation des axones de certains neurones, tels que les neurones commissuraux [
12
] (
→
).
(→) Voir la Synthèse de P. Mehlen et N. Rama,
m/s
n° 3, mars 2007, page 311
Son rôle le plus documenté est celui d’une molécule bifonctionnelle, jouant des rôles opposés d’attraction ou de répulsion des neurones, selon les récepteurs qui sont exprimés par les cellules avec lesquelles elle interagit. Son activité ne semble pas se limiter au développement du système nerveux. Il a en effet été proposé que la nétrine-1 soit impliquée dans différents processus, tels que l’angiogenèse [
13
], l’innervation artérielle sympathique
via
sa sécrétion par les cellules musculaires lisses artérielles, la migration des cellules du mésoderme, le développement des organes branchés (glande mammaire, poumon, oreille interne et pancréas) [
14
,
15
], le développement du système optique ou celui des structures crâniofaciales [
16
]. Il est cependant important de noter que malgré son implication probable dans ces différentes fonctions, les souris dont le gène codant la nétrine-1 a été délété, ne montrent pas de défaut d’angiogenèse, ni d’anomalie importante de développement de ces organes.
Si son rôle primordial est reconnu dans le développement embryonnaire, l’expression de la nétrine-1 n’est pas formellement démontrée dans l’organisme adulte, en dehors du système nerveux ; on ignore en effet à ce jour les fonctions précises de la nétrine-1 chez l’adulte. La protéine semble cependant être réexprimée lors de certains processus réactionnels, comme au cours d’une ischémie cérébrale ou lors de la survenue d’une lésion hépatique [
17
,
18
]. Des travaux suggèrent qu’elle pourrait jouer un rôle important au cours de la reprogrammation / différenciation des cellules [
19
] (
→
).
(→) Voir la Nouvelle de P. Mehlen et F. Lavial,
m/s
n° 3, mars 2016, page 241
Chez l’adulte, un des rôles supposés de la nétrine-1, sous sa forme sécrétée, dont les taux en condition physiologique normale sont faibles, pourrait être la protection des tissus contre une prolifération excessive. Une division cellulaire excessive et incontrôlée conduirait en effet à l’impossibilité pour la nétrine-1 de se fixer à ses récepteurs dont le nombre serait alors trop important. Cette absence de liaison de la protéine entraînerait ainsi l’apoptose des cellules surnuméraires. C’est pour cette raison que les récepteurs à dépendance, dont les prototypes sont les récepteurs fixant la nétrine-1, ont été décrits comme des suppresseurs de tumeurs conditionnels [
20
].
|
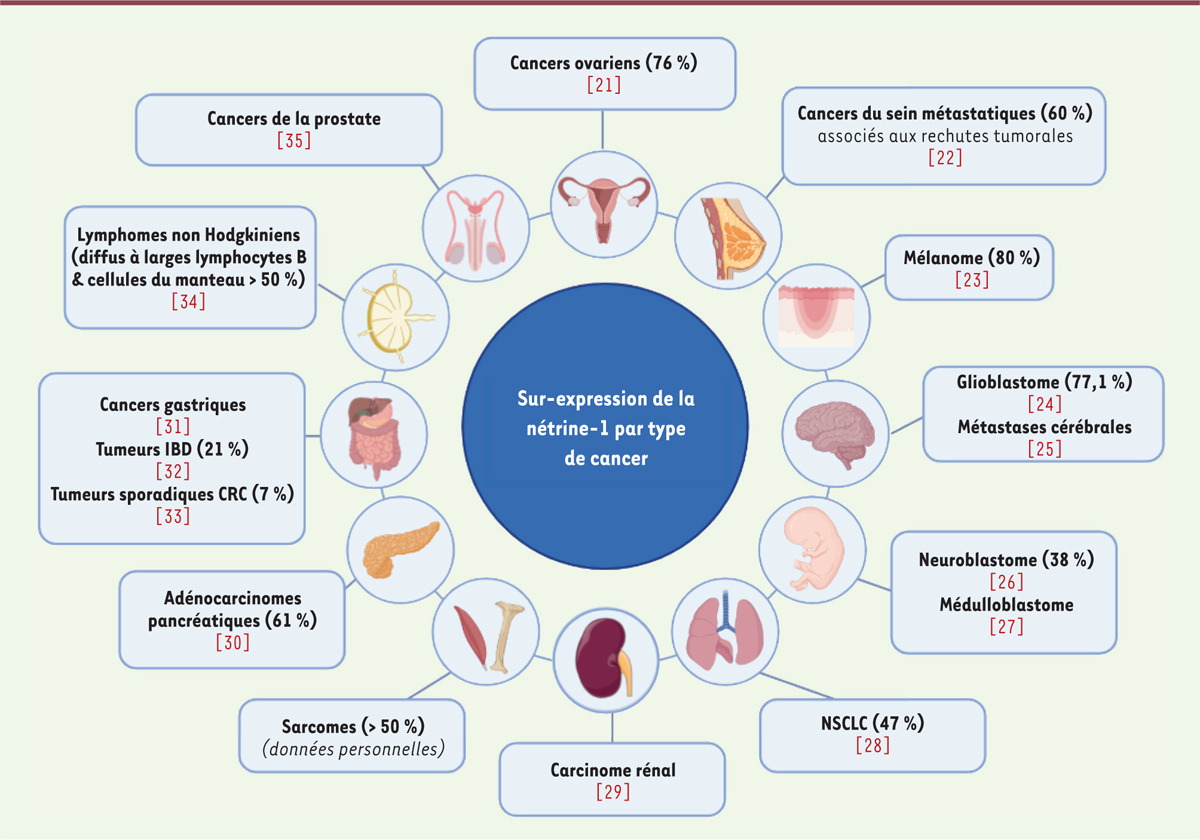
La nétrine-1 et le développement tumoral
La capacité des récepteurs à dépendance à induire la mort des cellules quand la quantité de ligand présente dans l’environnement est réduite serait donc un mécanisme de prévention du développement tumoral. Les cellules cancéreuses parviennent pourtant à contourner ce mécanisme, soit en invalidant la voie apoptotique par inactivation des récepteurs ou des voies de signalisation associées, soit en surproduisant le ligand de façon autocrine ou paracrine, assurant ainsi une saturation des récepteurs spécifiques [
4
]. L’ensemble de ces processus a été retrouvé dans les cellules tumorales, et la surproduction de nétrine-1 comme ligand semble être la voie privilégiée des cellules cancéreuses, cette surproduction apportant probablement un avantage supplémentaire, lié à l’augmentation du signal positif induit par le couple nétrine-1/récepteur. Une surexpression de nétrine-1 a en effet été observée dans de nombreux types de cancers, dans des proportions différentes selon les tissus
(
Figure 3
)
.
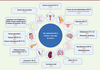 | Figure 3.
La nétrine-1 est surexprimée dans de nombreux types de cancers.
Les types de cancers dans lesquels une surexpression de la nétrine-1 a été mise en évidence sont indiqués ainsi que les références associées. Lorsqu’il est disponible, le pourcentage de tumeurs surexprimant la nétrine-1 est mentionné entre parenthèses. IBD :
inflammatory bowel disease
; CRC :
colorectal cancer
; NSCLC :
non-small cell lung carcinoma.
|
Les cellules cancéreuses se caractérisent par leur pouvoir de survie et de prolifération, des capacités qui mettent en jeu de multiples voies intracellulaires. La nétrine-1 pourrait, lors de sa fixation à son récepteur, activer les voies de signalisation à l’origine de cette prolifération cellulaire, telles que les voies PI3K / AKT (protéine kinase B) et ERK (
extracellular signal-regulated kinases
) [
36
-
38
], tout en favorisant l’échappement des cellules à l’apoptose induite par le signal de mort généré par son récepteur UNC5B. Cet échappement à la mort cellulaire en présence de nétrine-1 a été expliquée par l’expression accrue de Mdm2 (
mouse double minute 2 homolog
), un inhibiteur de TP53, une protéine suppresseur de tumeur [
39
]. La surproduction de nétrine-1 pourrait également permettre aux tumeurs d’assurer le développement de leur propre réseau vasculaire. En effet, la nétrine-1 est exprimée en condition d’hypoxie, ce qui permet la mise en place d’une néo-angiogenèse, non seulement en bloquant l’apoptose induite par son récepteur UNC5B, mais également par l’implication des voies angiogéniques reposant sur ERK et sur la PKC (protéine kinase C) [
13
,
40
,
41
]. La nétrine-1 et ses récepteurs, UNC5B et néogénine, ont également été décrits pour leur rôle dans le maintien de la pluripotence cellulaire. Ce mécanisme, qui participe à l’agressivité tumorale, attribue aux cellules cancéreuses un caractère « cellule souche » par l’activation de la voie des MAPK et de la voie Wnt, permettant ainsi la résistance des cellules aux thérapies classiques et les récidives, voire la mise en place de métastases [
40
]. Une expression importante de la nétrine-1 est en effet associée aux caractères migratoires et invasifs des cellules cancéreuses, des caractères propres aux cellules métastatiques. Ces caractéristiques se traduisent par la réinitialisation des capacités migratoires et invasives des cellules présentes lors du développement, ou accidentellement acquises
de novo
lors des processus de cicatrisation, notamment lors de la réactivation de la transition épithélio-mésenchymateuse (EMT) [
42
].
La motilité cellulaire implique une réorganisation du cytosquelette d’actine. Cette réorganisation pourrait être induite soit directement dans les cellules tumorales, par des signaux intracellulaires liés à l’interaction de la nétrine-1 avec ses récepteurs [
38
], soit de manière plus indirecte,
via
l’activation de facteurs de transcription comme NF-kB (
nuclear factor-
k
B
) [
43
] et CREB (
cAMP-response element binding protein
) [
44
], soit encore par l’action de co-activateurs transcriptomiques, comme YAP (
yes-associated protein
) [
33
] avec, pour conséquence, l’expression et la sécrétion de métalloprotéases et d’interleukines qui favorisent la dégradation de la matrice extracellulaire, promouvant ainsi la formation de métastases [
44
].
|
La nétrine-1 et le microenvironnement tumoral
L’inflammation et le développement tumoral sont intimement liés et les liens entre nétrine-1 et inflammation sont nombreux. La non-résolution d’une inflammation générée à la suite d’une lésion physique, chimique ou infectieuse, ou d’une réponse immunitaire incontrôlée, peuvent profondément perturber le microenvironnement cellulaire et favoriser le développement tumoral. Un lien direct a été montré entre le facteur de transcription NF-kB, qui régule plusieurs gènes codant des protéines de l’inflammation, et le promoteur du gène codant la nétrine-1. En effet, un contexte inflammatoire à l’origine de l’activation de NF-kB permettrait la transcription du gène codant la nétrine-1 avec pour conséquence l’inhibition du rôle de suppresseur de tumeurs des récepteurs à dépendance, favorisant ainsi le développement des tumeurs [
43
].
La nétrine-1 a cependant, selon les cellules et les tissus concernés, un rôle bivalent dans les phénomènes inflammatoires. En effet, elle serait impliquée dans de nombreuses maladies, telles que l’ischémie, l’obésité ou les maladies cardiovasculaires comme l’athérosclérose. La conséquence de l’augmentation de son expression dans ces maladies dépendrait de la cellule qui l’exprime. Par exemple, dans le cadre d’une ischémie du rein, du poumon ou du cœur, l’augmentation d’expression de nétrine-1, sécrétée par les cellules endothéliales en condition d’hypoxie, permettrait une protection des risques liés à l’inflammation en maintenant la fonction de barrière des vaisseaux, atténuant ainsi l’afflux et l’adhérence de monocytes circulants, de même que l’infiltration leucocytaires, dans les tissus [
45
-
47
]. Cette augmentation de nétrine-1 serait aussi impliquée dans le maintien de la barrière hémato-encéphalique, protégeant le système nerveux central d’une inflammation [
48
].
Lors de l’inflammation, un effet direct de la surexpression de la nétrine-1 sur la survie des cellules, telles que les cellules endothéliales, les cardiomyocytes ou les cellules tubulaires du rein, a été observé. Cet effet n’est pas sans rappeler la fonction de blocage de la mort liée aux récepteurs à dépendance. Dans l’obésité et l’athérosclérose, la présence de nétrine-1 produite par les macrophages présents dans les tissus adipeux et les plaques d’athérosclérose, favoriserait leur rétention et leur accumulation [
47
,
49
]. Récemment, il a d’ailleurs été montré, chez la souris, que la perte de l’expression de nétrine-1 dans les macrophages réduisait l’inflammation et la résistance à l’insuline associée à l’obésité [
50
].
En dehors de l’environnement inflammatoire qu’elles rencontrent, d’autres éléments facilitent le développement tumoral des cellules cancéreuses, en particulier les CAF (
cancer-associated fibroblasts
). En effet, des CAF, cultivés en présence de cellules tumorales, sécrètent la nétrine-1 ainsi que des cytokines qui induisent, dans les cellules cancéreuses, un phénotype « souche » plus agressif [
51
].
|
La nétrine-1, une nouvelle cible thérapeutique et un marqueur potentiel
En raison de sa sécrétion, de sa surexpression dans de nombreuses tumeurs, et de son rôle dans l’inflammation et sur la plasticité cellulaire, la nétrine-1 apparaît comme une cible de choix pour une nouvelle thérapie ciblée antitumorale. De nombreux essais d’interférence, altérant la liaison de la nétrine-1 avec ses récepteurs, réalisés sur plusieurs types de tumeurs, que ce soit
in vitro
ou
in vivo
chez la souris, ont révélé un effet inhibiteur sur la croissance tumorale et le développement de métastases, non seulement du fait de l’inhibition de la voie positive, la migration et l’invasion cellulaire [
36
], mais aussi par induction de la mort cellulaire par apoptose des cellules cancéreuses. Ces effets ont été observés en monothérapie, mais également lors d’essais réalisés en association avec des chimiothérapies conventionnelles ou des agents déméthylants
(
Tableau I
)
[
22
,
52
]. Récemment, un premier essai clinique de phase I, évaluant un anticorps monoclonal humanisé dirigé contre la nétrine-1, a été conduit chez des patients atteints de cancers solides avancés et métastatiques. Outre le fait qu’aucune toxicité n’ait été observée, des signes tangibles d’efficacité sur les lésions et la survie des patients, sans récidive, ont été mis en évidence, permettant d’espérer la mise en place d’une nouvelle thérapie anti-cancéreuse [
53
].
Tableau I.
| Agent interférant |
Type de cancer |
Effet sur les tumeurs |
Références |
| Anticorps monoclonal anti-nétrine-1 |
Côlon, NSCLC, sein, lymphomes de type ABC et leucémie myéloïde chronique |
– Inhibition de la croissance tumorale
– Induction de la mort cellulaire
– Combinaison avec une chimiothérapie efficace |
[
22
], [
34
], [
51
]
|
|
| siARN anti-nétrine-1 |
Glioblastome, poumon, neuroblastome, mélanome, médulloblastome |
– Inhibition de la croissance tumorale
– Inhibition de la prolifération, de la survie, de l’invasion, de la migration
– Inhibition de l’angiogenèse
– Réduction des métastases
– Induction de la mort cellulaire
– Combinaison avec une chimiothérapie efficace |
[
23
], [
24
], [
26
], [
27
], [
42
], [
52
]
|
|
| shARN anti-nétrine-1 |
Prostate, hépatocarcinome |
– Inhibition de prolifération, survie, invasion, migration |
[
35
],[
37
]
|
|
| TRAP-nétrine-1 (domaine extracellulaire des récepteurs DCC ou UNC5A) |
Poumon, pancréas |
– Inhibition de la croissance tumorale
– Réduction des métastases
– Induction de la mort cellulaire |
[
28
], [
52
]
|
Utilisation d’agents interférant avec la nétrine-1.
Ce tableau reprend l’ensemble des traitements interférant avec la nétrine-1 dans différents modèles de cancer, et leurs effets associés. ABC :
activated B cell
; DCC :
deleted in colorectal cancer
; UNC5B :
unc-5 netrin receptor B
; NSCLC :
non small cell lung carcinoma
; TRAP : fusion des ectodomaines des récepteurs à dépendance fixant la nétrine-1 à une région Fc d’IgG.
|
Un aspect important de la nétrine-1 est son rôle potentiel comme biomarqueur prédictif de la présence de cancers, de leur évolution et de l’efficacité du traitement administré. De nombreuses études rapportent une corrélation entre la présence de nétrine-1 dans les fluides biologiques et l’agressivité des tumeurs associées [
31
]. Cependant, la plupart des résultats relatés dans la littérature doivent être soumis à une certaine réserve [
54
]. En effet, les tests utilisés dans les études (tests immunoenzymatiques de type ELISA [
enzyme-linked immunosorbent assay
]), ne permettent pas d’évaluer spécifiquement la présence de nétrine-1, ni de quantifier les taux de la protéine dans les fluides biologiques [
27
,
29
,
31
]. Toutefois, les techniques de marquage de tumeurs par immunohistochimie ou par analyse des ARN messagers réalisées sur les tumeurs primaires, ont montré que des valeurs élevées de nétrine-1 ou d’ARNm codant cette protéine, étaient corrélées à un mauvais pronostique dans l’adénocarcinome du pancréas et les cancers de l’ovaire [
21
,
30
], faisant de la nétrine-1 un nouveau biomarqueur potentiel pour ces types de cancers.
|
Il apparaît désormais que la nétrine-1 participe au développement de tumeurs en se fixant à ses récepteurs à dépendance, faisant de cette protéine un nouveau candidat pour une thérapie ciblée. La nétrine-1 est une molécule qui participe au développement embryonnaire ; elle ne serait pas la seule molécule à être réactivée et détournée de son rôle au cours du développement, pour contribuer au processus pathologique tumoral. D’autres molécules, comme les sémaphorines, seraient en effet capables, par leur pouvoir attractant ou répulsif, de jouer un rôle important dans l’angiogenèse, l’inflammation et la tumorigenèse. La réactivation de ces molécules serait ainsi un avantage pour la cellule tumorale mais aussi pour la régulation du microenvironnement de la tumeur, notamment en agissant sur l’attractivité ou la répulsion de certaines cellules du système immunitaire, comme les lymphocytes, les macrophages ou les cellules endothéliales et les fibroblastes [
55
]. Ces molécules de guidage pourraient jouer un rôle dans le maintien des cellules tumorales à l’état de cellules souches, un phénomène qui joue un rôle central dans la résistance aux thérapies classiques. Cibler ce type de molécule représente donc une stratégie prometteuse et innovante, en monothérapie ou en combinaison avec les chimiothérapies, la radiothérapie ou les immunothérapies. Des tests cliniques de phase II en combinaison avec les traitements standards ont récemment débuté dans le cancer de l’endomètre et du col de l’utérus, et devraient permettre d’évaluer l’efficacité de ce type de traitement. Les analyses des échantillons issus des patients devraient permettre également de préciser le rôle de la nétrine-1 et de caractériser les voies de signalisation qui lui sont associées.
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Serafini
T
,
Kennedy
TE
,
Galko
MJ
,
et al.
The netrins define a family of axon outgrowth-promoting proteins homologous to C. elegans UNC-6.
.
Cell.
1994;
;
78
:
:409.
–
424
.
2.
Rajasekharan
S
,
Kennedy
TE
.
The netrin protein family.
.
Genome Biol.
2009;
;
10
:
:239.
.
3.
Delloye-Bourgeois
C
,
Goldschneider
D
,
Paradisi
A
,
et al.
Nucleolar localization of a netrin-1 isoform enhances tumor cell proliferation.
.
Sci Signal.
2012;
;
5
:
:ra57.
.
4.
Negulescu
A-M
,
Mehlen
P
.
Dependence receptors - the dark side awakens.
.
FEBS J.
2018;
;
285
:
:3909.
–
3924
.
5.
Grandin
M
,
Meier
M
,
Delcros
JG
,
et al.
Structural Decoding of the Netrin-1/UNC5 Interaction and its Therapeutical Implications in Cancers.
.
Cancer Cell.
2016;
;
29
:
:173.
–
185
.
6.
Liu
G
,
Li
W
,
Wang
L
,
et al.
DSCAM functions as a netrin receptor in commissural axon pathfinding.
.
Proc Natl Acad Sci U S A.
2009;
;
106
:
:2951.
–
2956
.
7.
Tu
T
,
Zhang
C
,
Yan
H
,
et al.
CD146 acts as a novel receptor for netrin-1 in promoting angiogenesis and vascular development.
.
Cell Res.
2015;
;
25
:
:275.
–
287
.
8.
Stein
E
,
Zou
Y
,
Poo
M
,
et al.
Binding of DCC by netrin-1 to mediate axon guidance independent of adenosine A2B receptor activation.
.
Science.
2001;
;
291
:
:1976.
–
1982
.
9.
Stanco
A
,
Szekeres
C
,
Patel
N
,
et al.
Netrin-1-alpha3beta1 integrin interactions regulate the migration of interneurons through the cortical marginal zone.
.
Proc Natl Acad Sci USA.
2009;
;
106
:
:7595.
–
7600
.
10.
Matsumoto
Y
,
Irie
F
,
Inatani
M
,
et al.
Netrin-1/DCC signaling in commissural axon guidance requires cell-autonomous expression of heparan sulfate.
.
J Neurosci.
2007;
;
27
:
:4342.
–
4350
.
11.
Wang
H
,
Boussouar
A
,
Mazelin
L
,
et al.
The Proto-oncogene c-Kit Inhibits Tumor Growth by Behaving as a Dependence Receptor.
.
Mol Cell.
2018;
;
72
:
(413–25)
:e5.
.
12.
Mehlen
P
,
Rama
N
.
Nétrine-1 et guidage axonal - Signalisation et traduction asymétrique.
.
Med Sci (Paris).
2007;
;
23
:
:311.
–
315
.
13.
Castets
M
,
Mehlen
P
.
Netrin-1 role in angiogenesis: to be or not to be a pro-angiogenic factor?
.
Cell Cycle.
2010;
;
9
:
:1466.
–
1471
.
14.
Brunet
I
,
Gordon
E
,
Han
J
,
et al.
Netrin-1 controls sympathetic arterial innervation.
.
J Clin Invest.
2014;
;
124
:
:3230.
–
3240
.
15.
Murray
MJ
.
The Role of Netrins and Their Receptors in Epithelial Mesenchymal Plasticity during Development.
.
Cells Tissues Organs.
2017;
;
203
:
:71.
–
81
.
16.
Hardy
H
,
Prendergast
JG
,
Patel
A
,
et al.
Detailed analysis of chick optic fissure closure reveals Netrin-1 as an essential mediator of epithelial fusion.
.
Elife.
2019
;
:8.
.
17.
Schlegel
M
,
Köhler
D
,
Körner
A
,
et al.
The neuroimmune guidance cue netrin-1 controls resolution programs and promotes liver regeneration.
.
Hepatology.
2016;
;
63
:
:1689.
–
1705
.
18.
Tang
T
,
Gao
D
,
Yang
X
,
et al.
Exogenous Netrin-1 Inhibits Autophagy of Ischemic Brain Tissues and Hypoxic Neurons via PI3K/mTOR Pathway in Ischemic Stroke.
.
J Stroke Cerebrovasc Dis.
2019;
;
28
:
:1338.
–
1345
.
19.
Mehlen
P
,
Lavial
F
.
Le facteur nétrine-1 régule la reprogrammation cellulaire vers l’état pluripotent.
.
Med Sci (Paris).
2016;
;
32
:
:241.
–
244
.
20.
Mazelin
L
,
Bernet
A
,
Bonod-Bidaud
C
,
et al.
Netrin-1 controls colorectal tumorigenesis by regulating apoptosis.
.
Nature.
2004;
;
431
:
:80.
–
84
.
21.
Papanastasiou
AD
,
Pampalakis
G
,
Katsaros
D
,
et al.
Netrin-1 overexpression is predictive of ovarian malignancies.
.
Oncotarget.
2011;
;
2
:
:363.
–
367
.
22.
Grandin
M
,
Mathot
P
,
Devailly
G
,
et al.
Inhibition of DNA methylation promotes breast tumor sensitivity to netrin-1 interference.
.
EMBO Mol Med.
2016;
;
8
:
:863.
–
877
.
23.
Kaufmann
S
,
Kuphal
S
,
Schubert
T
,
et al.
Functional implication of Netrin expression in malignant melanoma.
.
Cell Oncol.
2009;
;
31
:
:415.
–
422
.
24.
Sanvoranart
T
,
Supokawej
A
,
Kheolamai
P
,
et al.
Targeting Netrin-1 in glioblastoma stem-like cells inhibits growth, invasion, and angiogenesis.
.
Tumour Biol.
2016;
;
37
:
:14949.
–
14960
.
25.
Harter
PN
,
Zinke
J
,
Scholz
A
,
et al.
Netrin-1 Expression Is an Independent Prognostic Factor for Poor Patient Survival in Brain Metastases.
.
PLoS One.
2014;
;
9
:
:e92311.
.
26.
Delloye-Bourgeois
C
,
Fitamant
J
,
Paradisi
A
,
et al.
Netrin-1 acts as a survival factor for aggressive neuroblastoma.
.
J Exp Med.
2009;
;
206
:
:833.
–
847
.
27.
Akino
T
,
Han
X
,
Nakayama
H
,
et al.
Netrin-1 promotes medulloblastoma cell invasiveness and angiogenesis, and demonstrates elevated expression in tumor tissue and urine of patients with pediatric medulloblastoma.
.
Cancer Res.
2014;
;
74
:
:3716.
–
3726
.
28.
Delloye-Bourgeois
C
,
Brambilla
E
,
Coissieux
M-M
,
et al.
Interference with netrin-1 and tumor cell death in non-small cell lung cancer.
.
J Natl Cancer Inst.
2009;
;
101
:
:237.
–
247
.
29.
Ramesh
G
,
Krawczeski
CD
,
Woo
JG
,
et al.
Urinary netrin-1 is an early predictive biomarker of acute kidney injury after cardiac surgery.
.
Clin J Am Soc Nephrol.
2010;
;
5
:
:395.
–
401
.
30.
Link
B-C
,
Reichelt
U
,
Schreiber
M
,
et al.
Prognostic implications of netrin-1 expression and its receptors in patients with adenocarcinoma of the pancreas.
.
Ann Surg Oncol.
2007;
;
14
:
:2591.
–
2599
.
31.
Kefeli
U
,
Yildirim
ME
,
Aydin
D
,
et al.
Netrin-1 concentrations in patients with advanced gastric cancer and its relation with treatment.
.
Biomarkers.
2012;
;
17
:
:663.
–
667
.
32.
Paradisi
A
,
Maisse
C
,
Coissieux
MM
,
et al.
Netrin-1 up-regulation in inflammatory bowel diseases is required for colorectal cancer progression.
.
Proc Natl Acad Sci USA.
2009;
;
106
:
:17146.
–
17151
.
33.
Yin
K
,
Dang
S
,
Cui
L
,
et al.
Netrin-1 promotes metastasis of gastric cancer by regulating YAP activity.
.
Biochem Biophys Res Commun.
2018;
;
496
:
:76.
–
82
.
34.
Broutier
L
,
Creveaux
M
,
Vial
J
,
et al.
Targeting netrin-1/DCC interaction in diffuse large B-cell and mantle cell lymphomas.
.
EMBO Mol Med.
2016;
;
8
:
:96.
–
104
.
35.
Chen
H
,
Chen
Q
,
Luo
Q
.
Expression of netrin-1 by hypoxia contributes to the invasion and migration of prostate carcinoma cells by regulating YAP activity.
.
Exp Cell Res.
2016;
;
349
:
:302.
–
309
.
36.
Jin
X
,
Luan
H
,
Chai
H
,
et al.
Netrin-1 interference potentiates epithelial-to-mesenchymal transition through the PI3K/AKT pathway under the hypoxic microenvironment conditions of non-small cell lung cancer.
.
Int J Oncol.
2019;
;
54
:
:1457.
–
1465
.
37.
Han
P
,
Fu
Y
,
Liu
J
,
et al.
Netrin-1 promotes cell migration and invasion by down-regulation of BVES expression in human hepatocellular carcinoma.
.
Am J Cancer Res.
2015;
;
5
:
:1396.
–
1409
.
38.
Yin
K
,
Wang
L
,
Zhang
X
,
et al.
Netrin-1 promotes gastric cancer cell proliferation and invasion via the receptor neogenin through PI3K/AKT signaling pathway.
.
Oncotarget.
2017;
;
8
:
:51177.
–
51189
.
39.
Huang
Q
,
Hua
HW
,
Jiang
F
,
et al.
Netrin-1 promoted pancreatic cancer cell proliferation by upregulation of Mdm2.
.
Tumour Biol.
2014;
;
35
:
:9927.
–
9934
.
40.
Huyghe
A
,
Furlan
G
,
Ozmadenci
D
,
et al.
Netrin-1 promotes naive pluripotency through Neo1 and Unc5b co-regulation of Wnt and MAPK signalling.
.
Nat Cell Biol.
2020;
;
22
:
:389.
–
400
.
41.
Liu
J
,
Li
J
.
PKCα and Netrin-1/UNC5B positive feedback control in relation with chemical therapy in bladder cancer.
.
Eur Rev Med Pharmacol Sci.
2020;
;
24
:
:1712.
–
7
.
42.
Zhang
X
,
Cui
P
,
Ding
B
,
et al.
Netrin-1 elicits metastatic potential of non-small cell lung carcinoma cell by enhancing cell invasion, migration and vasculogenic mimicry via EMT induction.
.
Cancer Gene Ther.
2018;
;
25
:
:18.
–
26
.
43.
Paradisi
A
,
Maisse
C
,
Bernet
A
,
et al.
NF-kappaB regulates netrin-1 expression and affects the conditional tumor suppressive activity of the netrin-1 receptors.
.
Gastroenterology.
2008;
;
135
:
:1248.
–
1257
.
44.
Lee
S-J
,
Jung
YH
,
Oh
SY
,
et al.
Netrin-1 induces MMP-12-dependent E-cadherin degradation via the distinct activation of PKCα and FAK/Fyn in promoting mesenchymal stem cell motility.
.
Stem Cells Dev.
2014;
;
23
:
:1870.
–
1882
.
45.
Ly
NP
,
Komatsuzaki
K
,
Fraser
IP
,
et al.
Netrin-1 inhibits leukocyte migration in vitro and in vivo.
.
Proc Natl Acad Sci U S A.
2005;
;
102
:
:14729.
–
14734
.
46.
Rosenberger
P
,
Schwab
JM
,
Mirakaj
V
,
et al.
Hypoxia-inducible factor-dependent induction of netrin-1 dampens inflammation caused by hypoxia.
.
Nat Immunol.
2009;
;
10
:
:195.
–
202
.
47.
van Gils
JM
,
Derby
MC
,
Fernandes
LR
,
et al.
The neuroimmune guidance cue netrin-1 promotes atherosclerosis by inhibiting the emigration of macrophages from plaques.
.
Nat Immunol.
2012;
;
13
:
:136.
–
143
.
48.
Podjaski
C
,
Alvarez
JI
,
Bourbonniere
L
,
et al.
Netrin 1 regulates blood-brain barrier function and neuroinflammation.
.
Brain.
2015;
;
138
:
:1598.
–
1612
.
49.
Ramkhelawon
B
,
Hennessy
EJ
,
Ménager
M
,
et al.
Netrin-1 promotes adipose tissue macrophage retention and insulin resistance in obesity.
.
Nat Med.
2014;
;
20
:
:377.
–
384
.
50.
Sharma
M
,
Schlegel
M
,
Brown
EJ
,
et al.
Netrin-1 Alters Adipose Tissue Macrophage Fate and Function in Obesity.
.
Immunometabolism.
2019
;
:1.
.
51.
Sung
P-J
,
Rama
N
,
Imbach
J
,
et al.
Cancer-Associated Fibroblasts Produce Netrin-1 to Control Cancer Cell Plasticity.
.
Cancer Res.
2019;
;
79
:
:3651.
–
3661
.
52.
Paradisi
A
,
Creveaux
M
,
Gibert
B
,
et al.
Combining chemotherapeutic agents and netrin-1 interference potentiates cancer cell death.
.
EMBO Mol Med.
2013;
;
5
:
:1821.
–
1834
.
53.
Cassier
P
,
Eberst
L
,
Courbebaisse
Y
,
et al.
439O : A first in human, phase I trial of NP137, a first-in-class antibody targeting netrin-1, in patients with advanced refractory solid tumors.
.
Annals of Oncology.
2019;
;
30
:
:v159.
.
54.
Bruikman
CS
,
Zhang
H
,
Kemper
AM
,
et al.
Netrin Family: Role for Protein Isoforms in Cancer.
.
J Nucleic Acids.
2019;
;
2019
:
:3947123.
.
55.
Nakayama
H
,
Kusumoto
C
,
Nakahara
M
,
et al.
Semaphorin 3F and Netrin-1: The Novel Function as a Regulator of Tumor Microenvironment.
.
Front Physiol.
2018;
;
9
:
:1662.
.
|