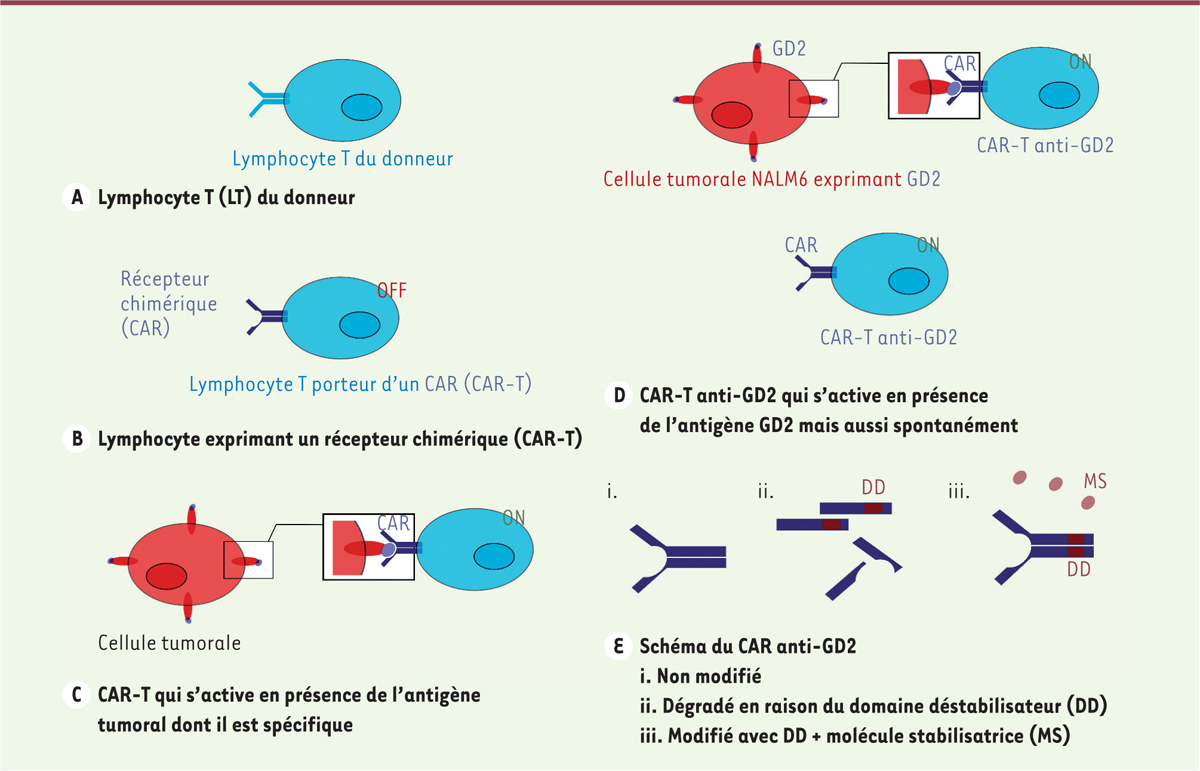
Les cellules CAR-T ( chimeric antigen receptor - T cells ou CAR-T cells ), des lymphocytes T porteurs d’un récepteur chimérique de l’antigène, sont utilisées en France depuis 2018 pour traiter certaines hémopathies malignes (leucémie aiguë lymphoblastique à cellules B, lymphome diffus à grandes cellules B, myélome multiple). Pour les fabriquer, les lymphocytes T du patient sont prélevés, puis modifiés génétiquement de façon à exprimer à leur surface un récepteur chimérique de l’antigène ( chimeric antigen receptor, CAR), ce qui leur permet de reconnaître les cellules cancéreuses, de s’activer, et de les détruire ( Figure 1A, B, C ) . Ces lymphocytes T ainsi modifiés sont ensuite réinjectés au patient.
| Figure 1.
Représentation schématique des différents protagonistes
(d’après [
5
]).
A.
Lymphocyte T (LT) du donneur.
B..
LT exprimant un récepteur chimérique (CAR-T).
C.
CAR-T qui s’active en présence de l’antigène tumoral dont il est spécifique.
D.
CAR-T anti-GD2 qui s’active en présence de l’antigène GD2, mais aussi spontanément.
E.
CAR anti-GD2.
|
Les CAR-T cells permettent de déclencher une réponse immunitaire indépendamment du complexe majeur d’histocompatibilité. Le CAR se compose de trois parties : une partie variable à chaîne unique, appelé scFv ( single chain Fragment variable), une région transmembranaire, une région intracellulaire responsable de la signalisation intracellulaire (CD3ζ), et deux régions intercellulaires co-stimulatrices (4-IBB, CD28).
Les freins pratiques à l’utilisation thérapeutique des CAR-T cells incluent leur délai de fabrication (un facteur limitant en cas de maladie cancéreuse agressive d’évolution rapide), les possibilités restreintes d’accès à ce traitement (seulement 24 centres agréés en France en mars 2021), et leur coût. Les freins cliniques à ce traitement sont : la difficulté d’identification des patients susceptibles d’y répondre (seulement 40 à 50 % des patients présentent une réponse complète six mois après le traitement, et les facteurs prédictifs d’une réponse favorable ne sont pas complètement identifiés) ; ses effets indésirables sévères (syndrome de relargage cytokinique, caractérisé par une activation incontrôlée des différents effecteurs de l’inflammation, atteintes neurologiques diverses, aplasie médullaire), nécessitant très souvent une hospitalisation dans un service de soins intensifs, et sa perte d’efficacité au cours du temps.
L’épuisement des CAR-T cells au cours du temps a été identifié comme l’une des principales causes d’échec thérapeutique. Cet épuisement est la conséquence d’un excès de stimulation du CAR, lié soit à une charge antigénique tumorale trop importante, soit à l’activation des CAR du fait de leur assemblage spontané de façon indépendante de l’antigène [ 1 , 2 ]. L’épuisement des CAR-T cells impliquerait une modification stable de leur état épigénétique [ 3 , 4 ]. Les résultats d’une étude récente ont montré qu’un repos intermittent des CAR-T cells permet non seulement de prévenir leur épuisement, mais aussi de restaurer leur activité anti-tumorale, avec un profil de type « T mémoire ». Cette restauration met en jeu un changement d’état épigénétique [ 5 ].
Nous ne présentons ici qu’un seul des modèles expérimentaux utilisés par les auteurs de cette étude [ 5 ]. Il s’agit d’un modèle in vitro de CAR anti-GD2 (disialoganglioside) modifié de façon à exprimer un domaine déstabilisateur. Le CAR anti-GD2 a la capacité de s’activer de façon spontanée et indépendante de l’antigène dont il est spécifique du fait d’une oligomérisation spontanée ( Figure 1D ) . La présence du domaine déstabilisateur provoque la rapide dégradation de ce CAR et prévient donc son activation spontanée ( Figure 1E ) . L’utilisation d’une molécule stabilisatrice ( shield-1 ) permet l’assemblage du CAR à la surface des lymphocytes T malgré la présence du domaine déstabilisateur, et ainsi de contrôler leur activation. Les lymphocytes T de différents donneurs ont été modifiés génétiquement, de façon à acquérir la capacité d’exprimer ce CAR anti-GD2 modifié. Les CAR-T cells ainsi obtenues sont cultivées en présence d’une lignée cellulaire de leucémie modifiée de façon à exprimer l’antigène GD2 (nalm6-GD2), afin de stimuler les CAR-T cells avec l’antigène dont elles sont spécifiques. Ces CAR-T cells ont été cultivées dans différentes conditions ( Tableau I ) , et leurs caractéristiques ainsi que leur efficacité anti-tumorale ont été comparées aux 11 e et 15 e jours (J11 et J15) de culture.
Tableau I.
Protocole expérimental et nomenclature utilisée dans cet article
(d’après [
5
]). J : Jour ;
CAR-T cells
: lymphocyte T exprimant un récepteur chimérique membranaire.
|
La comparaison à J11 entre les CAR-T cells ON J1-11 et les CAR-T cells OFF ou REPOS J7-11 (voir Tableau I ) fait apparaître des différences marquées : les cellules ON J1-11 présentent une augmentation relative des marqueurs d’épuisement (molécules de surface co-inhibitrices), tels que PD1 ( programmed cell death protein 1 ), TIM3 ( T-cell immunoglobulin and mucin containing protein-3) , LAG3 ( lymphocyte activation gene-3 ), tandis que les cellules OFF ou REPOS J7-11 montrent une augmentation relative de leur efficacité anti-tumorale et la mise en place d’une mémoire immunitaire. Les changements observés entre les cellules ON J1-11 et les cellules REPOS J7-11 semblent être la conséquence d’une modification de leurs caractéristiques plutôt que de la multiplication préférentielle d’une sous-population de cellules puisqu’il n’y a pas de différence entre ces populations en termes de prolifération ou d’expression du marqueur TCF1 ( transcription factor T cell factor 1 ), un facteur de transcription caractéristique de la cellule progénitrice des lymphocytes T épuisés.
À J15, les cellules REPOS J11-15 se caractérisent par une diminution relative des marqueurs d’épuisement, ainsi qu’une augmentation des marqueurs de mémoire immunitaire. Ces résultats mettent en évidence la réversibilité de l’épuisement des CAR-T cells puisqu’avant leur mise au repos à J11, ces mêmes cellules (ON J1-11 ) présentaient des marqueurs d’épuisement. De plus, les cellules REPOS J7-15 et REPOS J11-15 ont une meilleure efficacité anti-tumorale, caractérisée par une augmentation de la cytotoxicité et par la sécrétion des cytokines inflammatoires interleukine-2 et interféron-γ, que les cellules ON J1-15 . L’ajout d’anticorps anti-PD1, un inhibiteur de point de contrôle immunitaire, aux cellules ON permet d’augmenter leur cytotoxicité, mais pas la sécrétion de cytokines. Cela met en évidence que la reprogrammation fonctionnelle induite par le repos ne se limite pas à un blocage des points de contrôle immunitaire.
L’étude du transcriptome (par RNAseq) de ces différentes cellules montre que les cellules OFF, REPOS J7-11 et REPOS J11-15 se ressemblent et se distinguent des cellules ON. Les différences reposent sur une expression des gènes caractéristiques d’un épuisement cellulaire, tels que PDCD1 ( programmed cell death 1 ), ENTPD1 ( ectonucleoside triphosphate diphosphohydrolase 1 ), BATF ( basic leucine zipper ATF-like transcription factor ), NR4A1 ( nuclear receptor subfamily 4 group A member 1 ), dans les cellules ON, et une expression des gènes caractéristiques de la mise en place d’une mémoire immunitaire, tels que IL7R ( interleukin 7 receptor ), LEF1 ( lymphoid enhancer-binding factor 1 ), KLF2 ( Krüppel-like factor 2 ), BACH2 ( BTB and CNC homolog 2 ), dans les cellules REPOS J7-11 et REPOS J11-15.
L’étude des régions accessibles de la chromatine par ATACseq (assay for transposase-accessible chromatin with high throughput sequencing ) montre également que les cellules OFF, REPOS J7-11 et REPOS J11-15 se ressemblent entre elles et se distinguent des cellules ON. Dans les cellules REPOS J7J-11 et les cellules REPOS J11-15 , les sites de liaison à l’ADN des facteurs de transcription impliqués dans la mise en place d’une mémoire immunitaire sont accessibles, alors que ceux caractéristiques de l’épuisement cellulaire ne le sont pas. Dans les cellules ON, en revanche, les sites de liaison à l’ADN des facteurs de transcription impliqués dans l’épuisement cellulaire sont accessibles.
La cartographie des sites de liaison à l’ADN de l’histone H3K27me3 distingue les cellules OFF, REPOS J7-11 et REPOS J11-15 des cellules ON, en accord avec les données de RNAseq et de ATACseq ( Assay for Transposase-Accessible Chromatin with highthroughput sequencing ). La présence de H3K27me3 dépend de EZH2 ( enhancer of zeste homolog 2 ), qui permet d’ajouter trois groupes méthyle sur la lysine 27 de l’histone 3. Un traitement des cellules REPOS J11-15 par un inhibiteur de EZH2 a un impact sur la reprogrammation fonctionnelle de ces cellules par le repos, qui se manifeste par une moindre restauration de la sécrétion d’interleukine-2 par ces cellules et de leur cytotoxicité.
Cette étude a donc permis de montrer que la mise au repos transitoire des cellules CAR-T augmente leur efficacité thérapeutique anti-tumorale, en prévenant leur épuisement et en favorisant la mise en place d’une mémoire immunitaire. Cette reprogrammation fonctionnelle repose sur une modulation de marques épigénétiques.