La plupart des organismes vivants pluricellulaires sont constitués d’un grand nombre de cellules très différentes. À l’exception des gamètes, qui sont le produit d’une division cellulaire particulière (méiose), toutes ces cellules sont produites par division cellulaire mitotique. Lors d’un cycle mitotique, la cellule duplique son matériel génétique pendant la phase de réplication de l’ADN (phase S), avant de le répartir de manière égale entre les deux cellules filles pendant la mitose, qui est la phase la plus spectaculaire de ce cycle. En effet, lors de l’entrée en mitose, la cellule subit une profonde réorganisation de son architecture : l’ADN se condense en chromosomes individuels, l’enveloppe nucléaire se rompt, permettant ainsi la « capture » des chromosomes par les microtubules émanant des centrosomes. Commence alors la « danse » des chromosomes, qui viennent d’abord s’aligner sur la plaque métaphasique, puis les deux chromatides sœurs de chaque chromosome sont réparties entre les deux cellules filles, tractées par les microtubules du fuseau mitotique.
Des erreurs dans la coordination de ces différents processus peuvent avoir des conséquences dramatiques et entraîner la mort cellulaire ou une instabilité génétique à l’origine de diverses maladies, comme les cancers.
Cette profonde réorganisation cellulaire est sous le contrôle de sérine-thréonine protéine kinases, qui s’activent en cascade et coordonnent toutes les étapes de la mitose. La protéine AURKA ( Aurora kinase A ) est située au sommet de la cascade. Elle active la Polo-like kinase (Plk1), puis le complexe cycline B-Cdk1 ( cyclin-dependent kinase ), qui déclenche l’entrée de la cellule en mitose.
L’activation précise et coordonnée de ces kinases conduit à une augmentation considérable de la phosphorylation du protéome, et ainsi à la réorganisation de l’architecture cellulaire. Outre un rôle majeur dans l’activation du complexe cycline B-Cdk1, AURKA et Plk1 coordonnent la condensation des chromosomes, la maturation des centrosomes, la rupture de l’enveloppe nucléaire, la nucléation des microtubules, et l’assemblage du fuseau mitotique. Bien que le rôle de ces kinases soit assez bien décrit, le mécanisme précis qui conduit à leur activation lors de l’entrée de la cellule en mitose reste obscur.
Comme la majorité des protéines kinases, AURKA et Plk1 sont activées par phosphorylation d’un résidu de leur boucle d’activation conservé au cours de l’évolution, ce qui permet de les stabiliser dans une conformation active, compatible avec la fixation de l’ATP ( adénosine triphosphate ) et du substrat [ 1 ]. Cette phosphorylation activatrice peut s’effectuer par autophosphorylation ou par l’action d’une autre kinase. Par exemple, Plk1, incapable de s’autophosphoryler, nécessite une phosphorylation activatrice par AURKA [ 2 , 3 ]. En revanche, AURKA peut s’autophosphoryler sur sa boucle d’activation. Cependant, pendant la phase G2 du cycle cellulaire, AURKA est maintenue dans un état déphosphorylé par des phosphatases, dont l’activité prédomine en interphase [ 4 ]. Puisque la déphosphorylation maintient AURKA dans un état inactif, comment AURKA surmonte-t-elle l’effet répressif des phosphatases pour activer Plk1 et déclencher l’entrée de la cellule en mitose ?
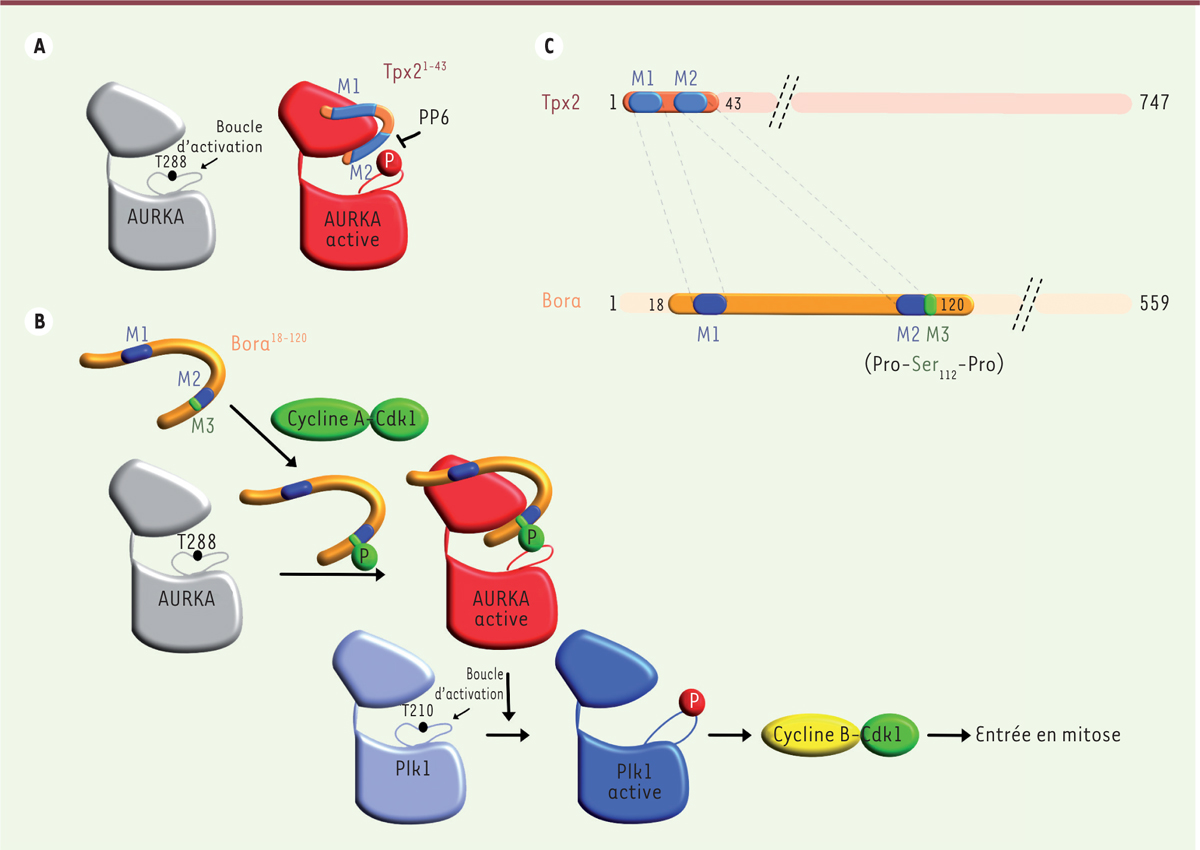
L’activation d’AURKA est d’une remarquable complexité, et des mécanismes différents d’activation de cette kinase ont été décrits. Outre son activation par autophosphorylation, AURKA est activée par sa liaison à divers modulateurs allostériques qui recrutent la protéine et l’activent localement à des emplacements intracellulaires spécifiques [ 5 ]. L’activateur allostérique de AURKA le mieux connu est Tpx2 ( targeting protein for Xklp2 ), qui recrute et active AURKA au niveau des microtubules du fuseau mitotique [ 6 ]. Tpx2 utilise les 43 premiers acides aminés de sa séquence peptidique pour activer AURKA d’une manière synergique avec l’autophosphorylation de la boucle d’activation, en se fixant au domaine kinase de AURKA [ 7 , 8 ] ( Figure 1A ) .
| Figure 1.
Comparaison des mécanismes d’activation de la protéine kinase AURKA par Tpx2 et phospho-Bora. A.
En l’absence de liaison à Tpx2 et de phosphorylation de sa boucle d’activation, AURKA présente une activité kinase très faible mais détectable. La fixation de Tpx2 et l’autophosphorylation de AURKA se traduisent par une augmentation substantielle (environ x 450) de l’activité kinase par rapport à l’état totalement réprimé [
14
]. Au niveau des microtubules du fuseau mitotique, la phosphatase PP6 (
protein phosphatase 6
) antagonise l’autophosphorylation de AURKA et contribue à contrôler son activité. Seul le fragment Tpx2
1-43
de la protéine Tpx2 est montré sur cette figure.
B.
Pour déclencher l’entrée en mitose, le complexe cycline A-Cdk1 phosphoryle la protéine Bora qui, par les motifs M1, M2 et M3 de sa séquence peptidique, interagit à son tour avec AURKA non phosphorylée. Le groupement phosphate du motif M3 vient se positionner dans la boucle d’activation de AURKA, ce qui permet de stabiliser cette kinase dans une forme active. Ainsi activée, la kinase AURKA peut alors phosphoryler Plk1 et, en cascade, activer le complexe cycline B-Cdk1. Seul le fragment Bora
18-120
de la protéine Bora est montré sur cette figure.
C.
Représentation schématique des protéines Tpx2 et Bora. Les séquences peptidiques de ces protéines présentent des similarités dans leurs motifs M1 et M2 requis pour fixer AURKA.
|
Les résultats de travaux récents montrent comment un autre activateur allostérique, appelé Bora ( Aurora Borealis ) [ 9 ], active AURKA non phosphorylée pour déclencher l’entrée de la cellule en mitose [ 10 ]. Alors que Tpx2 se fixe préférentiellement sur AURKA et l’active lorsqu’elle est phosphorylée sur sa boucle d’activation, Bora active AURKA alors que cette dernière est dans un état non phosphorylé ( Figure 1B ) . Pour cela, la protéine Bora doit elle-même être phosphorylée. Cette fonction de Bora requiert la présence de trois motifs situés dans la partie N-terminale de sa séquence peptidique, qui est la région la plus conservée au cours de l’évolution [ 11 ]. Les deux premiers motifs, appelés M1 et M2, correspondent à deux courtes séquences qui présentent des similarités avec deux motifs du fragment 1-43 de Tpx2 requis pour la liaison à AURKA ( Figure 1C ) . Le troisième motif (M3) correspond à un site de phosphorylation par les complexes cycline-Cdk (motif Pro-Ser 112 -Pro). Ainsi, lorsque la protéine Bora est phosphorylée, elle interagit avec AURKA et apporte « en trans » un groupement phosphate dans la boucle d’activation de AURKA, qui va compenser l’absence de phosphorylation de cette boucle par autophosphorylation, et ainsi activer la kinase ( Figure 1B ) . Ces travaux illustrent comment une kinase supposée inactive car non phosphorylée sur sa boucle d’activation peut être activée par un cofacteur apportant en trans le groupement phosphate manquant, un mécanisme d’activation inédit pour une kinase [ 5 , 10 ].
Quelle est la pertinence biologique de ces observations ? Lors de son expression en phase G2 du cycle cellulaire, AURKA est maintenue dans un état déphosphorylé, donc inactif, par les phosphatases. La protéine Bora phosphorylée, en se fixant à AURKA, va apporter en trans le groupement phosphate essentiel à l’activation de AURKA, qui va alors promouvoir la phosphorylation et l’activation de Plk1 puis, en cascade, celles de la cycline B-Cdk1, permettant ainsi l’entrée de la cellule en mitose ( Figure 1B ) .
Les complexes cycline A-Cdk1, actifs lors de la transition entre phase S et phase G2 du cycle mitotique, sont responsables de la phosphorylation de la protéine Bora [ 12 ]. Ainsi, Bora agit comme une molécule de signalisation qui couple l’activité des complexes cycline A-Cdk1 à l’activation des kinases mitotiques. Ce mécanisme permet de coordonner les phases S, G2 et l’entrée en mitose. Il reste maintenant à comprendre comment la protéine Bora phosphorylée peut s’accumuler dans une phase du cycle cellulaire où l’activité phosphatase prédomine. Il est possible qu’elle soit protégée de l’action des phosphatases par un mécanisme qui reste à découvrir.
La mise en évidence de différents mécanismes d’activation de la protéine kinase AURKA dans le temps et dans l’espace [ 10 ], ouvre un nouveau champ de recherche dans le développement de stratégies anticancéreuses ciblées pour inactiver certaines fonctions de AURKA. Une surexpression de AURKA, de Plk1, mais également de Bora, est observée dans de nombreux cancers, et est associée à un pronostic défavorable [ 13 ]. Comprendre le mécanisme d’activation de ces kinases revêt donc une importance particulière pour développer des stratégies thérapeutiques innovantes.