Les virus appartenant à la famille des Paramyxoviridae , des virus enveloppés à ARN de polarité négative, sont responsables de nombreuses maladies infectieuses humaines ou animales. Deux d’entre eux, le virus de la rougeole et le virus émergent Nipah 1 , partagent de nombreuses caractéristiques immuno-pathogéniques : ils ont la capacité d’être aéroportés, induisent des symptômes pseudo-grippaux suivis de cytopénies sévères chez les sujets infectés, et peuvent provoquer des syndromes respiratoires sévères ou des atteintes nerveuses irréversibles. Malgré le vaccin disponible contre le virus de la rougeole, qui a quasiment permis l’éradication de cette maladie dans les pays développés, une baisse de la couverture vaccinale et une hausse du nombre de malades et de décès à travers le monde, à cause de la rougeole, ont été constatées au cours de la dernière décennie [ 1 ]. Il n’existe, en revanche, ni traitement curatif, ni vaccin contre l’infection par le virus Nipah permettant de contrôler ses résurgences annuelles [ 2 ]. Le très fort taux de létalité de l’infection par ce virus (entre 40 et 100 % des individus infectés) et son fort potentiel bio-terroriste l’ont placé sur la liste Blueprint de l’Organisation mondiale de la santé (OMS) parmi les neuf microorganismes pathogènes à étudier en priorité [ 3 ].
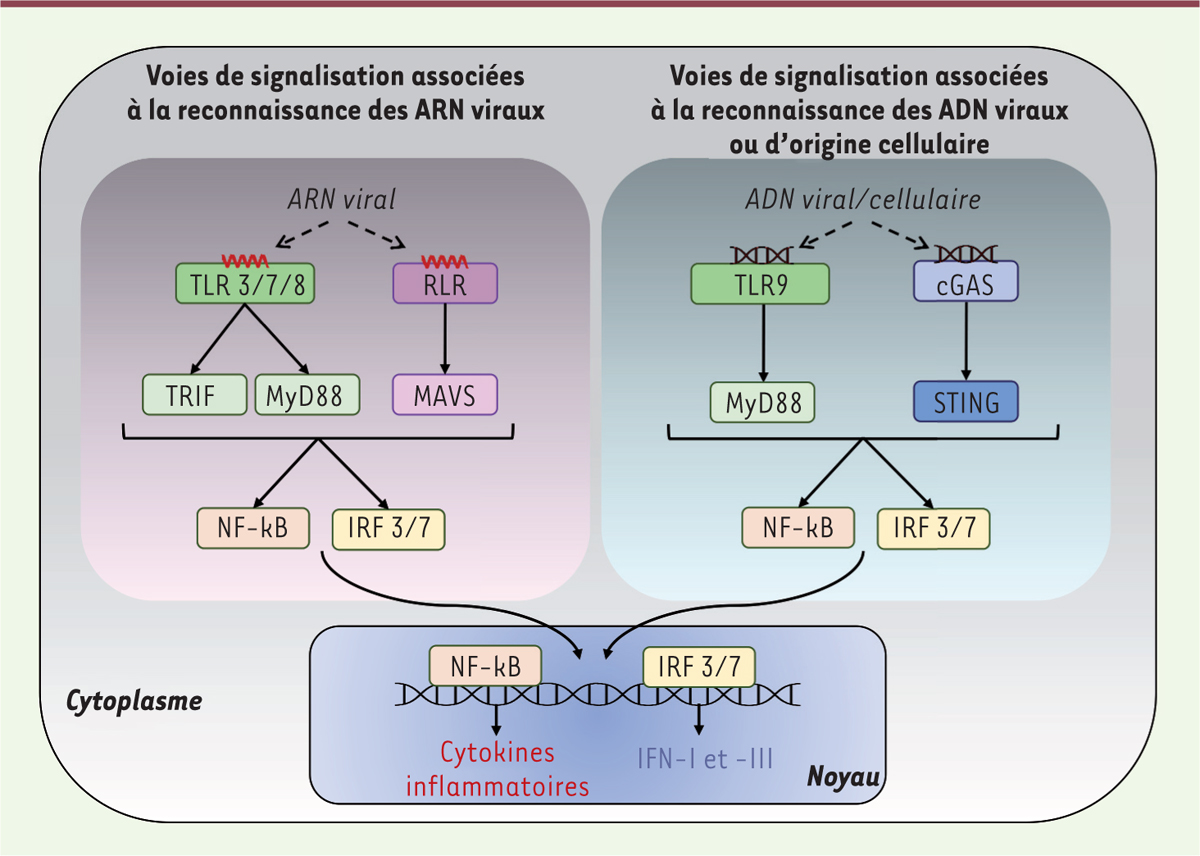
L’immunité innée représente la première ligne de défense contre les infections microbiennes. Elle opère par reconnaissance d’éléments exogènes (dits du « non-soi »), qu’il s’agisse d’acides nucléiques ou d’autres motifs protéiques associés à ces microorganismes [ 4 ]. Les cellules de l’immunité innée expriment, à leur surface et dans leur cytoplasme, des PRR ( pattern recognition receptors ) agissant comme des sentinelles les protégeant de dangers extérieurs. Le système immunitaire inné reconnaît ainsi l’ARN ou l’ADN constitutifs des génomes viraux, grâce, principalement, aux récepteurs TLR ( Toll-like receptors ), RIG-I ( retinoic-acid inducible gene I - like receptors , RLR), et à la protéine enzymatique cGAS ( cGMP-AMP synthase ) [ 4 ] ( Figure 1 ) . Chacune de ces « plateformes » de signalisation active une molécule adaptatrice spécifique qui lui est associée, MyD88 ( myeloid differentiation primary response 88 ) et TRIF ( toll-interleukin-1 receptor [TIR] -domain-containing adapter-inducing interferon-β ) pour les TLR, MAVS ( mitochondrial antiviral-signaling protein ), associée aux RLR, et STING ( stimulator of interferon genes ), connectée à cGAS [ 4 ]. Chaque voie de signalisation ainsi activée à la suite de la reconnaissance de matériel viral aboutit à la production des interférons de type I (IFN-I) et III (IFN-III) et de cytokines pro-inflammatoires [ 4 ] ( Figure 1 ) .
| Figure 1.
Schéma des voies de signalisation impliquées dans le contrôle des ARN et des ADN pathogéniques.
L’immunité innée peut être déclenchée par deux mécanismes distincts : grâce à la reconnaissance d’acides nucléiques exogènes d’origine microbienne, ou par l’intermédiaire d’ADN cellulaire, d’origine nucléaire ou mitochondriale, libéré dans le cytoplasme. Chaque type d’acides nucléiques est reconnu par des protéines cellulaires spécifiques, qui sont associées à différentes voies de signalisation. Les ARN viraux sont principalement reconnus par deux familles de senseurs cytoplasmiques : les TLR (
Toll-like receptors
) et les
RIG-I
([
retinoic-acid inducible gene I
-
like receptors
], RLR). Le TLR3 se lie aux ARN viraux double-brin, et TLR7 ou TLR8 aux ARN viraux simple-brin, et activent les molécules adaptatrices qui leur sont associées, TRIF et MyD88. Parmi les RLR, RIG-I et MDA-5 reconnaissent les ARN viraux double-brin ou simple-brin, avant d’activer la molécule adaptatrice MAVS. La reconnaissance des ADN viraux ou d’origine cellulaire implique les senseurs TLR9 et cGAS (
cyclic GMP-AMP synthase
), qui activent ensuite la molécule adaptatrice qui leur est associée, respectivement, MyD88 et STING (
stimulator of interferon genes
). Toutes ces voies de signalisation aboutissent à l’activation des facteurs de transcriptions IRF3/7 et NF-κB, permettant la production des interférons IFN-I et IFN-III et celle de cytokines inflammatoires.
|
La majorité des virus à ARN se répliquent dans le cytoplasme des cellules qu’ils infectent. Ils n’intègrent pas leur génome dans celui des cellules, et sont vulnérables aux défenses antivirales de l’hôte. Malgré le développement de mécanismes d’échappement immunitaire réduisant la réponse antivirale, le virus de la rougeole et le virus Nipah peuvent être contrôlés et éliminés par certains hôtes. Le matériel génétique des paramyxovirus est reconnu dans le cytoplasme des cellules infectées par différentes molécules : RIG-I, capable de reconnaître les ARN viraux triphosphates sans coiffe ; MDA-5 ( melanoma differentiation-associated protein 5 ), qui reconnaît les ARN double-brin ; les TLR : TLR3 pour les ARN double-brin, ou, principalement, TLR7 et TLR8 qui, lorsque ils sont exprimés dans les endosomes, reconnaissent directement l’ARN viral simple brin [ 5 ] ( Figure 1 ) . Nos travaux récents ont montré le rôle majeur de l’immunité innée et des IFN-I dans le contrôle de l’infection par le virus Nipah : des souris rendues génétiquement déficientes en IFNAR ( interferon- α/β receptor ) succombent à l’infection, tandis que les souris « sauvages » y résistent [ 6 ]. L’analyse de souris rendues génétiquement déficientes pour chacune des molécules adaptatrices impliquées dans les plateformes de signalisation, a permis de montrer que MyD88 et MAVS, agissant respectivement en aval de TLR7 et des RLR, sont primordiales pour la forte production d’IFN-I contre le virus Nipah [ 6 ]. Néanmoins, cette étude a révélé que les senseurs spécialisés dans la reconnaissance des ARN viraux ne sont pas suffisants pour contrôler l’infection par ces paramyxovirus. L’hypothèse que nous avons formulée, est que la voie de signalisation cGAS/STING était également activée lors de l’infection par le virus de la rougeole ou par le virus Nipah et qu’elle jouerait un rôle primordial dans la défense contre ces infections.
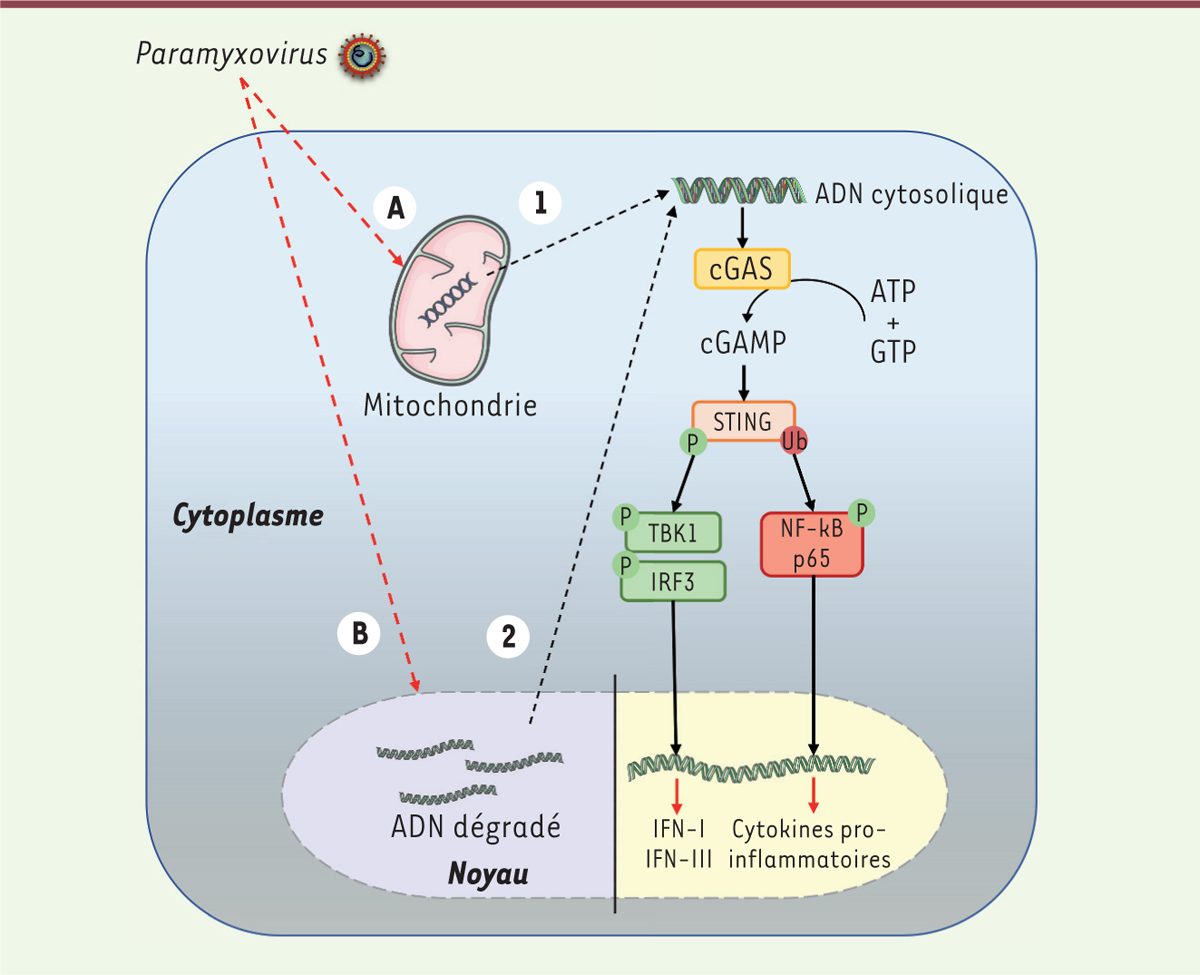
L’implication de la signalisation par cGAS/STING dans la défense contre les virus à ADN est bien établie, mais son rôle dans la défense contre les virus à ARN reste inconnue ( Figure 2 ) . Au cours d’une infection par un virus à ADN, le senseur cGAS reconnaît en effet l’ADN viral dans le cytoplasme de la cellule hôte, ce qui entraîne l’activation rapide (quatre à six heures après l’infection) de la molécule adaptatrice STING, aboutissant à celle des facteurs de transcription IRF3/7 ( interferon regulatory factor 3/7 ) et NF-κB ( nuclear factor-kappa B ) (Figures 1 et 2) . En dépit de la capacité de certains virus à ARN à inhiber la voie de signalisation impliquant cGAS/STING, aucune étude n’a montré le rôle direct d’un ARN viral dans la mise en place de cette réponse. Des résultats récents de plusieurs travaux de recherche impliquant des virus à ARN, tels que le virus du chikungunya ou celui de la dengue, ont cependant établi la nécessité de l’engagement de STING à la suite de l’infection des cellules par ces virus [ 7 ]. On ne pouvait donc pas exclure l’existence d’une stimulation indirecte, indépendante de l’ARN viral, de cette voie de signalisation par des paramyxovirus. Nous avons mis en évidence l’activation déterminante de la signalisation impliquant cGAS/STING dans le contrôle des infections par le virus de la rougeole ou par le virus Nipah [ 8 ]. En effet, les premières expériences menées in vivo chez des souris mutantes, dépourvues d’expression de MyD88/TRIF/MAVS, comparées à des souris mutantes dépourvues de l’expression de MyD88/TRIF/MAVS/STING ont validé l’importance de la protéine STING dans la survie des animaux infectés par le virus Nipah [ 8 ]. Les rôles protecteurs singuliers de cGAS et de STING contre le virus de la rougeole et le virus Nipah ont ensuite été confirmés par des expériences réalisées en utilisant des fibroblastes primaires MEF ( murine embryonic fibroblasts ) isolés des souris. Ils ont ensuite été confirmés en utilisant des cellules d’une lignée monocytaire humaine (THP-1) rendues génétiquement déficientes en cGAS ou en STING, ou traitées avec des inhibiteurs spécifiques de STING (H151) ou de cGAS (RU.521) [ 8 ]. Les analyses qualitatives et quantitatives, par microscopie en fluorescence et par cytométrie en flux, ont montré, dans ces conditions, une augmentation de l’infection par ces deux paramyxovirus dans les cultures de cellules où l’une ou l’autre des protéines cGAS ou STING était absente ou inactive. Ce résultat a été corroboré par une analyse moléculaire révélant des quantités accrues d’ARN viral dans les cellules où cGAS ou STING avait été inactivée, ainsi que dans leur milieu de culture, associées à une diminution des transcrits des gènes codant IFN-α et IFN-β [ 8 ].
| Figure 2.
Schéma de l’activation de la voie cGAS/STING lors d’une infection par un paramyxovirus.
L’activation de la voie cGAS/STING constitue un mécanisme de défense plus tardif contre une infection de la cellule par un paramyxovirus (virus à ARN), survenant 24 à 48 heures après l’infection. Dans le cas d’une infection par le virus de la rougeole ou par le virus Nipah, deux mécanismes distincts sont envisagés :
(A)
les mitochondries peuvent subir une perte de perméabilité membranaire et libérer leur ADN dans le cytoplasme
(1)
, qui sera ensuite reconnu par la protéine enzymatique GMP-AMP cyclique synthase (cGAS) ;
(B)
l’ADN nucléaire est endommagé en conséquence de l’infection par le paramyxovirus, et libéré dans le cytoplasme
(2)
, avant d’être reconnu par cGAS. Une fois activée, l’enzyme cGAS utilise l’adénosine triphosphate (ATP) et la guanosine triphosphate (GTP) comme substrats pour produire le dinucléotide cyclique cGAMP (
cyclic GMP-AMP
). Ce dernier se lie à la protéine STING (
stimulator of interferon genes
), contribue à sa translocation du réticulum endoplasmique vers l’appareil de Golgi, et favorise son activation par des modifications post-traductionnelles par phosphorylation (p) ou ubiquitination (ub). Ces formes modifiées de STING aboutissent principalement à l’activation des facteurs de transcription IRF3 ou NF-κB, respectivement, permettant la synthèse des interférons IFN-I et IFN-III et de cytokines inflammatoires.
|
La diminution des défenses immunitaires contre des paramyxovirus après la suppression préalable des protéines cGAS et STING dans les cellules infectées suggère ainsi que STING est activée à la suite de l’infection. Cette activation de STING se caractérise par la présence de modifications post-traductionnelles spécifiques, telles que des phosphorylations et des ubiquitinations, majoritairement associées aux activations de IRF3 [ 9 ] et de NF-κB [ 10 ] et à la mise en place, respectivement, de réponses IFN-I et inflammatoire ( Figure 2 ) [ 9 , 10 ]. Nos analyses ont concerné des MEF, des cellules THP-1 et des cellules représentatives du tissu endothélial pulmonaire, les cellules HPMEC ( human pulmonary microvascular endothelial cells ), cibles primaires des paramyxovirus [ 8 ]. Les analyses cinétiques de l’infection que nous avons ensuite réalisées ont révélé, 24 heures à 48 heures après l’infection par le virus de la rougeole ou par le virus Nipah, la présence de STING sous sa forme phosphorylée sur le résidu sérine en position 365 (STING-S365 P ) dans les MEF, et en position 366 (STING-S366 P ) dans les cellules THP-1 et les cellules HPMEC, une caractéristique de l’état d’activation de la protéine. L’absence de STING-S366 P dans les cellules THP-1 génétiquement déficientes en cGAS ou traitées avec le RU.521 (un inhibiteur spécifique de cGAS) a permis de déterminer l’importance de cGAS dans l’activation de STING. Surtout, l’analyse des MEF a montré que l’activation de la voie cGAS/STING était indépendante des autres senseurs : les cellules génétiquement déficientes pour MyD88/TRIF/MAVS, qui expriment seulement STING, ont des taux de STING-S365 P équivalents aux cellules témoins, après une infection par le virus Nipah pendant 48 heures. L’ubiquitination de STING a également été évaluée dans des cellules HPMEC, plus particulièrement sa forme polyubiquitinylée-K63 (Ub-K63) connue comme favorisant l’activation de la voie NF-κB [ 10 ]. Et nous avons montré que STING était également activée par polyubiquitination à la suite d’une infection de ces cellules par le virus de la rougeole ou par le virus Nipah [ 8 ].
Ces résultats permettent d’affirmer que la voie cGAS/STING est activée et protectrice lors d’une infection par des paramyxovirus. Ils révèlent, pour la première fois, des profils de réponses innée et inflammatoire qui dépendent de STING, à travers, respectivement, ses formes activées S366 P et Ub-K63, lors d’une infection par le virus de la rougeole ou par le virus Nipah ( Figure 2 ) . D’autres travaux sont désormais nécessaires afin d’approfondir notre compréhension des mécanismes cellulaires impliqués dans ces processus. Ils devraient permettre d’identifier de nouvelles modifications post-traductionnelles associées à STING, de déterminer l’impact de l’infection de la cellule par le virus de la rougeole ou par le virus Nipah sur les membranes mitochondriale ( Figure 2A ) et nucléaire ( Figure 2B ) , et de caractériser la source, possiblement mitochondriale ( Figure 2 , voie 1) ou nucléaire ( Figure 2 , voie 2) , de l’agoniste cellulaire responsable de l’activation de la voie cGAS/STING.