| |
| Med Sci (Paris). 38(3): 324–326. doi: 10.1051/medsci/2022021.L’apéline, un nouvel espoir thérapeutique dans les maladies cardiovasculaires Sambre Mach,1a Nour Elhouda Bouddiaf,1b and Philippe Robin2c 1Master Biologie Santé, Université Paris-Saclay
,
France 2Université Paris-Saclay, Institut des sciences du vivant Frédéric Joliot, CEA Saclay
,
91190Gif-sur-Yvette
,
France MeSH keywords: Apeline, Récepteur de l'apeline, Maladies cardiovasculaires, Humains, usage thérapeutique, traitement médicamenteux |
L’anévrisme aortique abdominal (AAA) est une maladie cardiovasculaire caractérisée par une dilatation anormale de l’aorte abdominale qui, lorsqu’elle est trop importante, conduit à une rupture tissulaire. Souvent accompagnée d’une hypertension artérielle, la rupture de l’aorte provoque une hémorragie interne conduisant à la mort du patient. Aujourd’hui, l’AAA est difficilement détectable et il n’existe pas de traitement efficace pour lutter contre la maladie à l’exception d’une opération chirurgicale dans les cas les plus sévères. Ainsi, l’AAA constitue un problème majeur de santé publique avec un taux de mortalité élevé.
Le système rénine-angiotensine (RAS) est l’un des acteurs impliqués dans le développement de l’AAA. Il participe à la régulation de la pression artérielle et au remodelage tissulaire dans le système cardiovasculaire en agissant sur les cellules musculaires lisses vasculaires [
1
] (
→
).
(→) Voir la Synthèse de J.B. Michel,
m/s
n° 4, avril 2004, page 409
L’acteur principal du RAS est l’angiotensine II (AngII), un peptide de huit acides aminés, issu de la coupure protéolytique de l’angiotensinogène par la rénine puis par l’ACE (
angiotensin-converting enzyme)
1. L’AngII peut être hydrolysée en angiotensine 1-7 (Ang1-7) par l’enzyme ACE2. Alors que l’AngII a un effet vasoconstricteur, l’Ang1-7 a un effet vasodilatateur [
2
]. Une dérégulation du système RAS conduisant à une augmentation de l’AngII favorise le développement d’AAA
(
Figure 1
)
. Il a été montré que l’apéline (APLN) et son récepteur jouaient un rôle bénéfique dans différentes maladies cardiovasculaires [
3
,
4
]. Le précurseur de l’apéline génère plusieurs peptides, dont l’APLN-17, le plus actif, qui agit sur le récepteur APJ (ou AGTRL1,
angiotensin II receptor-like 1
), un récepteur à 7 segments transmembranaires couplé aux protéines G [
5
]. Dans une étude récente publiée dans la revue
PNAS
, Wang et ses collaborateurs se sont intéressés au rôle de l’apéline dans l’évolution de l’AAA et ont mis en évidence son action bénéfique [
6
].
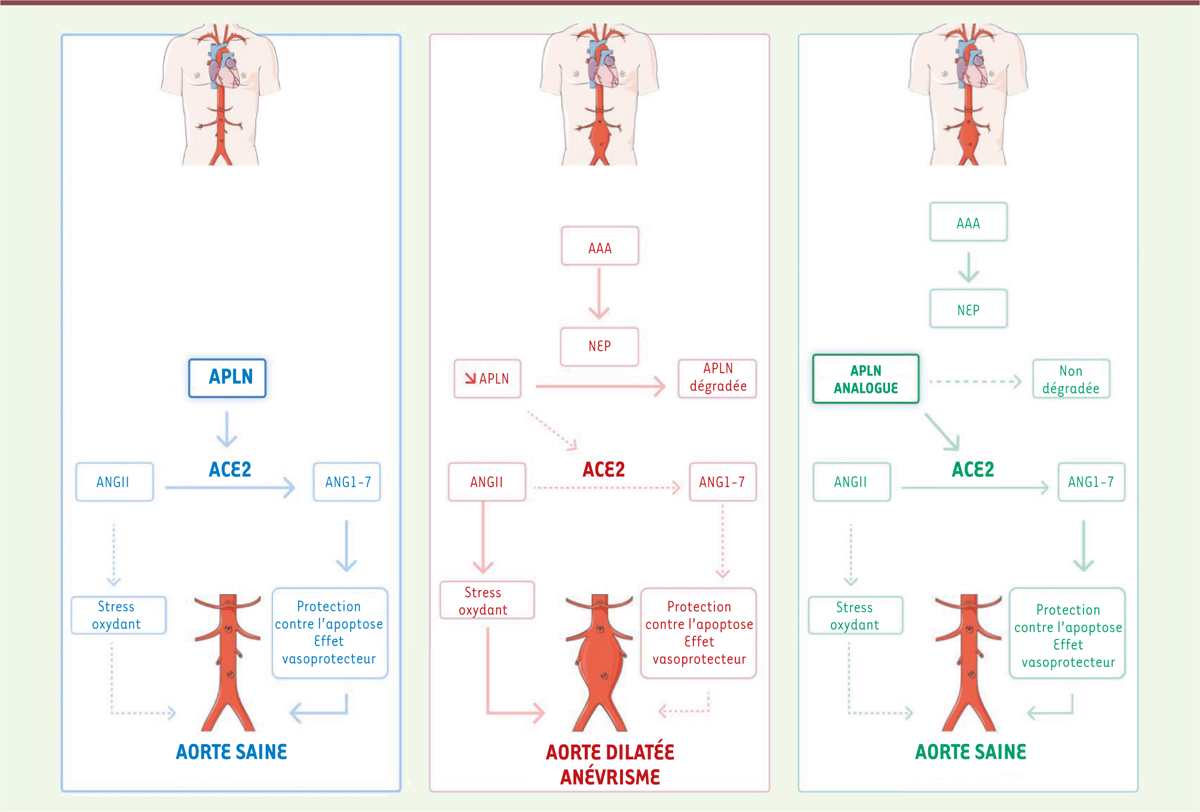
 | Figure 1.
Rôle de l’apéline et du système rénine angiotensine dans le développement de l’anévrisme aortique abdominal (AAA) et effet d’un analogue stable de l’apéline-17.
À gauche :
dans les conditions physiologiques, l’apéline-17 (APLN-17) régule positivement l’expression de l’ACE2 (
angiotensin-converting enzyme 2
), ce qui permet la conversion de l’angiotensine II (AngII) aux effets délétères en angiotensine 1-7 (Ang1-7) qui a un rôle protecteur sur les vaisseaux.
Au centre :
en situation pathologique d’AAA, la NEP (
neutral endopeptidase
) est surexprimée et dégrade l’APLN-17. Ainsi l’expression de l’ACE2 est réduite et ne peut plus convertir l’AngII en Ang1-7 aussi efficacement et les effets néfastes de l’AngII sur l’aorte deviennent prépondérants.
À droite :
Lorsque l’AAA est traité par l’analogue stable de l’APLN-17, celui-ci reproduit tous les effets de l’APLN-17 naturelle mais n’est pas dégradé par la NEP. Les effets bénéfiques de l’Ang1-7 sont augmentés et les effets néfastes de l’AngII sont réduits, favorisant ainsi un recul de la maladie et un retour à une situation physiologique.
|
|
Mise en évidence du rôle d’apéline dans l’AAA
Afin d’étudier le rôle de l’apéline (APLN) dans l’AAA, les chercheurs ont réalisé des analyses immunohistochimiques sur des segments d’aortes sains (NDA pour
nondiseased aorta
) ou présentant des lésions de type AAA. Dans ces derniers, ils ont observé une perturbation de l’homéostasie cellulaire au niveau de l’aorte abdominale, caractérisée par une fragmentation des fibres d’élastine, réduisant la résistance de la paroi de l’aorte et induisant la mort par apoptose des cellules musculaires lisses vasculaires. Les auteurs ont également noté une augmentation de l’APLN au niveau des anévrismes. Chez l’animal, l’injection répétée d’AngII chez des souris transgéniques dont le gène de l’APLN a été invalidé (souris KO pour l’APLN) provoque le développement de nombreux AAA sévères, caractérisés par une dilatation locale de l’aorte et par l’affaiblissement de sa paroi, allant jusqu’à provoquer la mort de certains animaux suite à une rupture aortique. Le même traitement appliqué à des souris normales entraîne une surexpression de l’APLN et des effets aortiques réduits (dilatation plus faible et moindre affaiblissement de la paroi vasculaire). Ainsi, l’APLN aurait un rôle protecteur, s’opposant aux effets néfastes de l’AngII, limitant le développement et la sévérité des AAA induits par l’AngII.
|
Mécanismes d’action de l’apéline
Les mécanismes à l’origine du développement de l’AAA, chez les souris dont le gène codant l’APLN a été invalidé, ont été mis en évidence par des expériences d’immunohistochimie. Les auteurs ont observé une forte vasoconstriction des vaisseaux, associée à un stress oxydant lié à une forte production de FAO (formes actives de l’oxygène), inducteurs connus du processus d’apoptose. La caspase 3, une protéase également impliquée dans l’apoptose, est plus fortement exprimée au niveau des lésions. Ces résultats suggèrent que l’APLN limite la progression des AAA et que son absence favorise le développement de la maladie. Afin d’étudier l’existence d’un lien éventuel entre l’APLN et l’ACE2, l’enzyme qui réduit l’effet de l’AngII en la transformant en Ang1-7, les auteurs ont inhibé l’expression de l’APLN par une technique d’interférence ARN dans des cellules musculaires aortiques murines et humaines. Dans les cellules témoins où l’APLN est exprimée, l’AngII induit une surexpression d’ACE2 (augmentation de l’ARN messager) contrairement aux cellules où l’expression de l’APLN est inhibée. Ces résultats suggèrent donc que l’APLN régule positivement l’expression d’ACE2. Ainsi, l’APLN permettrait de limiter les effets vasoconstricteurs d’AngII
via
la surexpression d’ACE2 qui dégraderait l’AngII en Ang1-7 vasodilatatrice, ce qui limiterait le développement des anévrismes aortiques abdominaut (AAA).
|
L’apéline comme cible thérapeutique Mécanismes de régulation de l’apéline
Dans la perspective de développer un traitement thérapeutique, il est important de comprendre les mécanismes de régulation
in vivo
de l’APLN. L’équipe de Wang
et al
s’est intéressée au rôle d’une protéase, la NEP (
neutral endopeptidase
), potentiellement impliquée dans la dégradation de l’APLN. Les auteurs ont montré une surexpression de la NEP, chez la souris et chez l’homme, dans les aortes présentant un AAA. En se fondant sur des modélisations de la structure de la NEP et de l’APLN-17, les chercheurs ont émis l’hypothèse que l’APLN-17 (le principal peptide impliqué dans l’AAA) pouvait se lier au site catalytique de la NEP qui dégraderait le peptide pour l’inactiver, réduisant ainsi son effet protecteur contre les AAA. Cette hypothèse a été validée par des expériences
in vivo
utilisant un inhibiteur de NEP. Ces résultats constituent un premier pas vers le développement d’un traitement thérapeutique à base d’analogue de l’APLN résistant à la NEP.
Développement d’un analogue de l’apéline comme traitement contre les AAA
Les chercheurs ont effectivement alors conçu un analogue de l’APLN (APLN-NMeLeu9A2) dont certains acides aminés ont été modifiés, le rendant résistant à la dégradation par la NEP. Avant de vérifier l’efficacité de cet analogue sur l’AAA, ils se sont assurés que celui-ci possédait des propriétés pharmacologiques comparables à l’APLN native : fixation sur le récepteur APJ avec une affinité comparable à l’APLN, et activation des acteurs de sa voie de signalisation, la protéine Gi et la β-arrestine, avec les mêmes propriétés et la même efficacité [
9
]. Pour tester l’effet
in vivo
de cet analogue, Wang
et al.
ont utilisé un modèle murin dans lequel l’induction d’AAA par l’AngII est bien caractérisée. Le traitement prolongé de ces souris par l’AngII conduit en effet à une mort de près de 50 % des animaux par rupture aortique. Par contre, le traitement conjoint par l’AngII et l’analogue de l’APLN ne provoque la mort d’aucune souris et l’aorte de celles-ci présente des caractéristiques proches de celle des souris non traitées par l’AngII. Ces résultats suggèrent que l’analogue de l’APLN, résistant à la NEP, pourrait être efficace pour lutter contre l’AAA. Les auteurs ont également montré que l’analogue pouvait réguler positivement l’expression d’ACE2, comme le fait l’APLN, ce qui réduirait d’autant plus l’effet néfaste de l’AngII.
Ainsi, le couple APLN-APJ aurait un rôle bénéfique dans la maladie en limitant le développement d’AAA (induit par une dérégulation du RAS) mais ce rôle serait limité par l’action de la NEP. L’analogue stable de l’APLN résistant à la NEP développé dans cette étude conduit les auteurs à proposer un rôle thérapeutique pour cet analogue non seulement comme traitement contre le développement d’un AAA mais aussi pour le traitement d’autres maladies vasculaires, telles que l’hypertension artérielle pulmonaire, ou pour le traitement des maladies associées à l’obésité [
10
].
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Michel
JB
.
Système rénine-angiotensine et remodelage vasculaire.
.
Med Sci (Paris).
2004;
;
20
:
:409.
–
413
.
2.
Patel
VB
,
Zhong
JC
,
Grant
MB
,
Oudit
GY
.
Role of the ACE2/Angiotensin 1–7 axis of the Renin-Angiotensin System in Heart Failure.
.
Circ res.
2016;
;
118
:
:1313.
–
1326
.
3.
Wang
W
,
McKinnie
SM
,
Patel
VB
et al.
Loss of Apelin exacerbates myocardial infarction adverse remodeling and ischemia-reperfusion injury: therapeutic potential of synthetic Apelin analogues.
.
J Am Heart Assoc.
2013;
;
2
:
:e000249.
.
4.
Brash
L
,
Barnes
GD
,
Brewis
MJ
et al.
Short-Term Hemodynamic Effects of Apelin in Patients With Pulmonary Arterial Hypertension.
.
JACC Basic to Transl Sci.
2018;
;
3
:
:176.
–
186
.
5.
Yang
Y
,
Lv
SY
,
Ye
W
,
Zhang
L
.
Apelin/APJ system and cancer.
.
Clin Chim Acta.
2016;
;
457
:
:112.
–
116
.
6.
Wang
W
,
Shen
M
,
Fischer
C
et al.
Apelin protects against abdominal aortic aneurysm and the therapeutic role of neutral endopeptidase resistant apelin analogs.
.
Proc Natl Acad Sci U S A.
2019;
;
116
:
:13006.
–
13015
.
7.
Cassis
LA
,
Gupte
M
,
Thayer
S
et al.
ANG II infusion promotes abdominal aortic aneurysms independent of increased blood pressure in hypercholesterolemic mice.
.
Am J Physiol Heart Circ Physiol.
2019;
;
296
:
:H1660.
–
H1665
.
8.
Yue
J
,
Yin
L
,
Shen
J
,
Liu
ZA
.
Modified Murine Abdominal Aortic Aneurysm Rupture Model Using Elastase Perfusion and Angiotensin II Infusion.
.
Ann Vasc Surg.
.
2020;
;
67
:
:474.
–
81
.
9.
Scimia
MC
,
Hurtado
C
,
Ray
S
,
et al.
APJ acts as a dual receptor in cardiac hypertrophy.
.
Nature.
2020;
;
488
:
:394.
–
8
.
10.
Mughal
A
,
O’Rourke
ST
.
Vascular effects of apelin : Mechanisms and therapeutic potential.
.
Pharmacol Ther.
2018;
;
190
:
:139.
–
147
.
|