| |
| Med Sci (Paris). 38(3): 263–273. doi: 10.1051/medsci/2022028.Génétique de l’hypothyroïdie congénitale Athanasia Stoupa,1,2,3,4 Dulanjalee Kariyawasam,1,2,3,4 Michel Polak,1,2,3,4,5 and Aurore Carré2,3* 1Service d’endocrinologie, gynécologie et diabétologie pédiatriques, Centre régional de dépistage néonatal (CRDN) Île-de-France, Hôpital universitaire Necker-Enfants-malades, AP-HPParis
,
France 2Affilié Institut IMAGINE, Inserm U1163
,
Paris
,
France 3Inserm U1016, Institut Cochin
,
Paris
,
France 4Centre des maladies endocriniennes rares de la croissance et du développement
,
Paris
,
France 5Université de Paris
,
Paris
,
France |
Vignette (© Aurore Carré).
Les hormones thyroïdiennes (HT), produites par la glande thyroïde, sont indispensables au développement, à la croissance et au métabolisme de pratiquement tous les tissus humains. La production d’HT (thyroxine ou T4 et triiodothyronine ou T3) est régulée par l’axe hypothalamo-hypophysaire-thyroïdien. De faibles taux d’HT sériques entraînent une augmentation de la libération de la TSH (
thyroid-stimulating hormone
) par l’hypophyse, sous l’influence de la TRH (
thyrotropin-releasing hormone
) libérée par l’hypothalamus. La TSH, un régulateur clé de la fonction thyroïdienne, stimule la synthèse et la sécrétion des HT par la thyroïde. Un déficit en HT à la naissance, l’hypothyroïdie congénitale (HC), entraîne un retard sévère de la croissance et du développement neuropsychomoteur en l’absence de traitement substitutif rapidement instauré dès la période néonatale.
L’HC affecte environ un nouveau-né sur 2 500 à 3 000 dans le monde. Depuis la fin des années 1970, cette maladie peut être dépistée systématiquement vers le troisième jour après la naissance par le dosage de la TSH, permettant un traitement par L-thyroxine (L-T4) [
1
] (
→
).
(→) Voir la Synthèse de J. Léger,
m/s
n° 5, mai 2021, page 474
L’HC peut être due à un défaut de développement ou de la fonction de la glande thyroïde (HC primaire/périphérique), à des anomalies de l’axe hypothalamo-hypophysaire (HC centrale), mais aussi à une altération de l’action, du transport ou du métabolisme des HT.
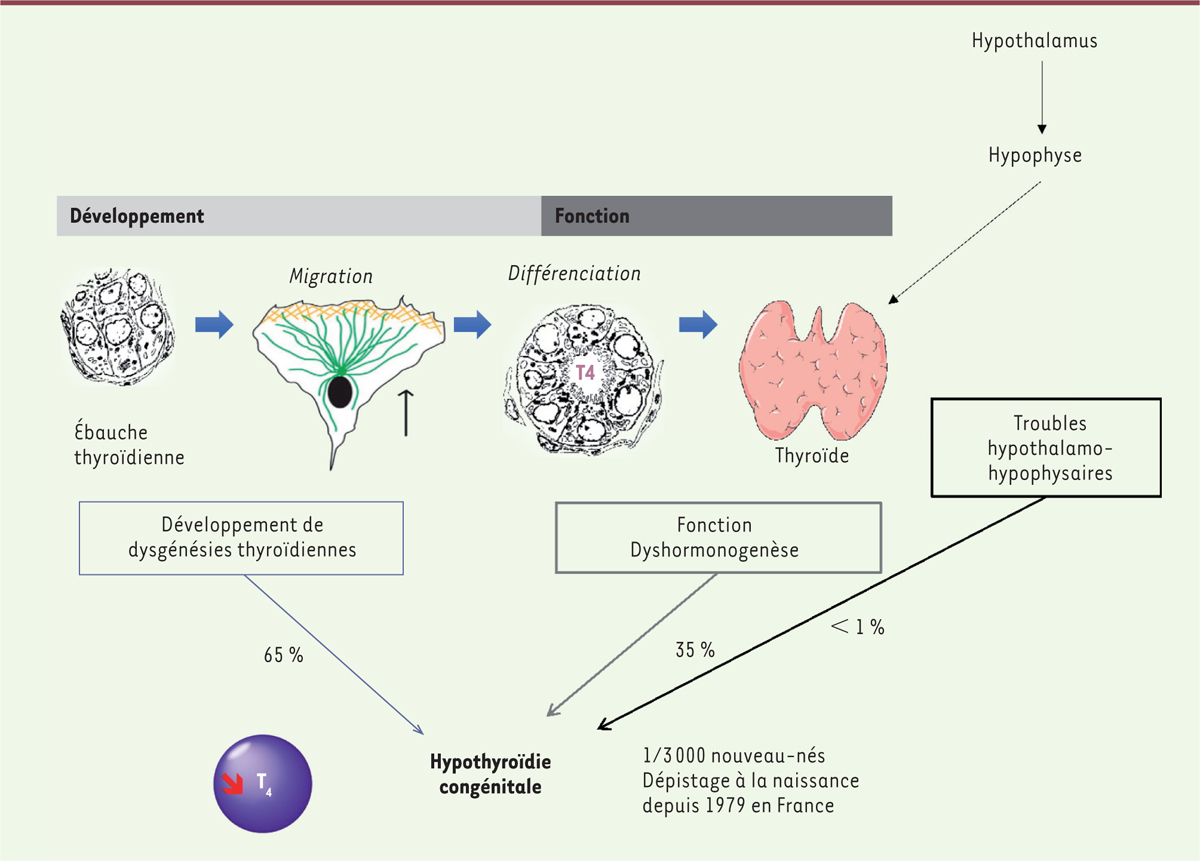
Dans la majorité des cas (65 %), l’HC primaire est due à une anomalie du développement de la glande thyroïde, ou dysgénésie thyroïdienne (HCDT) [
2
]. L’HCDT peut être isolée ou associée à des signes extra-thyroïdiens. Lorsque la glande thyroïde est en place et de taille normale ou hyperplasique (goitre) (35 % des HC), l’hypothyroïdie est alors due à un défaut de synthèse des HT, ou dyshormonogenèse (HCDH) [
3
]
(
Figure 1
)
.
 | Figure 1.
Représentation schématique du développement et de la fonction de la thyroïde et de l’hypothyroïdie congénitale associée.
|
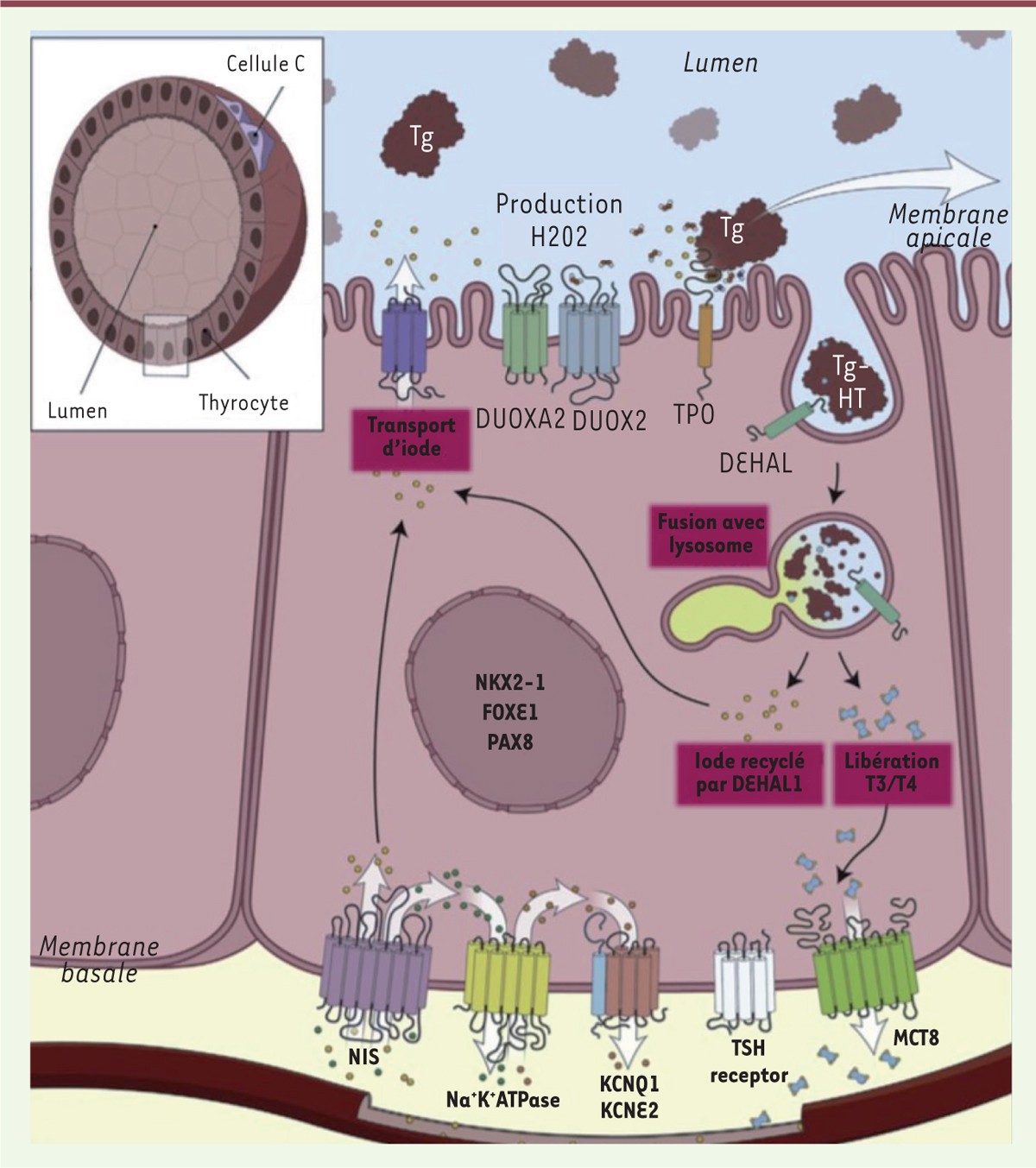
Il existe une corrélation désormais bien établie entre la survenue d’une HC et l’altération du développement de la thyroïde. La thyroïde primitive se développe à partir d’une ébauche médiane qui apparaît vers la troisième semaine de développement (SD) chez l’homme, sous la forme d’un épaississement puis d’une évagination du plancher de l’endoderme de la cavité bucco-pharyngée. Cette ébauche médiane va ensuite migrer et fusionner avec les corps ultimobranchiaux issus du récessus
1
postérieur de la quatrième poche pharyngée (appelé parfois cinquième poche pharyngée), en position pré-trachéale, pour donner la thyroïde primaire dès la septième semaine de développement [
4
]. Les facteurs de transcription Nkx2-1, Foxe1, Pax8, et Hhex sont essentiels pour la spécification de la thyroïde. La migration des progéniteurs cellulaires est une étape cruciale pour le développement de la glande et la fonction thyroïdienne. Après migration et fusion des ébauches, les cellules se différencient majoritairement en cellules folliculaires thyroïdiennes (ou thyrocytes). Les marqueurs de la différenciation terminale de ces cellules sont le récepteur de la TSH (TSHR), le transporteur d’iode (NIS, symporteur
2
d’iode et de sodium codé par le gène
SLC5A5
), la thyroglobuline (TG), la thyroperoxydase (TPO), l’oxydase DUOX2 (
dual oxidase 2
) et son facteur de maturation DUOXA2 (
dual oxidase maturation factor 2
), des acteurs de l’hormonosynthèse
(
Figure 2
)
. L’iode, provenant de la circulation sanguine, entre dans le thyrocyte par le transporteur d’iode NIS. L’iode est ensuite oxydé par la thyroperoxydase (TPO) et le complexe producteur d’H
2
O
2
DUOX2/DUOXA2 puis lié à la TG, protéine matrice des HT (T4 et T3) [
5
]. Des anomalies à l’une des étapes du développement thyroïdien (telle que la spécification, la prolifération, la migration, la croissance, l’organisation, la différenciation et la survie) peuvent entraîner une anomalie congénitale et/ou une altération de l’hormonosynthèse conduisant à des degrés variables d’hypothyroïdie.
 | Figure 2.
Production des hormones thyroïdiennes dans les thyrocytes
(d’après [
5
]).
|
Au cours de ces dernières années, les nouvelles approches génétiques, comme le séquençage haut débit (
next generation sequencing
, NGS) et le séquençage de l’exome entier (
whole exome sequencing
, WES), la description phénotypique détaillée des patients atteints d’HC et/ou des familles, ont ouvert de nouvelles pistes génétiques pour les HC, mais ont aussi permis d’élargir le phénotype thyroïdien associé à certains gènes mutés.
Nous présentons ici l’ensemble des gènes connus et les gènes récemment découverts responsables des HC ainsi que les modes de transmission de cette maladie complexe. |
Gènes récemment découverts impliqués dans les HC primaires La dysgénésie thyroïdienne
Il existe un large spectre de dysgénésies thyroïdiennes (HCDT), allant de l’athyréose (21 % des HC), due à un défaut de survie ou une absence des progéniteurs thyroïdiens, à l’ectopie de la thyroïde (41 % des HC) par défaut de migration des ébauches au cours du développement, en position sublinguale dans la plupart des cas, ou à l’hypoplasie, à l’hémithyroïde/lobe unique (3 % des HC) [
2
].
Une cause génétique est identifiée dans moins de 5 à 10 % des HCDT, comprenant des mutations dans le gène codant le récepteur de la TSH
(TSHR)
et dans des gènes codant des facteurs de transcription impliqués dans le développement de la thyroïde (
NKX2-1/TTF1, PAX8, FOXE1/TTF2, NKX2-5, GLIS3
) [
6
]. En général, le mode de transmission des mutations responsables des HCDT est dominant, sauf pour celles touchant
GLIS3
et
FOXE1
. L’implication de ces gènes, identifiés en fonction du phénotype thyroïdien de modèles animaux transgéniques, a été validée chez l’homme par la recherche de mutations dans des cohortes de patients atteints d’HC associées ou non à des formes syndromiques. Les phénotypes associés aux différents gènes mutés sont décrits dans le
Tableau I
. Les gènes responsables d’HCDT identifiés ces cinq dernières années sont décrits ci-après.
Tableau I.
| Gène (OMIM) |
Phénotype thyroïdien |
Mode de transmission |
Pathologies associées |
|
TSHR
(603372)
|
Résistance complète ou partielle à la TSH : athyréose apparente, glande en place et hypothyroïdie variable |
AD/AR |
|
|
|
NKX2-1
(600635)
|
variable |
AD |
Détresse respiratoire, choréoathétose |
|
|
FOXE1
(602617)
|
Athyréose, hypoplasie sévère |
AR |
Fente palatine, atrésie des choanes, cheveux hérissés |
|
|
PAX8
(167415)
|
variable |
AD |
Défauts du tractus urogénital |
|
|
NKX2-5
(600584)
|
Glande en place, hypothyroïdie variable |
Inconnu |
Malformations cardiaques congénitales |
|
|
GLIS3
(610192)
|
Glande en place |
AR |
Diabète néonatal, reins polykystiques, cholestase |
|
|
JAG1
(601920)
|
Hypoplasie thyroïdienne |
AD |
Malformations cardiaques, cholestase hépatique |
|
|
NTN1
(601614)
|
Ectopie thyroïdienne |
inconnu |
Arthrogrypose |
|
|
BOREALIN
(609977)
|
Ectopie thyroïdienne, hémithyroïde, asymétrie thyroïdienne |
AD/AR |
|
|
|
TUBB1
(612901)
|
Variable
(Principalement ectopie) |
AD |
Macroplaquettes et hyperagrégation des plaquettes |
|
|
TRPC4AP
(60843)
|
Hypoplasie thyroïdienne |
AD |
|
|
|
GBP1
(600411)
|
HCDT (non décrite) |
AD/AR |
|
Gènes associés aux HC primaires avec dysgénésie thyroïdienne.
TSH :
thyroid-stimulating hormone
; AD : autosomique dominant ; AR : autosomique récessif ; HCDT : dysgénésie thyroïdienne.
|
CDCA8/BORÉALINE
Par des études de séquençage de l’exome entier réalisé sur un cas d’HCDT familiale, nous avons montré l’implication du gène
CDCA8/BOREALIN
dans la migration et l’adhérence des thyrocytes, expliquant certains cas d’ectopies thyroïdiennes [
7
]. La boréaline est un composant majeur du CPC (
chromosomal passenger complex
) impliqué dans différentes étapes de la mitose. Des mutations bialléliques du gène
BOREALIN
ont été identifiées dans cette famille consanguine ; deux mutations monoalléliques distinctes ont également été observées dans deux autres familles. Les patients porteurs de ces mutations ont soit une athyréose, soit une ectopie. Certains membres de la famille consanguine avaient une fonction thyroïdienne normale malgré une hémithyroïde, une thyroïde asymétrique ou des nodules. Un des patients présentant une asymétrie des lobes a développé un cancer papillaire de la thyroïde. Il est cependant difficile, à ce jour, d’associer les mutations du gène
BOREALIN
avec les nodules ou le cancer papillaire de la thyroïde. Ces travaux ont par ailleurs permis de révéler l’expression du gène
BOREALIN
dans les thyrocytes de la glande fœtale thyroïdienne humaine avant et après le début de la synthèse des HT (8 et 12 semaines de développement), contrairement à la thyroïde adulte où son expression est très faible. Ils ont également montré l’implication de la boréaline dans le processus de migration et d’adhérence des thyrocytes humains, correspondant aux phénotypes d’ectopie de certains patients. Une autre mutation du gène
CDCA8/BOREALIN
a été décrite depuis (c.585-1G>C) à l’état hétérozygote chez une patiente présentant une HCDT [
8
]. Les quatre mutations décrites jusqu’à présent se localisent dans les exons 6, 7 et 8 et dans l’intron 8, tous situés dans la région du gène qui code une partie de la protéine probablement non essentielle pour la mitose, mais importante pour l’adhérence et la migration des thyrocytes.
NTN1/Nétrine-1
NTN1
code la nétrine-1, une protéine impliquée dans la régulation de divers processus développementaux, comme l’angiogenèse, la migration des cellules non neuronales et la morphogenèse épithéliale [
9
]. Des mutations du gène
NTN1
ont été identifiées chez les patients présentant des mouvements en miroir congénitaux
3
[
10
], et une délétion
de novo
4
du gène a été décrite chez un patient présentant un défaut cardiaque congénital et une HCDT (ectopie) [
11
]. Notons que dans le modèle du poisson zèbre, les embryons dont le gène
ntn1a
a été invalidé ont une morphogenèse anormale de la thyroïde, probablement à cause d’un défaut de développement du réseau vasculaire qui ne permet pas le guidage correct des progéniteurs thyroïdiens
via
les vaisseaux.
JAG1
JAG1
code la protéine Jagged 1, un ligand de la voie Notch. Des mutations hétérozygotes de ce gène ont été décrites dans le syndrome d’Alagille, une maladie multisystémique rare. La voie Notch est impliquée dans le développement de la thyroïde et l’invalidation de
jag1a/b
chez le poisson zèbre entraîne une hypothyroïdie [
12
,
13
]. La fonction thyroïdienne de 21 patients présentant des mutations du gène
JAG1
a été examinée et une analyse génétique a été réalisée dans une cohorte italienne de 100 patients atteints d’HC [
13
]. Une prédominance de l’HC a été observée chez 6 des 21 patients atteints du syndrome d’Alagille, et deux d’entre eux avaient une hypoplasie thyroïdienne. Dans la cohorte italienne, deux variants de
JAG1
à l’état hétérozygote ont été retrouvés chez quatre des 100 patients (trois ayant une HCDT, et deux des malformations cardiaques). Ces données suggèrent un rôle de
JAG1
dans la pathogénie des HCDT, principalement l’hypoplasie thyroïdienne.
TUBB1
Trois mutations dans le gène
TUBB1
qui code la tubuline bêta 1 de classe VI, ont récemment été identifiées chez des patients appartenant à trois familles atteintes de HCDT (principalement des ectopies) associées à une morphologie et une agrégabilité plaquettaires anormales [
14
]. La première mutation a été retrouvée par séquençage d’exome dans une famille consanguine. Les deux autres mutations ont été mises en évidence chez deux patients issus d’une cohorte de 270 patients atteints d’HCDT analysée par un panel de gènes ciblés. Initialement, les mutations de
TUBB1
ont été retrouvées chez des patients présentant une macrothrombocytopénie.
TUBB1
code une protéine de la famille des b-tubulines, qui forment avec les α-tubulines des dimères qui s’assemblent en microtubules, l’une des principales structures du cytosquelette cellulaire. Chacune des trois mutations de
TUBB1
associées à une HCDT sont des mutations perte de fonction : elles entraînent la formation de dimères d’α/b-tubulines non fonctionnels qui ne peuvent s’incorporer dans les microtubules. Ce gène est exprimé dans la thyroïde en développement et dans la thyroïde adulte chez l’homme et la souris. Comme chez les patients dont le gène
TUBB1
est muté, les souris dont le gène
Tubb1
a été invalidé présentent des macroplaquettes et une hypothyroïdie. Chez ces souris, on observe des défauts de prolifération pendant le développement précoce (jour embryonnaire E9.5), une migration altérée à E11.5 et E13.5, et un défaut de sécrétion des HT à E17.5, tous ces mécanismes nécessitant des microtubules fonctionnels. Deux des mutations de
TUBB1
ont été associées chez les patients à une activation plaquettaire basale augmentée et à une hyperagrégation.
TRPC4AP
Une première mutation
de novo
du gène
TRPC4AP
(
transient receptor potential cation channel subfamily C member 4-associated protein
) a été identifiée par séquençage de l’exome d’un enfant atteint d’HCDT [
15
]. Par la suite, le séquençage de gènes ciblés réalisé chez 179 autres patients a permis de révéler quatre variants de
TRPC4AP
. Dans le modèle du xénope (
Xenopus laevis
),
Trpc4ap
est exprimé dans le cerveau, le bourgeon thyroïdien, et le rein pendant le développement. Son invalidation entraîne une hypoplasie de la thyroïde. Le produit du gène
TRPC4AP
interagit avec IKBKG (
inhibitor of nuclear factor kappa B kinase regulatory subunit gamma
, ou NEMO [
NF-kB essential modulator
]) un modulateur de NF-κB (
nuclear factor kappa B
) qui régule les gènes impliqués dans la prolifération et la survie des thyrocytes. NF-κB contrôlerait également l’expression de
NKX2-1, PAX8, TPO, NIS
et
TG
[
16
].
TRPC4AP
serait ainsi un gène candidat impliqué dans les HCDT, mais son rôle spécifique reste à élucider.
GBP1
Par l’analyse de l’exome de 98 patients atteints d’HC, quatre mutations du gène
GBP1
(
guanylate-binding protein 1
) ont été identifiées chez trois d’entre eux : deux présentaient une HCDT, le troisième une glande en place [
17
]. Les mutations ont été trouvées à l’état hétérozygote, et hétérozygote composite pour l’un des patients. Chez les deux patients atteints d’HCDT porteurs d’une mutation de
GBP1
à l’état hétérozygote, un site CpG (cg12054698) du gène s’est révélé être hyperméthylé, comparé à l’ADN de leurs parents euthyroïdiens, présentant le même variant. Le pyroséquençage a confirmé cette hyperméthylation mais sans la distinguer de celle observée chez les parents. L’analyse des tissus thyroïdiens (par immunohistochimie et PCR [
polymerase chain reaction
] quantitative) a montré une corrélation inverse entre le niveau de méthylation du site cg12054698 et l’expression du gène. Des facteurs génétiques mais aussi épigénétiques participeraient donc à la pénétrance des HC chez ces deux patients. Chez le poisson zèbre, l’invalidation du gène
Gbp1
est à l’origine d’une hypoplasie de la thyroïde pendant le développement et d’une hypothyroïdie, associées à une perturbation dans les thyrocytes des complexes d’adhérence, dont les E-cadhérine et la β-caténine, probablement à l’origine du développement anormal de la thyroïde.
Les HC syndromiques en présence d’une HCDT
Les patients atteints d’HC due à une HCDT ou à une glande en place, peuvent présenter des anomalies extra-thyroïdiennes. Les formes les plus courantes d’HC syndromique avec HCDT sont le syndrome de Bamforth-Lazarus
5,
(associé à des mutations de
FOXE1
) et le syndrome cerveau-poumon-thyroïde
6,
(associé à des mutations de
NKX2-1
). La recherche génétique a permis d’identifier de nouvelles mutations associées à ces HC syndromiques de gènes, tels que
TBX1
(dans le syndrome de Di George
7,
),
SALL1
(dans le syndrome de Townes-Brocks
8,
),
URB1
(dans le syndrome de Johanson-Blizzard
9,
),
ELN
et
BAZ1B
(dans le syndrome de Williams-Beuren
10,
),
KMT2D
et
KDM6A
(dans le syndrome de Kabuki
11,
),
KAT6B
(dans le syndrome d’Ohdo
12
) [
18
] et
CDC42
(dans le syndrome Takenouchi-Kosaki
13
) [
19
]. Pour ce dernier, il a d’ailleurs été montré que la constriction apicale lors de la formation de l’ébauche thyroïdienne dépendait de Cdc42 [
20
]. Deux autres gènes,
CDH1
(codant la E-cadhérine) et
CTNND1
(codant la caténine delta 1 ou p120ctn)
14
, ont été retrouvés mutés chez des patients présentant le syndrome de Blépharo-cheilo-dontique selon un mode de transmission dominant. Ce syndrome associe des malformations de la face, dont un ectropion des paupières inférieures, une fente labiale/palatine et une dysplasie ectodermique. D’après les auteurs, les mutations de
CDH1
seraient associées à des manifestations plus sévères. Le spectre des pathologies associées à ce syndrome a été élargi puisque des patients porteurs de mutations de
CDH1
ou de
CTNND1
ont été rapportés avec une HC et une hypoplasie thyroïdienne ou une athyréose [
21
]. Certains patients présentent également une synpolydactylie (doigts collés), une atrésie anale et des défauts du tube neural.
Les nouveau-nés et les enfants en bas-âge atteint du syndrome de Down (ou trisomie 21) présentent souvent une hypothyroïdie infraclinique ou une HC primaire [
22
]. Le dysfonctionnement de la thyroïde dans ce cas demeure mal compris. Les souris transgéniques (
Dyrk1a
+/++
) surexprimant
Dyrk1a
(
dual specificity tyrosine phosphorylation-regulated kinase 1A
), un modèle de la trisomie 21, présentent des troubles neuronaux, synaptiques, d’apprentissage et de mémoire similaires à ceux retrouvés dans le syndrome de Down chez l’homme. Chez la souris,
Dyrk1a
est localisé sur le chromosome 18, qui correspond chez l’homme au chromosome 21. Ces animaux ont un développement et une fonction de la thyroïde anormaux [
23
] avec à E15.5, une thyroïde plus grande et des niveaux de T4 et de TG diminués, ainsi qu’une dérégulation des facteurs de transcription impliqués dans le développement de la glande, menant
in fine
à des anomalies de sa morphologie et de fonction. En effet, les thyroïdes des souris adultes
Dyrk1a
+/++
sont désorganisées, avec de grandes régions comprenant des petits follicules. Ces anomalies sont semblables à celles que l’on observe dans les thyroïdes des fœtus humains atteints par le syndrome de Down.
La dyshormonogenèse thyroïdienne Un défaut touchant l’une des protéines indispensables à la synthèse des hormones thyroïdiennes par les thyrocytes conduit à une dyshormonogenèse thyroïdienne (HCDH). L’échographie permet de déterminer si la glande thyroïdienne est de taille normale ou hyperplasique (goitre).
Les HCDH sont classées selon les résultats obtenus par scintigraphie, qui permet d’évaluer la captation d’iode radioactif par la thyroïde, et par le test au perchlorate
15
: les défauts d’absorption de l’iode par les thyrocytes, avec peu ou pas de captation d’iode radioactif en raison de mutations du transporteur NIS ; les défauts d’organification de l’iode (DOIP/T) dus à des mutations dans les gènes
TPO, DUOX2, DUOXA2
et
PENDRIN (SLC26A4)
- la captation de l’iode est alors normale mais le test au perchlorate est positif ; les défauts de synthèse, de stockage ou de libération de la TG, ou les défauts d’IYD (
iodotyrosine deiodinase
) entraînant des perturbations dans le recyclage de l’iodure par les thyrocytes - dans ces cas, la captation de l’iode est normale et le test au perchlorate est négatif. Un défaut de iodotyrosine déhalogénase (DEHAL1) produit également une décroissance très rapide de la fixation de l’iode dans la glande thyroïde qui est caractéristique.
Contrairement aux HCDT, les HCDH
(
Tableau II
)
sont transmises selon un mode autosomique récessif et, en général, sans malformation associée. Le syndrome de Pendred, dû aux mutations du gène codant la pendrine (
SLC26A4
), une protéine échangeuse d’anions chlorure Cl
-
contre des anions iodure I
-
,
est une exception. Les patients atteints de ce syndrome ont un goitre thyroïdien et une perte d’audition neurosensorielle.
Tableau II.
| Gène(OMIM) |
Échographie/Scintigraphie thyroïdienne |
Dosage de la thyroglobuline |
Sévérité de l’HC, maladie associée |
Mode de transmission |
|
SLC5A5
(601843)
|
Goitre
Captation d’iode
absente ou – |
Tg sérique élevée |
Hypothyroïdie variable |
AR |
|
|
SLC26A4/PDS
(605646)
|
Goitre
Captation d’iode +,
DOIP (perchlorate +) |
Tg sérique élevée |
Hypothyroïdie légère à modérée,
Syndrome de Pendred : surdité |
AR |
|
|
DUOX1/DUOX2
(606758/606759)
|
Goitre
Captation d’iode +,
DOIP ou DOIT
(perchlorate +) |
Tg sérique élevée |
Hypothyroïdie transitoire ou permanente de sévérité variable |
AR/AD |
|
|
DUOXA2
(612772)
|
Goitre
Captation d’iode +,
DOIP ou DOIT
(perchlorate +) |
Tg sérique élevée |
Hypothyroïdie transitoire ou permanente de sévérité variable |
AR |
|
|
TPO
(606765)
|
Goitre,
Captation d’iode +,
DOIT (perchlorate +) |
Tg sérique élevée |
Hypothyroïdie sévère |
AR |
|
|
TG
(188450)
|
Goitre congénital ou à croissance rapide, Captation d’iode +, perchlorate négatif |
Tg sérique faible |
Hypothyroïdie variable |
AR |
|
|
IYD/DEHAL1
(612025)
|
Glande en place de taille normale, goitre,
Captation d’iode +, perchlorate négatif |
Tg sérique élevée, MIT/DIT dans le sérum et les urines |
Hypothyroïdie variable |
AR (pénétrance incomplète) |
|
|
SLC26A7
(608479)
|
Goitre,
DOIP (perchlorate +) |
Tg sérique élevée |
Hypothyroïdie variable |
AR |
Gènes associés aux HC primaires avec dyshormonogenèse thyroïdienne.
Tg : thyroglobuline ; AD : autosomique dominant ; AR : autosomique récessif ; DOIP : défaut d’organification d’iode partiel ; DOIT : défaut d’organification d’iode total ; Perchlorate : test au perchlorate ; MIT : monoiodotyrosine ; DIT : diiodityrosine (MIT et DIT sont issus du catabolisme/recyclage des hormones thyroïdiennes [HT]).
|
Des mutations bialléliques du gène
SLC26A7,
qui code un membre de la même famille de transporteurs que la pendrine, ont récemment été rapportées chez des patients atteints d’HC, et présentant un goitre et un défaut d’organification de l’iode partiel [
8
,
24
]. Ces mutations n’impactent cependant pas l’efflux d’iodure dans les thyrocytes, et les personnes ont une audition normale [
8
,
24
].
Dans une cohorte de patients atteints d’HCDH (HC avec goitre ou HC avec glande en place et test au perchlorate positif), le diagnostic génétique, utilisant les gènes identifiés que nous avons présentés, est posé chez 50 % des patients [
25
].
Des mutations des gènes
SLC26A4
[
26
],
DUOX2
[
27
] et
TPO
[
28
] ont été retrouvées de façon inattendue chez des patients présentant une HC sans goitre ou avec une hypoplasie de la thyroïde. Des mutations de
DUOX2
ont également été retrouvées chez des patients ayant une HC avec une ectopie de la thyroïde. D’autres études sont cependant nécessaires afin d’expliquer l’implication de DUOX2 dans la migration de la thyroïde [
29
]. Ces résultats montrent néanmoins un possible chevauchement des gènes impliqués dans l’étiologie et la pathogénie entre HCDT et HCDH. Les premiers patients avec HC portant des mutations DUOX1 et de DUOX2 ont été rapportés, suggérant une cause digénique possible d’HC. [
30
].
|
De nouveaux gènes impliqués dans l’HC centrale
L’HC centrale (ou CeHC) peut être isolée ou se retrouver dans un contexte de déficience en hormone hypophysaire multiple/combiné (CPHD pour
combined pituitary hormone deficiency
). Le nombre de CeHC d’origines génétiques probables, isolées ou syndromiques, a augmenté ces dernières années, en raison des progrès réalisés dans les analyses génétiques, comme cela a été le cas pour l’HC primaire.
La CeHC est fréquemment associée à une CPHD. Elle peut être liée à un ou plusieurs autres déficits en hormones hypophysaires. Certains patients qui sont atteints de CeHC présentent également des anomalies morphologiques de l’hypophyse ou de l’hypothalamus, ou d’autres anomalies neurologiques [
31
,
32
]. La CeHC isolée est principalement due à des mutations bialléliques du gène codant la TSH-β [
33
,
34
] et du gène codant son récepteur TRHR [
35
], ces dernières ne touchant que peu de familles. Ces dernières années, de nouveaux gènes ont été identifiés chez les patients atteints de CeHC
(
Tableau III
)
.
Tableau III.
|
Gène(OMIM) |
Phénotype |
Mode de transmission |
| HC centrale isolée |
|
TSH
β(188540)
|
Début néonatal avec un taux bas de TSH, une sous-unité alpha glycoprotéine élevée et une PRL normale, hyperplasie hypophysaire réversible sur L-T4 |
AR |
|
TRHR
(188545)
|
TSH normale et taux faibles de PRL, réponses insuffisantes de TSH/PRL au test de stimulation de la TRH |
AR |
|
TBL1X
(300196)
|
CeCH isolée chez les hommes avec niveaux sériques normaux de TSH et réponse normale au test de stimulation de la TRH ; défauts auditifs associés |
Lié à l’X |
|
IRS4
(300904)
|
CeCH isolée chez les hommes avec niveaux sériques normaux de TSH, réponse insuffisante de la TSH au TRH |
Lié à l’X |
|
| HC centrale associée aux autres anomalies hypophysaires |
|
IGSF1
(300137)
|
TSH sérique normale et réponse insuffisante au test de stimulation de la TRH ; faible taux de PRL, insuffisance variable de GH, hypocortisolisme modéré transitoire, syndrome métabolique ; macrorchidisme post-pubertaire |
Lié à l’X |
|
PROP1
(601538)
|
Âge variable d’apparition, déficit combiné avec des déficit en GH, PRL, LH/FSH et ACTH, volume hypophysaire variable |
AR |
|
POU1F1
(173110)
|
Âge d’apparition variable, associé à un déficit en GH et en PRL, front proéminent, hypoplasie de la face médiane, ensellure nasale |
AD/AR |
|
HESX1
(601802)
|
Hypopituitarisme associé à la dysplasie septo-optique |
AD/AR |
|
SOX3
(313430)
|
Hypoplasie anté-hypophysaire avec post-hypophyse ectopique, canal cranio-pharyngé persistant et difficultés d’apprentissage |
Lié à l’X |
|
OTX2
(600037)
|
Hypoplasie antéhypophysaire avec post-hypophyse ectopique (PHE) et anomalies oculaires (ano-/micro-ophtalmie/dystrophie rétinienne) |
AD |
|
LHX3
(600577)
|
Hypopituitarisme avec déficit corticotrope inconstant, volume variable de l’hypophyse, épine cervicale courte et rigide et défaut auditif variable |
AR |
|
LHX4
(602146)
|
Hypopituitarisme variable, hypoplasie de l’anté-hypophyse avec PHE, syndrome d’Arnold-Chiari, hypoplasie du corps calleux |
AD/AR |
|
LEPR
(601007)
|
Hyperphagie, obésité, hypogonadisme hypogonadotrope |
AR |
|
SOX2
(184429)
|
Hypopituitarisme variable, hypoplasie hypophysaire, microphtalmie, difficultés d’apprentissage variables |
AD |
|
PCSK1
(162150)
|
Hyperphagie, obésité précoce, hypogonadisme hypogonadotrope, déficit corticotrope |
AR |
|
| HC centrale dans un contexte syndromique |
|
PROKR2
(607123)
|
Hypopituitarisme variable associé à une dysplasie septo-optique ou à un syndrome d’interruption de la tige pituitaire |
AD/AR |
|
|
NFKB2
(164012)
|
Déficit antéhypophysaire avec déficit immunitaire variable (DAVID), syndrome associé à une insuffisance corticotrope et à des déficits variables de GH et de TSH |
AD |
|
|
CHD7
(608892)
|
Syndrome CHARGE (colobome, anomalie cardiaque, atrésie choanale, retard, anomalies génitales et d’oreille) avec PHE et déficits variables de LH/FSH, de TSH et de GH |
AD |
|
|
FGFR1
(136350)
|
Syndrome de Kallman (KS) et hypogonadisme hypogonadotrope congénital normosmique (nCHH), association variable avec des déficits d’autres hormones pituitaires comprenant la TSH, la dysplasie septo-optique et une PHE |
AD |
|
|
FGF8
(600483)
|
KS et nCHH, associations variables avec des déficits d’autres hormones hypophysaires, y compris la TSH, l’holoprosencéphalie et l’agénésie du corps calleux |
AR |
|
|
FOXA2
(600288)
|
Hypopituitarisme avec anomalies craniofaciales et atteinte multiorganique, hyperinsulinisme |
AD |
|
|
RNPC3
(618016)
|
Déficit en hormone de croissance, cataracte congénitale, retard de développement, retard pubertaire |
AR |
Gènes impliqués dans l’hypothyroïdie centrale et leurs phénotypes associés.
AR : autosomique récessif ; AD : autosomique dominant ; TSH : thyroi
d-stimulating hormone
; PRL : prolactine ; L-T4 : L-thyroxine ; TRH :
thyrotropin-releasing hormone
; CeCH : hypothyroïdie congénitale centrale ; GH : hormone de croissance ; LH : hormone lutéinisante ; FSH : hormone folliculostimulante ; ACTH : hormone corticotrope hypophysaire.
|
IGSF1
Les mutations du gène codant le membre 1 de la superfamille des immunoglobulines
(IGSF1)
sont à l’origine d’un syndrome lié à l’X, dont une CeCH qui est de sévérité modérée. Les caractéristiques de cette atteinte sont une croissance testiculaire anormale conduisant à une augmentation anormale du volume des testicules (macroorchidie) à l’âge adulte, parfois un retard pubertaire, un niveau faible de prolactine, et, parfois, une carence réversible en hormone de croissance [
36
]. Certaines femmes porteuses de ces mutations peuvent avoir une fonction thyroïdienne altérée.
IGSF1
est désormais considéré comme le gène le plus fréquemment impliqué dans les CeHC [
37
].
TBL1X
Les mutations du gène
TBL1X
sont la deuxième cause de CeHC liées à l’X. TBL1X (
transducin-like 1
) est une protéine participant au complexe corépresseur du récepteur des hormones thyroïdiennes SMRT (
silencing mediator for retinoid and thyroid hormone receptors
) / NcoR (
nuclear receptor corepressor
). Elle est exprimée chez l’homme aux niveaux hypothalamique (noyau paraventriculaire) et hypophysaire. Chez la souris, les animaux transgéniques dont le gène codant NcoR a été invalidé, présentent un déficit thyréotrope. La perte auditive est souvent une caractéristique clinique associée chez l’homme [
38
].
IRS4
Récemment, des mutations du gène
IRS4
ont été identifiées chez des patients atteints de CeHC liées à l’X, dans cinq familles. Les familles de substrats de récepteur de l’insuline (IRS) agissent comme des interfaces entre les récepteurs tyrosine kinases, dont les récepteurs de l’insuline, la leptine et IGF-1 (
insulin-like growth factor 1
), et plusieurs voies de signalisation. IRS4 est impliqué dans la signalisation de la leptine, une hormone digestive qui régule les réserves de l’organisme. Un mécanisme proposé pour ce type de CeHC pourrait donc avoir pour origine la signalisation induite par la leptine [
39
].
PCSK1
Le déficit en PC1/3 (
proproteinconvertase 1/3
) causé par des mutations du gène
PCSK1
, selon un mode de transmission récessif, entraîne une hyperphagie, une obésité précoce, un hypogonadisme hypogonadotrope, une CeHC et un hypocortisolisme [
40
]. Certains patients présentent également une diarrhée chronique, une malabsorption et un diabète insipide. Vingt-six patients ayant un déficit en PC1/3, dont 56 % présentaient une CeHC, ont été décrits.
RNPC3
Des variants bialléliques du gène
RNPC3
(
RNA-binding region [RNP1, RRM]-containing 3
) ont été identifiés dans deux familles dont les enfants présentaient un déficit en hormone de croissance, une CeHC, une cataracte congénitale, une déficience intellectuelle et un retard pubertaire [
41
]. Ces cas mettent en évidence une association entre variants bialléliques de
RNPC3
et le retard de croissance postnatal sévère dû à un déficit en hormone de croissance.
RNPC3
code une protéine (U11/U12-65K) liant les petits ARN nucléaires, un composant du spliceosome mineur dont les altérations entraîneraient un défaut de développement de l’hypophyse.
|
Les modes de transmission
La pathogénie des HC est en grande partie inconnue. Elle dépend en effet de facteurs individuels (génétiques) mais aussi de facteurs environnementaux. Bien que l’HC soit typiquement identifiée comme une maladie sporadique, plusieurs études réalisées chez l’homme et dans des modèles expérimentaux montrent l’origine génétique de la maladie. En faveur de cette origine génétique, une plus grande fréquence d’anomalies thyroïdiennes développementales a été observée chez les parents du premier degré d’individus atteints d’HC [
42
]. L’incidence de l’HC dans les familles consanguines et dans certains groupes ethniques est également en faveur de cette origine génétique [
43
]. L’HC est également associée à un risque plus élevé d’avoir d’autres anomalies liées à des atteintes congénitales (20 fois supérieur) [
44
] et plusieurs syndromes ont été associés à des anomalies thyroïdiennes, comme le syndrome d’Alagille, le syndrome de Di George, le syndrome de Williams-Beuren, le syndrome de Kabuki et le syndrome génito-patellaire (voir plus haut).
L’HCDT, a toujours été considérée comme une maladie monogénique, avec un mode de transmission autosomique dominant, due à des variants rares. La proportion de cas familiaux d’HCDT est estimée à 2 %, ce qui suggère l’implication de facteurs génétiques [
45
]. Mais moins de 5 % des patients atteints d’HCDT sont porteurs d’une mutation dans l’un des dix gènes déterminés comme causaux ou prédisposants (
NKX2-1, FOXE1, PAX8, NKX2-5, TSHR, JAG1, NTN1, GLIS3, BOREALIN, TUBB1)
. Ces patients sont des cas sporadiques ou familiaux, avec une pénétrance incomplète pour certains gènes [
18
].
Dans une cohorte comptant 177 patients atteints d’HC, une origine oligogénique des cas sporadiques d’HC a été envisagée [
46
]. Ce modèle oligogénique pourrait expliquer l’expressivité et la pénétrance variables des défauts génétiques qui ont été rapportés dans plusieurs cas familiaux d’hypothyroïdie. Il correspond au modèle animal dans lequel l’HC aurait, en fait, une origine multifactorielle [
47
]. Outre ces formes monogéniques rares, l’HC pourrait survenir, plus fréquemment, dans des cas sporadiques comme une maladie multifactorielle ayant des prédispositions génétiques. Un modèle génétique plus complexe des HCDT est ainsi proposé, impliquant différents variants génétiques qui sont plus ou moins rares [
48
]. Le caractère polymorphe des polyalanines du gène
FOXE1
(
forkhead box E1
) a suscité un grand intérêt comme facteur de susceptibilité. La relation entre la longueur du polyalanine de
FOXE1
et le type de DT suggère une implication de cette caractéristique comme facteur de susceptibilité aux DT [
49
].
Le taux de discordance élevé (92 %) entre jumeaux monozygotes et la différence de prévalence des HCDT selon le sexe plus élevée chez les femmes, sont deux arguments contre une transmission mendélienne classique de la maladie [
50
]. Des mécanismes somatiques pourraient être impliqués : des mutations somatiques post-zygotiques précoces ; des mutations ou épimutations spécifiques au tissu ; ou une expression monoallélique autosomique tissu-spécifique des gènes impliqués dans la thyroïde [
51
-
54
]. Cependant, à ce jour, aucune preuve de l’existence de tels mécanismes n’a été établie.
|
L’origine des hypothyroïdies congénitales (HC) n’est pas encore bien définie. Ces dernières années ont révélé la complexité de la maladie avec la description de nouveaux modèles, comme l’oligogénisme, l’intervention de l’épigénétique, et, probablement aussi, l’implication de facteurs extrinsèques, comme l’environnement. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
AS a reçu la bourse de recherche de l’European Society for Pediatric Endocrinology (ESPE). AC, DK et MP ont reçu les financements de Sandoz SAS, et Merck Serono France, de la Société française d’endocrinologie et diabétologie pédiatrique (SFEDP) et de l’Agence nationale de la recherche (ANR).
|
Footnotes |
1.
Léger
J
.
Dépistage de l’hypothyroïdie congénitale.
.
Med Sci (Paris).
2021;
;
37
:
:474.
–
81
.
2.
Barry
Y
,
Bonaldi
C
,
Goulet
V
,
et al.
Increased incidence of congenital hypothyroidism in France from 1982 to 2012: a nationwide multicenter analysis.
.
Ann Epidemiol.
2016;
;
26
:
:100.
–
105
.
3.
Cavarzere
P
,
Castanet
M
,
Polak
M
,
et al.
Clinical description of infants with congenital hypothyroidism and iodide organification defects.
.
Horm Res.
2008;
;
70
:
:240.
–
248
.
4.
Trueba
SS
,
Augé
J
,
Mattei
G
,
et al.
PAX8, TITF1, and FOXE1 gene expression patterns during human development: new insights into human thyroid development and thyroid dysgenesis-associated malformations.
.
J Clin Endocrinol Metab.
2005;
;
90
:
:455.
–
462
.
5.
Carvalho
DP
,
Dupuy
C
.
Thyroid hormone biosynthesis and release.
.
Mol Cell Endocrinol.
2017;
;
458
:
:6.
–
15
.
6.
Stoupa
A
,
Kariyawasam
D
,
Carré
A
,
Polak
M
.
Update of Thyroid Developmental Genes.
.
Endocrinol Metab Clin North Am.
2016;
;
45
:
:243.
–
254
.
7.
Carré
A
,
Stoupa
A
,
Kariyawasam
D
,
et al.
Mutations in BOREALIN cause thyroid dysgenesis.
.
Hom Mol Genet.
2017;
;
26
:
:599.
–
610
.
8.
Zou
M
,
Alzahrani
AS
,
Al-Odaib
A
,
et al.
Molecular Analysis of Congenital Hypothyroidism in Saudi Arabia: SLC26A7 Mutation Is a Novel Defect in Thyroid Dyshormonogenesis.
.
J Clin Endocrinol Metab.
2018;
;
103
:
:1889.
–
1898
.
9.
Levy-Strumpf
N
,
Culotti
JG
.
Netrins and Wnts function redundantly to regulate antero-posterior and dorso-ventral guidance in C. elegans.
.
PLoS Genet.
2014;
;
10
:
:e1004381.
.
10.
Méneret
A
,
Franz
EA
,
Trouillard
O
,
et al.
Mutations in the netrin-1 gene cause congenital mirror movements.
.
J Clin Invest.
2017;
;
127
:
:3923.
–
3936
.
11.
Opitz
R
,
Hitz
MP
,
Vandernoot
I
,
et al.
Functional zebrafish studies based on human genotyping point to netrin-1 as a link between aberrant cardiovascular development and thyroid dysgenesis.
.
Endocrinology.
2015;
;
156
:
:377.
–
388
.
12.
Marelli
F
,
Persani
L
.
Role of Jagged1-Notch pathway in thyroid development.
.
J Endocrinol Invest.
2018;
;
41
:
:75.
–
81
.
13.
de Filippis
T
,
Marelli
F
,
Nebbia
G
,
et al.
JAG1 Loss-Of-Function Variations as a Novel Predisposing Event in the Pathogenesis of Congenital Thyroid Defects.
.
J Clin Endocrinol Metab.
2016;
;
101
:
:861.
–
870
.
14.
Stoupa
A
,
Adam
F
,
Kariyawasam
D
,
et al.
TUBB1 mutations cause thyroid dysgenesis associated with abnormal platelet physiology.
.
EMBO Mol Med.
2018;
;
10
:
:e9569.
.
15.
Choukair
D
,
Eberle
B
,
Vick
P
,
et al.
Identification of Transient Receptor Potential Channel 4-Associated Protein as a Novel Candidate Gene Causing Congenital Primary Hypothyroidism.
.
Horm Res Paediatr.
2020;
;
93
:
:16.
–
29
.
16.
Reale
C
,
Iervolino
A
,
Scudiero
I
,
et al.
NF-κB Essential Modulator (NEMO) Is Critical for Thyroid Function.
.
J Biol Chem.
2016;
;
291
:
:5765.
–
5773
.
17.
Yang
RM
,
Zhan
M
,
Zhou
QY
,
et al.
Upregulation of GBP1 in thyroid primordium is required for developmental thyroid morphogenesis.
.
Genet Med.
2021;
;
23
:
:1944.
–
51
.
18.
Abu-Khudir
R
,
Larrivée-Vanier
S
,
Wasserman
JD
,
Deladoëy
J
.
Disorders of thyroid morphogenesis.
.
Best Pr. Res Clin Endocrinol Metab.
2017;
;
31
:
:143.
–
159
.
19.
Motokawa
M
,
Watanabe
S
,
Nakatomi
A
,
et al.
A hot-spot mutation in CDC42 (p.Tyr64Cys) and novel phenotypes in the third patient with Takenouchi-Kosaki syndrome.
.
J Hum Genet.
2018;
;
63
:
:387.
–
390
.
20.
Loebel
DA
,
Plageman
TF
,
Jr
,
Tang
TL
,
et al.
Thyroid bud morphogenesis requires CDC42- and SHROOM3-dependent apical constriction.
.
Biol Open.
2016;
;
5
:
:130.
–
139
.
21.
Ghoumid
J
,
Stichelbout
M
,
Jourdain
AS
,
et al.
Blepharocheilodontic syndrome is a CDH1 pathway-related disorder due to mutations in CDH1 and CTNND1.
.
Genet Med.
2017;
;
19
:
:1013.
–
1021
.
22.
Kariyawasam
D
,
Carré
A
,
Luton
D
,
Polak
M
.
Down syndrome and nonautoimmune hypothyroidisms in neonates and infants.
.
Horm Res Paediatr.
2015;
;
83
:
:126.
–
131
.
23.
Kariyawasam
D
,
Rachdi
L
,
Carré
A
,
et al.
DYRK1A BAC transgenic mouse: a new model of thyroid dysgenesis in Down syndrome.
.
Endocrinology.
2015;
;
156
:
:171.
–
180
.
24.
Cangul
H
,
Liao
XH
,
Schoenmakers
E
,
et al.
Homozygous loss-of-function mutations in SLC26A7 cause goitrous congenital hypothyroidism.
.
JCI Insight.
2018;
;
3
:
:e99631.
.
25.
Stoupa
A
,
Hage
Chehade GA
,
Chaabane
R
,
et al.
High Diagnostic Yield of Targeted Next-Generation Sequencing in a Cohort of Patients with Congenital Hypothyroidism Due to Dyshormonogenesis.
.
Front Endocrinol.
2021;
;
11
:
:545339.
.
26.
Kühnen
P
,
Turan
S
,
Fröhler
S
,
et al.
Identification of PENDRIN (SLC26A4) mutations in patients with congenital hypothyroidism and “apparent” thyroid dysgenesis.
.
J Clin Endocrinol Metab.
2014;
;
99
:
:E169.
–
E176
.
27.
Srichomkwun
P
,
Takamatsu
J
,
Nickerson
DA
,
et al.
DUOX2 Gene Mutation Manifesting as Resistance to Thyrotropin Phenotype.
.
Thyroid. Thyroid.
2016;
;
27
:
:129.
–
131
.
28.
Stoupa
A
,
Chaabane
R
,
Guériouz
M
,
et al.
Thyroid Hypoplasia in Congenital Hypothyroidism Associated with Thyroid Peroxidase Mutations.
.
Thyroid.
2018;
;
28
:
:941.
–
944
.
29.
Kizys
MML
,
Louzada
RA
,
Mitne-Neto
M
,
et al.
DUOX2 Mutations Are Associated With Congenital Hypothyroidism With Ectopic Thyroid Gland.
.
J Clin Endocrinol Metab.
2017;
;
102
:
:4060.
–
4071
.
30.
Aycan
Z
,
Cangul
H
,
Muzza
M
,
et al.
Digenic DUOX1 and DUOX2 Mutations in Cases With Congenital Hypothyroidism.
.
J Clin Endocrinol Metab.
2017;
;
102
:
:3085.
–
3090
.
31.
Persani
L
,
Cangiano
B
,
Bonomi
M
.
The diagnosis and management of central hypothyroidism in 2018.
.
Endocr Connect.
2019;
;
8
:
:R44.
–
R54
.
32.
Persani
L
,
Brabant
G
,
Dattani
M
,
et al.
2018 European Thyroid Association (ETA) Guidelines on the Diagnosis and Management of Central Hypothyroidism.
.
Eur Thyroid J.
2018;
;
7
:
:225.
–
237
.
33.
Miyai
K
,
Azukizawa
M
,
Kumahara
Y
.
Familial isolated thyrotropin deficiency with cretinism.
.
N Engl J Med.
1971;
;
285
:
:1043.
–
1048
.
34.
Bonomi
M
,
Proverbio
MC
,
Weber
G
,
et al.
Hyperplastic pituitary gland, high serum glycoprotein hormone alpha-subunit, and variable circulating thyrotropin (TSH) levels as hallmark of central hypothyroidism due to mutations of the TSH beta gene.
.
J Clin Endocrinol Metab.
2001;
;
86
:
:1600.
–
1604
.
35.
Bonomi
M
,
Busnelli
M
,
Beck-Peccoz
P
,
et al.
A family with complete resistance to thyrotropin-releasing hormone.
.
N Engl J Med.
2009;
;
360
:
:731.
–
734
.
36.
Sun
Y
,
Bak
B
,
Schoenmakers
N
,
et al.
Loss-of-function mutations in IGSF1 cause an X-linked syndrome of central hypothyroidism and testicular enlargement.
.
Nat Genet.
2012;
;
44
:
:1375.
–
1381
.
37.
Joustra
SD
,
Heinen
CA
,
Schoenmakers
N
,
et al.
IGSF1 Deficiency: Lessons From an Extensive Case Series and Recommendations for Clinical Management.
.
J Clin Endocrinol Metab.
2016;
;
102
:
:2125.
.
38.
Heinen
CA
,
Losekoot
M
,
Sun
Y
,
et al.
Mutations in TBL1X Are Associated With Central Hypothyroidism.
.
J Clin Endocrinol Metab.
2016;
;
101
:
:4564.
–
4573
.
39.
Heinen
CA
,
de Vries
EM
,
Alders
M
,
et al.
Mutations in IRS4 are associated with central hypothyroidism.
.
J Med Genet.
2018;
;
55
:
:693.
–
700
.
40.
Pépin
L
,
Colin
E
,
Tessarech
M
,
et al.
A New Case of PCSK1 Pathogenic Variant With Congenital Proprotein Convertase 1/3 Deficiency and Literature Review.
.
J Clin Endocrinol Metab.
2019;
;
104
:
:985.
–
993
.
41.
Verberne
EA
,
Faries
S
,
Mannens
MMAM
,
et al.
Expanding the phenotype of biallelic RNPC3 variants associated with growth hormone deficiency.
.
AM J Med Genet A.
2020;
;
182
:
:1952.
–
6
.
42.
Léger
J
,
Marinovic
D
,
Garel
C
,
et al.
Thyroid developmental anomalies in first degree relatives of children with congenital hypothyroidism.
.
J Clin Endocrinol Metab.
2002;
;
87
:
:575.
–
580
.
43.
Stoppa-Vaucher
S
,
Van Vliet
G
,
Deladoëy
J
.
Variation by ethnicity in the prevalence of congenital hypothyroidism due to thyroid dysgenesis.
.
Thyroid.
2011;
;
21
:
:13.
–
18
.
44.
Passeri
E
,
Frigerio
M
,
De Filippis
T
,
et al.
Increased risk for non-autoimmune hypothyroidism in young patients with congenital heart defects.
.
J Clin Endocrinol Metab.
2011;
;
96
:
:E1115.
–
E1119
.
45.
Castanet
M
,
Lyonnet
S
,
Bonaïti-Pellié
C
,
et al.
Familial forms of thyroid dysgenesis among infants with congenital hypothyroidism.
.
N Engl J Med.
2000;
;
343
:
:441.
–
442
.
46.
de Filippis
T
,
Gelmini
G
,
Paraboschi
E
,
et al.
A frequent oligogenic involvement in congenital hypothyroidism.
.
Hum Mol Genet.
2017;
;
26
:
:2507.
–
2514
.
47.
Amendola
E
,
De Luca
P
,
Macchia
PE
,
et al.
A mouse model demonstrates a multigenic origin of congenital hypothyroidism.
.
Endocrinology.
2005;
;
146
:
:5038.
–
5047
.
48.
Stoupa
A
,
Kariyawasam
D
,
Muzza
M
,
et al.
New genetics in congenital hypothyroidism.
.
Endocrine.
2021;
;
71
:
:696.
–
705
.
49.
Carré
A
,
Castanet
M
,
Sura-Trueba
S
,
et al.
Polymorphic length of FOXE1 alanine stretch: evidence for genetic susceptibility to thyroid dysgenesis.
.
Hum Genet.
2007;
;
122
:
:467.
–
476
.
50.
Perry
R
,
Heinrichs
C
,
Bourdoux
P
,
et al.
Discordance of monozygotic twins for thyroid dysgenesis: implications for screening and for molecular pathophysiology.
.
J Clin Endocrinol Metab.
2002;
;
87
:
:4027.
–
4077
.
51.
Abu-Khudir
R
,
Magne
F
,
Chanoine
JP
,
et al.
Role for tissue-dependent methylation differences in the expression of FOXE1 in nontumoral thyroid glands.
.
J Clin Endocrinol Metab.
2014;
;
99
:
:E1120.
–
E1129
.
52.
Abu-Khudir
R
,
Paquette
J
,
Lefort
A
,
et al.
Transcriptome, methylome and genomic variations analysis of ectopic thyroid glands.
.
PLoS One.
2010;
;
5
:
:e13420.
.
53.
Magne
F
,
Ge
B
,
Larrivée-Vanier
S
,
et al.
Demonstration of autosomal monoallelic expression in thyroid tissue assessed by whole-exome and bulk RNA sequencing.
.
Thyroid.
2016;
;
26
:
:852.
–
859
.
54.
Magne
F
,
Serpa
R
,
Van Vliet
G
,
et al.
Somatic mutations are not observed by exome sequencing of lymphocyte DNA from monozygotic twins discordant for congenital hypothyroidism due to thyroid dysgenesis.
.
Horm Res Paediatr.
2014;
;
83
:
:79.
–
85
.
|