| |
| Med Sci (Paris). 38(3): 251–254. doi: 10.1051/medsci/2022014.Les astrocytes, gardiens de la plasticité des périodes critiques Jérôme Ribot,1 Rachel Breton,1,2,3 Glenn Dallérac,1 and Nathalie Rouach1* 1Interactions neurogliales en physiologie et pathologies cérébrales, Centre interdisciplinaire de recherche en biologie, Collège de France, CNRS, Inserm, Labex Memolife, Université PSL
,
11 place Marcelin Berthelot
,
75005Paris
,
France 2École doctorale 568, Université Paris-Saclay, Université PSL
,
Le Kremlin Bicêtre
,
France 3Adresse actuelle : Astrocytes et Cognition, Institut des neurosciences de Paris-Saclay, CNRS UMR 9197, Université Paris-Saclay
,
Orsay
,
France MeSH keywords: Astrocytes, Humains, Plasticité neuronale |
Les « périodes critiques », périodes de remodelage intense des connexions neuronales
La plasticité neuronale traduit la capacité du cerveau à modifier ses réseaux neuronaux pour s’adapter à un nouvel environnement. Elle est impliquée dans les processus d’apprentissage et de mémorisation, et fait de notre cerveau une structure dynamique qui s’adapte à nos expériences. La plasticité neuronale a des pics d’efficacité pendant des fenêtres de temps spécifiques du développement, au cours desquelles les informations reçues du monde extérieur « sculptent » les circuits neuronaux
(
Figure 1
)
. Ces périodes sensibles, dites « périodes critiques », sont des périodes du développement postnatal relativement courtes à l’échelle d’une vie. Leur décours temporel varie selon les espèces et les processus cognitifs impliqués, de telle sorte que les périodes critiques pour les processus les plus simples, comme la perception sensorielle (vision, audition, etc.), ont lieu avant celles de processus cognitifs plus complexes, tels que le langage. Pendant ces périodes, le cerveau se développe morphologiquement et physiologiquement en fonction des stimulations qu’il reçoit. La mise en place des circuits neuronaux au cours de ces périodes développementales est donc cruciale pour les différentes fonctions cognitives et leurs interactions.
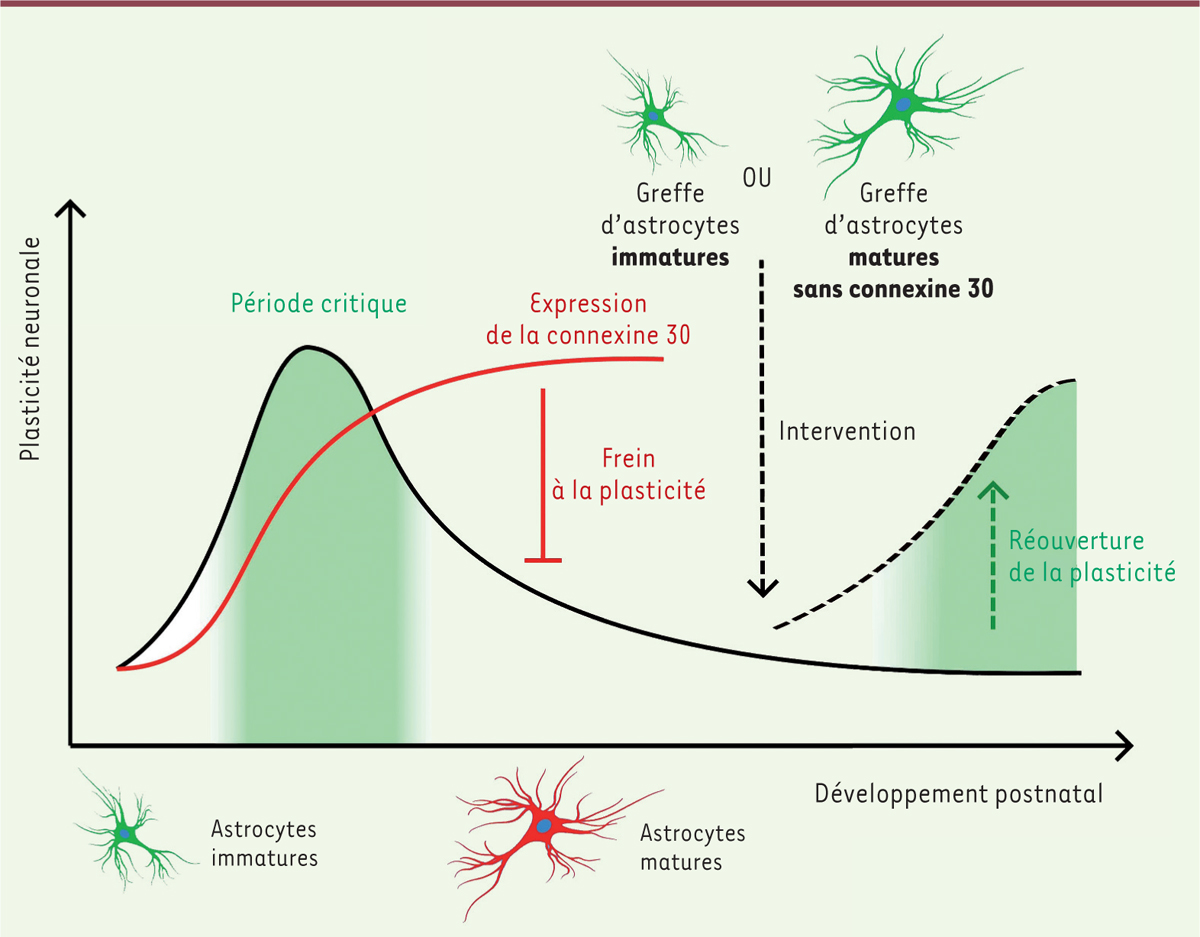
 | Figure 1.
Les astrocytes immatures rouvrent la période critique de plasticité.
La période critique correspond à une période limitée de plasticité neuronale intense. Quand des astrocytes immatures – extraits d’animaux nouveau-nés – sont greffés dans le cortex visuel d’animaux adultes, pour lesquels la période critique est fermée, une réouverture de la plasticité neuronale après une occlusion monoculaire se produit. L’une des caractéristiques majeures de ces astrocytes immatures est leur faible expression de la connexine 30, qui atteint un plateau peu de temps après la fermeture de la période critique. Lorsque des astrocytes matures – extraits d’animaux adultes – dépourvus de connexine 30 sont greffés dans le cortex visuel d’animaux adultes, une réouverture de la plasticité neuronale après une occlusion monoculaire se produit également.
|
Un corrélat de l’existence de ces périodes critiques est que des expériences sensorielles ou cognitives « anormales », si elles surviennent pendant ces périodes de grande plasticité, modifient considérablement le développement des zones corticales associées à ces fonctions. Les périodes critiques sont donc aussi des périodes de grande vulnérabilité. Dans le cas du dysfonctionnement d’un organe sensoriel, les réseaux neuronaux corticaux associés à cet organe s’organisent en relation avec ce dysfonctionnement. Ils pourront éventuellement retrouver un fonctionnement adéquat ultérieurement à condition que celui de l’organe sensoriel soit rétabli avant la fermeture de la période critique. Ainsi, comprendre les processus mis en œuvre dans l’établissement des périodes critiques dans le but d’identifier de nouvelles cibles thérapeutiques est essentiel pour espérer pouvoir un jour rouvrir chez l’adulte ces périodes de forte plasticité et recouvrer des réseaux neuronaux optimaux. |
Les astrocytes, acteurs majeurs de la plasticité neuronale pendant la période critique
Les astrocytes sont l’un des acteurs de la mise en place de la période critique. Ces cellules, de forme étoilée, sont les cellules gliales majoritaires du cerveau. Elles sont électriquement silencieuses, et ont été initialement considérées comme une sorte de ciment entre les neurones. Depuis, de nombreux travaux ont montré qu’elles participent en réalité à de nombreuses fonctions, telles que l’apport de nutriments aux neurones, la détoxification du milieu extracellulaire, le maintien de la barrière hémato-encéphalique, ou encore la modulation de la transmission synaptique. L’idée que les astrocytes immatures ont la capacité de rouvrir la plasticité neuronale chez l’adulte a été proposée il y a plus de trente ans. Une expérience avait en effet montré qu’une greffe d’astrocytes immatures dans le cortex visuel d’un chat adulte permet d’induire de nouveau une plasticité cérébrale [
1
]. Cependant, on ignorait encore si les astrocytes matures sont impliqués dans la fermeture de la période critique, et s’ils le sont, par quel mécanisme.
Pour répondre à cette question, nous avons d’abord reproduit chez la souris l’expérience de greffe d’astrocytes immatures précédemment réalisée chez le chat [
2
]. La souris offre en effet la possibilité d’utiliser divers outils pour tenter de comprendre les mécanismes moléculaires sous-jacents. Après avoir greffé dans le cortex visuel de souris adultes des astrocytes immatures cultivés à partir du cortex visuel de souriceaux nouveau-nés, nous avons analysé les changements de la plasticité cérébrale. Pour cela, nous avons réalisé une occlusion monoculaire, qui induit un changement de dominance oculaire (c’est-à-dire de la réponse du cortex cérébral à la stimulation de chaque œil) dans le cortex visuel des souriceaux tant que celui-ci possède une plasticité, mais n’en induit pas si l’occlusion est réalisée après la période critique [
3
]. Nous avons montré que la dominance oculaire du cortex visuel est modifiée chez les souris adultes greffées, mais pas chez les souris témoins, ce qui indique une réapparition de la plasticité neuronale chez les souris greffées
(
Figure 1
)
et démontre la capacité des astrocytes immatures à induire une plasticité corticale chez la souris.
|
La connexine 30, marqueur de maturité astrocytaire et acteur de la fermeture de la période critique
Quelles sont donc les caractéristiques des astrocytes immatures permettant de rétablir cette plasticité chez l’adulte ? Une analyse du transcriptome de ces cellules a révélé un changement fonctionnel au cours du développement : les astrocytes immatures privilégient la division cellulaire, tandis que les astrocytes matures privilégient la communication intercellulaire. En particulier, le gène
Gjb6
codant la connexine 30, une sous-unité des canaux jonctionnels communicants, est beaucoup plus fortement exprimé dans les astrocytes matures que dans les astrocytes immatures. Ce résultat, combiné au rôle déjà connu de la connexine 30 dans la maturation structurale des astrocytes et dans le contrôle de la transmission synaptique dans une autre région du cerveau [
4
], suggérait la possibilité que la variation d’expression de
Gjb6
dans les astrocytes soit impliquée dans la réouverture de la plasticité corticale chez la souris adulte.
Nous avons montré que la connexine 30 possède aussi d’autres propriétés remarquables. Premièrement, l’expression de
Gjb6
dans le cortex visuel est corrélée au profil temporel de la période critique, et est maximale au terme de cette période
(
Figure 1
)
. De plus, la connexine 30 est plus abondante dans la couche IV du cortex visuel, qui contient un sous-type de neurones inhibiteurs synthétisant la parvalbumine, et dont le développement joue un rôle crucial dans le décours temporel de la période critique [
5
]. Enfin, l’expression de
Gjb6
dans le cortex visuel est modulée par l’expérience visuelle. En effet, si la souris est placée quelques jours dans l’obscurité, une procédure permettant de rétablir la plasticité dans le cortex visuel adulte [
6
], l’expression de
Gjb6
diminue considérablement et la binocularité du cortex visuel est altérée. Ces résultats suggéraient que la connexine 30 est impliquée dans la fermeture de la période critique.
Pour tester cette hypothèse, nous avons d’abord analysé des souris adultes transgéniques chez lesquelles l’expression de
Gjb6
dans les astrocytes est réduite à environ 20 % de sa valeur normale. Ces souris présentent une période critique modifiée, avec un pic de plasticité plus tardif et de plus grande amplitude. Nous avons ensuite répété l’expérience de greffe précédente, en cultivant cette fois-ci des astrocytes matures exprimant ou pas le gène de la connexine 30. Nous avons montré que seuls les astrocytes matures n’exprimant pas ce gène ont la capacité de « rouvrir » une période de plasticité neuronale
(
Figure 1
)
. Ces deux expériences indiquent donc que la connexine 30 astrogliale intervient dans le contrôle de la fermeture de la période critique.
|
La connexine 30 promeut la maturation des neurones inhibiteurs synthétisant la parvalbumine
via
l’inhibition de la voie de signalisation RhoA-ROCK-MMP-9
Comment la connexine 30 intervient-elle dans la fermeture de la période critique ? Il convient de rappeler que cette connexine n’est pas seulement une protéine constitutive des jonctions communicantes entre astrocytes, et qu’elle est également impliquée dans des fonctions d’interaction cellulaire, d’adhérence ou de signalisation [
7
]. Compte-tenu du profil spatial et temporel d’expression de la connexine 30 dans le cortex visuel, nous avons émis l’hypothèse qu’elle pourrait être impliquée dans le contrôle de la maturation des neurones inhibiteurs synthétisant la parvalbumine, qui jouent un rôle fondamental dans la fermeture de la période critique en contrôlant l’équilibre entre inhibition et excitation neuronales [
5
]. La maturation de ces neurones inhibiteurs dépend de celle de la matrice extracellulaire autour d’eux, appelée filet périneuronal. Ces filets, dont l’abondance caractérise la maturité de ces neurones [
8
], sont des structures composées d’éléments de la matrice extracellulaire qui stabilisent les synapses, et sont donc un frein à leur plasticité. Nous avons montré que l’étendue des filets périneuronaux est réduite chez des souris adultes déficientes en connexine 30 [
2
]. Ce résultat indique que la connexine 30 intervient dans le contrôle de l’étendue des filets périneuronaux, donc dans la maturation des neurones inhibiteurs synthétisant la parvalbumine.
Une approche protéomique quantitative visant à déterminer les protéines partenaires de la connexine 30 nous a permis de mettre en évidence la voie de signalisation impliquée
(
Figure 2
)
. Nous avons montré que la connexine 30 inhibe la voie RhoA-ROCK (
Rho-associated protein kinase
), qui contrôle notamment l’expression de l’enzyme MMP-9 (métalloprotéinase matricielle-9), impliquée dans la dissolution de la matrice extracellulaire au voisinage des neurones
(
Figure 2A
)
. Lorsque l’expression de la connexine 30 augmente au cours du développement des astrocytes, l’expression de cette enzyme diminue fortement, ce qui entraîne la stabilisation et l’extension des filets périneuronaux situés autour des neurones inhibiteurs synthétisant la parvalbumine
(
Figure 2B
)
. Il s’ensuit une maturation de ces neurones, qui se traduit fonctionnellement par une augmentation de leur activité électrique, donc des courants inhibiteurs, notamment ceux enregistrés dans les neurones pyramidaux du cortex visuel
(
Figure 2C
)
. L’équilibre entre excitation et inhibition neuronales se trouve ainsi modifié au profit de l’inhibition, laquelle contrôle la fermeture de la période critique [
9
]
(
Figure 2D
)
. L’inhibition pharmacologique de cette voie de signalisation chez des souris adultes déficientes en connexine 30 suffit à restaurer la concentration de MMP-9, l’étendue des filets périneuronaux, et la plasticité neuronale à un niveau comparable à celui de souris adultes témoins.
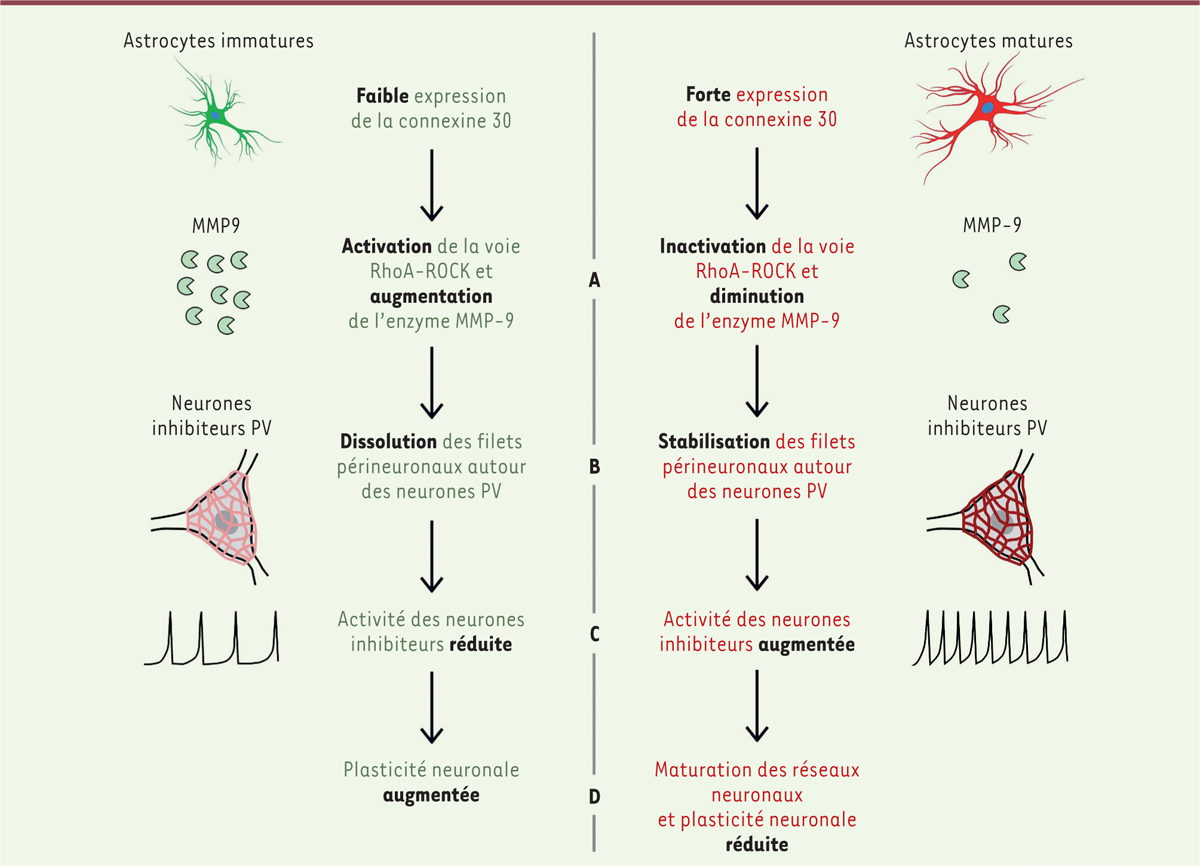
 | Figure 2.
La présence de la connexine 30 promeut la maturation des neurones inhibiteurs synthétisant la parvalbumine en inhibant la voie de signalisation RhoA-ROCK-MMP-9.
L’augmentation de l’expression du gène
Gjb6
codant la connexine 30 dans les astrocytes inhibe la voie de signalisation RhoA-ROCK (
Rho-associated protein-kinase
), ce qui entraîne une diminution de l’expression de la métalloprotéinase MMP-9
(A)
. En conséquence, les filets périneuronaux autour des neurones inhibiteurs synthétisant la parvalbumine (PV) sont stabilisés
(B)
, et l’activité électrique de ces neurones augmente
(C)
. Le changement dans l’équilibre entre inhibition et excitation neuronales au profit de l’inhibition conduit à la fermeture de la période critique dans le cortex visuel
(D)
(figure adaptée de [
10
]).
|
|
Nous avons montré que la maturation des astrocytes, par l’augmentation de l’expression de la connexine 30 qui l’accompagne, coordonne la fermeture de la période critique, donc la fin du remodelage des circuits neuronaux dans le cortex visuel. Ce mécanisme pourrait également concerner d’autres aires cérébrales impliquées dans la perception sensorielle, voire dans certaines fonctions cognitives. Les résultats de notre étude, qui mettent en lumière de nouveaux mécanismes cellulaires et moléculaires impliqués dans la fermeture de cette période critique, pourraient servir à élaborer des stratégies visant à induire une nouvelle période de plasticité accrue dans le cerveau adulte afin de favoriser la réadaptation après, par exemple, une lésion cérébrale, ou après un défaut d’information sensorielle survenu pendant une période critique de développement. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Müller
CM
,
Best
J
.
Ocular dominance plasticity in adult cat visual cortex after transplantation of cultured astrocytes.
.
Nature.
1989;
;
342
:
:427.
–
430
.
2.
Ribot
J
,
Breton
R
,
Calvo
CF
,
et al.
Astrocytes close the mouse critical period for visual plasticity.
.
Science.
2021;
;
373
:
:77.
–
81
.
3.
Hubel
DH
,
Wiesel
TN
.
The period of susceptibility to the physiological effects of unilateral eye closure in kittens.
.
J Physiol.
1970;
;
206
:
:419.
–
436
.
4.
Ghézali
G
,
Calvo
CF
,
Pillet
LE
,
et al.
Connexin 30 controls astroglial polarization during postnatal brain development.
.
Development.
2018;
;
145
:
:dev155275.
.
5.
Huang
ZJ
,
Kirkwood
A
,
Pizzorusso
T
,
et al.
BDNF regulates the maturation of inhibition and the critical period of plasticity in mouse visual cortex.
.
Cell.
1999;
;
98
:
:739.
–
755
.
6.
He
HY
,
Ray
B
,
Dennis
K
,
et al.
Experience-dependent recovery of vision following chronic deprivation amblyopia.
.
Nat Neurosci.
2007;
;
10
:
:1134.
–
1136
.
7.
Pannasch
U
,
Freche
D
,
Dallérac
G
,
et al.
Connexin 30 sets synaptic strength by controlling astroglial synapse invasion.
.
Nat Neurosci.
2014;
;
17
:
:549.
–
558
.
8.
Pizzorusso
T
,
Medini
P
,
Berardi
N
,
et al.
Reactivation of ocular dominance plasticity in the adult visual cortex.
.
Science.
2002;
;
298
:
:1248.
–
1251
.
9.
Hensch
TK
,
Fagiolini
M
,
Mataga
N
,
et al.
Local GABA circuit control of experience-dependent plasticity in developing visual cortex.
.
Science.
1998;
;
282
:
:1504.
–
1508
.
10.
Kofuji
P
,
Araque
A
.
Astrocytes control the critical period of circuit wiring.
.
Science.
2021;
;
373
:
:29.
–
30
.
|