| |
| Med Sci (Paris). 38(3): 248–251. doi: 10.1051/medsci/2022016.Les neurones produisant l’hormone de mélano-concentration régulent la fenestration des anses vasculaires de l’éminence médiane Alicia Sicardi1* and Vincent Prévot1** 1Univ. Lille, Inserm, CHU Lille, Laboratoire de Développement et plasticité du cerveau neuroendocrine, Lille Neuroscience et Cognition, UMR-S1172
,
1 place de Verdun
,
59045Lille Cedex
,
France MeSH keywords: Noyau arqué de l'hypothalamus, Humains, Hypothalamus, Éminence médiane, Neurones, physiologie, vascularisation |
Le cerveau est protégé par la présence d’une barrière hémato-encéphalique constituée par les jonctions serrées entre les cellules endothéliales de capillaires non-fenêtrés, qui limitent la diffusion paracellulaire des molécules [
1
]. La perméabilité de cette barrière à certains endroits permet cependant le passage direct d’hormones et de métabolites entre la circulation sanguine et le parenchyme cérébral [
2
]. Ces échanges se produisent dans les organes circumventriculaires du cerveau, dont les cellules endothéliales des capillaires ne sont pas toutes unies par des jonctions serrées, ce qui entraîne la présence de fenestrations dans la paroi de ces capillaires [
3
]. L’éminence médiane est un organe circumventriculaire stratégiquement situé à la base de l’hypothalamus. Le rôle de barrière y est assuré par une communication étroite entre les boucles de capillaires fenêtrés et une population de cellules gliales spécialisées : les tanycytes. Il s’agit de cellules gliales épendymaires tapissant le plancher du troisième ventricule et bordant l’hypothalamus médio-basal. Les tanycytes régulent à la fois la fenestration de l’endothélium des anses vasculaires [
4
] et le transport d’hormones peptidiques dans l’hypothalamus [
5
]. Leurs prolongements cytoplasmiques (ou extensions podales) sont dirigés vers la partie externe de l’éminence médiane ou vers les aires hypothalamiques voisines, où ils entrent respectivement en contact avec les capillaires fenêtrés ou ceux, non fenêtrés, de la barrière hémato-encéphalique [
3
]. Au contact des boucles de capillaires fenêtrés de l’éminence médiane s’intercalent également de nombreuses terminaisons axonales des cellules neuroendocrines, qui communiquent avec la glande hypophysaire par la sécrétion d’hormones peptidiques dans la circulation sanguine (système porte vasculaire hypothalamo-hypophysaire) [
6
]. Ainsi, l’éminence médiane est impliquée dans la libération de neurohormones et de neurotransmetteurs dans le sang, mais elle l’est également dans le passage de molécules provenant du sang vers leurs régions cérébrales cibles [
3
].
|
L’activation des neurones produisant l’hormone de mélano-concentration augmente la perméabilité des capillaires de l’éminence médiane
Les neurones synthétisant l’hormone de mélano-concentration (MCH) sont localisés dans l’aire hypothalamique latérale et la
zona incerta
du cerveau, où ils forment un réseau hautement interconnecté dans et au-delà de l’hypothalamus. Ces neurones sont impliqués dans le contrôle du flux de liquide cérébro-spinal, du comportement alimentaire (la MCH augmente la prise de nourriture), de l’activité locomotrice (la MCH la diminue), des cycles de sommeil, ainsi que dans l’homéostasie métabolique (la MCH diminue la dépense énergétique et induit adiposité, prise de poids et intolérance au glucose) [
7
,
8
].
Jiang et ses collègues, dans une étude réalisée chez la souris, ont testé l’hypothèse selon laquelle les neurones produisant la MCH pourraient moduler la plasticité de la barrière hémato-encéphalique de l’éminence médiane et réguler l’entrée de molécules circulantes dans le cerveau [
9
]. Ils ont montré que ces neurones se projettent vers l’éminence médiane et que leurs terminaisons axonales, qui s’intercalent avec les pieds des tanycytes, sont en contact étroit avec les boucles des capillaires fenêtrés [
9
].
Afin d’explorer le rôle fonctionnel de ces projections axonales, les auteurs ont induit, avec des outils de chimiogénétique, une activation des neurones produisant la MCH. Ils ont montré que cette activation avait pour conséquence l’entrée, dans l’éminence médiane et la partie ventro-médiane du noyau arqué de l’hypothalamus, d’un colorant (le bleu d’Evans) injecté dans la circulation sanguine, ce qui indiquait une augmentation de la perméabilité vasculaire à ces emplacements. Cette dernière n’était pas associée à des altérations des complexes de jonctions serrées des tanycytes, mais à une augmentation du nombre de fenestrations dans les capillaires [
9
].
|
L’activation des neurones produisant la MCH potentialise l’effet de la leptine sur la prise alimentaire
La leptine est une adipokine anorexigène. Cette hormone circule proportionnellement à la quantité de masse grasse d’un organisme. Elle passe du sang vers le parenchyme cérébral (ou vers le liquide cérébro-spinal) au niveau de l’éminence médiane, et active la phosphorylation du facteur de transcription STAT3 (
signal transducer and activator of transcription 3
) dans ses neurones cibles, notamment dans le noyau arqué hypothalamique [
5
]. Il en résulte une augmentation de la dépense énergétique et une diminution de la prise alimentaire. Puisque le rôle des neurones produisant la MCH dans l’homéostasie énergétique repose sur la détection de signaux circulants tels que la leptine, les auteurs ont cherché à savoir si l’activation de ces neurones augmentait les effets de l’administration périphérique exogène de cette hormone. Ils ont montré que l’activation chimiogénétique des neurones produisant la MCH, après une injection intrapéritonéale de leptine, induit une augmentation de phospho-STAT3 dans le noyau arqué de l’hypothalamus et a un effet inhibiteur sur la prise alimentaire [
9
].
Les neurones produisant la MCH sécrètent des neurotransmetteurs, qui agissent sur un réseau neuronal dense. La modulation de la perméabilité de la barrière hémato-encéphalique de l’éminence médiane par les neurones produisant la MCH et leur action sur l’effet de la leptine pourraient donc être véhiculés par ces réseaux neuronaux, mais pourraient aussi résulter de l’intervention directe des projections axonales des neurones produisant la MCH sur l’éminence médiane. Pour résoudre cette question, les chercheurs ont ciblé spécifiquement ces terminaisons axonales
in vivo,
chez la souris, en utilisant des outils d’optogénétique. L’activation optogénétique de ces projections a provoqué une augmentation de la perméabilité des capillaires de l’éminence médiane et de la sensibilité à la leptine. Ce résultat atteste l’implication des projections des neurones produisant la MCH, sur l’éminence médiane, dans les effets de la leptine et dans la variation concomitante de la perméabilité des capillaires de cette région hypothalamique [
9
].
|
L’effet des neurones produisant la MCH sur la barrière hémato-encéphalique de l’éminence médiane n’est pas véhiculé par les tanycytes
Restait à préciser le mécanisme par lequel l’activité des neurones produisant la MCH augmente la perméabilité vasculaire dans l’éminence médiane. L’implication des tanycytes, dont les pieds sont situés à proximité des terminaisons axonales des neurones produisant la MCH, a été la première hypothèse envisagée. Notamment parce qu’il avait été montré auparavant que la MCH peut moduler le battement ciliaire des épendymocytes « classiques » (cellules cuboïdes ciliées) tapissant la paroi du troisième ventricule dans la région dorsale de la partie tubéreuse de l’hypothalamus [
10
], et que les tanycytes agissent sur la fenestration de l’endothélium des capillaires [
4
]. Pour tester cette hypothèse, des cultures primaires de tanycytes ont été exposées aux sécrétions de neurones produisant la MCH, et une imagerie calcique a été pratiquée sur des tranches d’éminence médiane exposées à la MCH
ex vivo
. Étonnamment, aucune modification de la signalisation ni de la concentration calcique intracellulaire des tanycytes n’a été observée dans ces expériences [
9
]. Ces résultats suggèrent que les neurones produisant la MCH ne modulent pas la perméabilité des anses vasculaires de l’éminence médiane par l’intermédiaire des tanycytes.
|
L’augmentation de la perméabilité des capillaires de l’éminence médiane par les neurones produisant la MCH implique la sécrétion de VEGFA
Des expériences fondées sur l’utilisation de la technique phosphoRiboTrap
1,
ont révélé que l’activation des neurones produisant la MCH entraîne une altération de la signalisation mTOR dans les cellules endothéliales [
9
]. Rappelons que les auteurs avaient précédemment montré que ces neurones projettent leurs axones vers les tanycytes, mais aussi directement vers les capillaires fenêtrés. Pour identifier les signaux émis par les neurones produisant la MCH et agissant sur les cellules endothéliales, un séquençage de leurs ARN messagers (ARNm) a été réalisé. L’analyse de leur profil transcriptomique a révélé un enrichissement des transcrits de gènes impliqués dans le contrôle de la voie de signalisation par le facteur de croissance endothélial vasculaire (VEGF) [
9
]. Or on savait déjà que l’isoforme A du VEGF (VEGF-A) agit sur les structures endothéliales impliquées dans la fenestration des vaisseaux capillaires [
4
]. Par des approches complémentaires, les auteurs ont montré que les neurones produisant la MCH synthétisent cette isoforme du VEGF. En inhibant pharmacologiquement, par l’axitinib, les récepteurs (VEGFR) impliqués dans la signalisation par ce facteur de croissance, ils ont observé une atténuation de la capacité de ces neurones à augmenter la sensibilité de la signalisation induite par la leptine périphérique. Ces résultats impliquent que ce facteur est responsable, au moins en partie, de l’augmentation de la perméabilité capillaire de la barrière hémato-encéphalique de l’éminence médiane
(
Figure 1
)
.
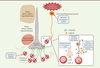 | Figure 1.
Régulation de la perméabilité des anses vasculaires de l’éminence médiane par les neurones produisant la MCH.
Les neurones produisant l’hormone de mélano-concentration (MCH) situés dans la zone hypothalamique latérale envoient des projections axonales vers les capillaires fenêtrés et les tanycytes (cellules gliales) de l’éminence médiane. L’activation chimiogénétique ou optogénétique des neurones produisant la MCH
(1)
induit une libération de facteur de croissance endothélial vasculaire A (VEGF-A)
(2)
, une molécule pouvant augmenter la fenestration des capillaires, donc leur perméabilité
(3)
. Jiang et ses collègues montrent que cela s’accompagne d’une potentialisation de l’effet de la leptine, une adipokine anorexigène, dont l’entrée dans le parenchyme cérébral, vraisemblablement par le biais des tanycytes
(4)
, ou encore par diffusion passive dans le noyau arqué hypothalamique, est alors facilitée.
|
|
Cette étude de Jiang et collègues [
9
] a révélé l’existence d’un mécanisme neurogène régulant l’accès au parenchyme cérébral des substances véhiculées par le sang, grâce à un remodelage des structures capillaires impliquant le VEGF-A. L’activation des neurones de l’hypothalamus produisant la MCH augmente la perméabilité des capillaires de l’éminence médiane. Cela facilite notamment la diffusion de la leptine vers des populations de neurones impliqués dans l’homéostasie énergétique, et potentialise l’effet de cette hormone. Les résultats de cette étude suggèrent que les projections neurovasculaires sont impliquées dans la perméabilité d’autres organes circumventriculaires qui assurent également des fonctions homéostatiques [
3
]. Ce mécanisme pourrait favoriser non seulement le passage de substances du sang vers le cerveau, mais aussi dans le sens inverse. Dans cette étude, l’augmentation de la perméabilité vasculaire de l’éminence médiane a été induite par une activation artificielle massive des neurones produisant la MCH. Reste à savoir si l’activité physiologique de ces neurones a le même effet. Enfin, se pourrait-il qu’une perturbation du remodelage de la barrière hémato-encéphalique de l’éminence médiane par ces neurones contribue à la résistance à la leptine en limitant l’accès de cette hormone au parenchyme cérébral ? Ou même, explique certaines comorbidités, telles que les troubles du sommeil, chez les patients obèses ? Et si tel est le cas, un ciblage thérapeutique pharmacologique de ce mécanisme de contrôle de la perméabilité des capillaires pourrait-il être envisagé ?
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Worzfeld
T
,
Schwaninger
M
.
Apicobasal polarity of brain endothelial cells.
.
J Cereb Blood Flow Metab.
2016;
;
36
:
:340.
–
362
.
2.
Banks
W
.
The blood-brain barrier as an endocrine tissue.
.
Nat Rev Endocrinol.
2019;
;
15
:
:444.
–
455
.
3.
Prevot
V
,
Nogueiras
R
,
Schwaninger
M
.
Tanycytes in the infundibular nucleus and median eminence and their role in the blood-brain barrier.
.
Handb Clin Neurol.
2021;
;
180
:
:253.
–
73
.
4.
Langlet
F
,
Levin
BE
,
Luquet
S
et al.
Tanycytic VEGF-A boosts blood hypothalamus barrier plasticity and access of metabolic signals to the arcuate nucleus in response to fasting.
.
Cell Metab.
2013;
;
17
:
:607.
–
617
.
5.
Duquenne
M
,
Folgueira
C
,
Bourouh
C
,
et al.
Leptin brain entry via a tanycytic LepR-EGFR shuttle controls lipid metabolism and pancreas function.
.
Nat Metab.
2021;
;
3
:
:1071.
–
90
.
6.
Prévot
V
,
Dehouck
B
,
Sharif
A
et al.
The versatile tanycyte : a hypothalamic integrator of reproduction and energy metabolism.
.
Endocr Rev.
2018;
;
39
:
:333.
–
368
.
7.
Hassani
O
,
Gee Lee
M
,
E Jones
B
.
Melanin-concentrating hormone neurons discharge in a reciprocal manner to orexin neurons across the sleep-wake cycle.
.
Proc Natl Acad Sci USA.
2009;
;
106
:
:2418.
–
22
.
8.
Al-Massadi
O
,
Dieguez
C
,
Schneeberger
M
,
et al.
Multifaceted actions of melanin-concentrating hormone on mammalian energy homeostasis.
.
Nat Rev Endocrinol.
2021
;
https://doi.org/10.1038/s41574-021-00559-1
.
9.
Jiang
H
,
Gallet
S
,
Klemm
P
,
et al.
MCH neurons regulate permeability of the median eminence barrier.
.
Neuron.
2020;
;
107
:
:1.
–
14
.
10.
Conductier
G
,
Brau
F
,
Viola
A
et al.
Melanin-concentrating hormone regulates beat frequency of ependymal cilia and ventricular volume.
.
Nat Neurosci.
2013;
;
16
:
:845.
–
847
.
|