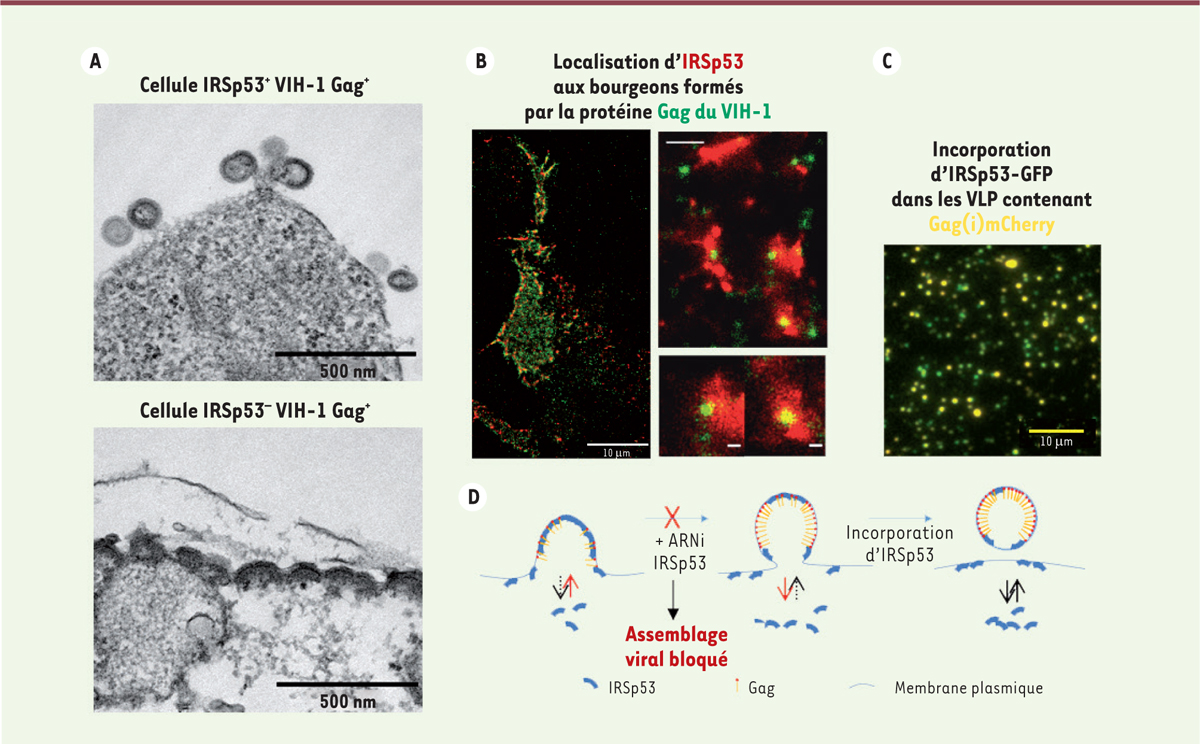
La production des particules virales du virus de l’immunodéficience humaine de type 1 (VIH-1) par la cellule infectée résulte-t-elle uniquement de la multimérisation de la poly-protéine virale Gag à la face interne de la membrane plasmique, comme le pensent la plupart des chercheurs [ 1 , 2 ] ? On sait que la courbure de la membrane plasmique est une caractéristique critique pour la formation de vésicules dans les cellules, et qu’elle est requise pour la formation du nouveau virion VIH-1, dont le diamètre est toujours d’environ 100 à 150 nm. La taille et la forme des virus enveloppés dépendent donc de leur capacité à courber les membranes vers l’extérieur. Dans le cas du rétrovirus VIH-1, la protéine virale Gag est le principal moteur de l’assemblage des virions via la reconnaissance puis le recrutement du phospholipide phosphatidylinositol - 4, 5 biphosphate (PIP2), et du cholestérol dans une moindre mesure, au feuillet interne de la membrane plasmique du lymphocyte T infecté [ 3 , 4 ]. Néanmoins, les résultats de certaines études ont montré que l’auto-assemblage de Gag pourrait ne pas suffire à surmonter la barrière énergétique de courbure et de tension de la membrane cellulaire pour produire la courbure finale de la nouvelle particule virale [ 5 ]. De plus, il a été rapporté que l’assemblage et le bourgeonnement de la protéine Gag du VIH-1 à la membrane cellulaire n’est pas très efficace lorsque cette membrane est observée par microscopie TIRF ( total internal reflection fluorescence microscope ) ; le taux d’échec de la formation complète des particules virales semble assez élevé [ 2 , 6 ], ce qui suggère que le bourgeonnement produisant ces particules n’est pas en lui-même un processus très efficace. Grâce à la microscopie de fluorescence par réflexion totale interne, nous avons évalué à cinq minutes le temps d’assemblage de la particule virale du VIH-1 dans les lymphocytes T CD4 + , puis à 10-15 minutes supplémentaires le temps nécessaire au bourgeonnement total de la particule virale [ 1 , 6 ], comme cela a été décrit pour les lignées cellulaires adhérentes [ 2 ]. Le mécanisme par lequel le virus VIH-1 surmonte la barrière énergétique associée à la formation d’une forte courbure membranaire lors du bourgeonnement viral reste donc à élucider, et une ou plusieurs protéines cellulaires pourraient y contribuer [ 7 ]. En effet, de nombreuses protéines ont un rôle majeur dans l’induction ou la reconnaissance des courbures de la membrane plasmique, que ce soit vers l’intérieur ou vers l’extérieur [ 8 ]. Nous avons ainsi montré que la protéine d’assemblage Gag du virus est capable de détourner la fonction de courbure membranaire du cofacteur de l’actine corticale IRSp53 ( insulin receptor substrate protein of 53 kDa ) pour compléter l’assemblage de la particule virale [ 9 ]. IRSp53 appartient à la famille des protéines à domaine BAR ( Bin/amphiphysin/Rvs ) inversé (I-BAR), spécialisées dans la courbure des membranes pour former des protrusions membranaires dirigées vers l’extérieur de la cellule (par exemple, les filopodes), et dont l’activité dépend des petites RhoGTPases Rac1 et Cdc42 [ 8 , 10 ]. Nous avons découvert quelle protéine de la voie de signalisation Rac1-IRSp53-Wave2-Arp2/3, précédemment décrite [ 7 ], est impliquée dans la relargage des particules virales. Nous proposons un mécanisme compatible avec la capacité unique de IRSp53 à interagir spontanément avec les membranes chargées en PIP2 pour les courber localement [ 8 , 9 ], et à détecter les courbures membranaires négatives [ 10 ]. En utilisant des techniques de biologie moléculaire, de biochimie et de biophysique combinées à la microscopie électronique et à la microscopie de fluorescence en super résolution dans des cellules modèles et des lymphocytes T CD4 + infectés par le VIH-1, nous avons montré que la protéine Gag du virus VIH-1 s’associe au domaine I-BAR d’IRSp53, dont elle subvertit la fonction de courbure membranaire afin de favoriser la formation complète des particules virales, indépendamment de l’activité des ESCRT ( endosomal sorting complexes required for transport ) impliquées dans le bourgeonnement final de ces particules [ 1 , 9 ]. Par une technique d’interférence ARN (ARNi) ciblant le gène codant IRSp53, nous avons montré que la réduction de l’expression de ce gène entraîne une diminution de la production des particules virales dans les lymphocytes T CD4 + infectés et dans des lignées cellulaires modèles n’exprimant que la protéine d’assemblage Gag. De plus, l’extinction du gène codant IRSp53 entraîne un arrêt du bourgeonnement du virus à mi-parcours ( Figure 1A ) . L’analyse de molécule unique par microscopie de super-résolution en fluorescence [ 1 ] nous a ensuite permis de montrer la présence d’IRSp53 à proximité du bourgeon viral, autour des sites d’assemblage de la protéine Gag ( Figure 1B ) , ce qui diffère de la localisation d’une autre protéine I-BAR membranaire de la même famille, IRTKS ( insulin receptor tyrosine kinase substrate ) [ 9 ]. Finalement nous avons montré que IRSp53 interagit avec la protéine Gag et est spécifiquement incorporée dans les particules virales ( Figure 1C ) , à la différence d’IRTKS [ 9 ]. Ainsi, la protéine cellulaire IRSp53, qui a la propriété de courber la membrane plasmique, est nécessaire à la progression de la courbure membranaire de la particule virale de VIH-1 en formation ( Figure 1D ) . IRSp53 pourrait jouer des rôles différents et complémentaires à différentes étapes de ce processus d’assemblage des virions, en favorisant l’attraction des oligomères de Gag à la membrane grâce à la déformation locale de cette dernière ou par recrutement du PIP2 et en abaissant la barrière énergétique de la flexion de la membrane lors de l’assemblage de la particule virale, favorisant ainsi son bourgeonnement. Ces mécanismes moléculaires dépendent vraisemblablement de la présence, dans la membrane plasmique, du phospholipide PIP2, qui se lie à la fois à Gag et à IRSp53. L’expression de Gag dans les lymphocytes T CD4 + entraîne une activation de la protéine Rac1 permettant le maintien de l’accrochage de Gag à la membrane [ 7 ] et le recrutement membranaire d’IRSp53 [ 9 ]. Finalement, cette étape pourrait s’accompagner de la polymérisation locale de l’actine corticale sous-jacente, avec laquelle IRSp53 interagit. En effet, IRSp53 peut à son tour recruter la protéine WAVE2 ( Wiskott-Aldrich syndrome protein-family verprolin homologous protein 2 ), qui déclencherait alors une polymérisation de l’actine corticale facilitant les déformations membranaires [ 7 , 8 ] et le relargage de la particule virale.
| Figure 1.
Interaction entre la protéine cellulaire IRSp53 et la protéine Gag du virus VIH-1 au site de bourgeonnement des virions. (A)
Images, obtenues par microscopie électronique, du bourgeonnement de la protéine Gag dans des cellules exprimant la protéine IRSp53 (IRSp53
+
) ou dans des cellules où cette expression est inhibée par un ARN interférent (IRSp53
-
). En l’absence de IRSp53, le bourgeonnement des particules virales à la surface des cellules est bloqué. Barre d’échelle = 500 nm. D’après [
9
]. Crédit photos à Philippe Roingeard (Université de Tours).
(B)
Images de super-résolution des zones d’assemblage et de bourgeonnement de la protéine Gag et localisation de la protéine IRSp53 à la membrane des cellules, montrant la proximité de IRSp53 (en rouge) avec le site d’assemblage de Gag (en vert) à la surface cellulaire (microscopie TIRF et de super résolution double couleur PALM/STORM. Barre d’échelle = 10 µm. Crédit images à Kaushik Inamdar (IRIM CNRS Montpellier).
(C)
Image, obtenue par microscopie TIRF, de particules pseudo-virales (VLP) fluorescentes contenant la protéine de fusion Gag-(i)mCherry (fluorescence rouge) et la protéine de fusion IRSp53-GFP (fluorescence verte). La protéine IRSp53-GFP exogène est incorporée dans toutes les particules formées par Gag et Gag(i)mCherry au cours de leur assemblage (fluorescence jaune). Barre d’échelle = 10 µm.
(D)
Schéma de la progression de l’assemblage des particules virales à la membrane plasmique des cellules infectées. La déformation membranaire induite par les protéines virales Gag conjointement avec la protéine cellulaire IRSp53 catalyse le bourgeonnement de la particule virale et entraîne l’incorporation de IRSp53 dans cette particule formée de protéines Gag du VIH-1 ou du virus sauvage (voir [
9
]). En revanche, l’inhibition de l’expression du gène codant IRSp53 par la technique d’interférence ARN (ARNi) empêche le passage de la barrière énergétique permettant la flexion membranaire et entraîne un arrêt de l’assemblage et du bourgeonnement de la particule virale à la membrane de la cellule infectée.
|