| |
| Med Sci (Paris). 38(2): 230–232. doi: 10.1051/medsci/2022013.Inhibition des réponses immunitaires anti-tumorales par NF-κB Vers un ciblage thérapeutique ? Lara Revol-Bauz1* and Yenkel Grinberg-Bleyer2** 1Master de cancérologie, module d’immunologie - virologie, université Claude Bernard Lyon 1
,
Lyon
,
France 2Centre de recherche en cancérologie de Lyon, UMR Inserm 1052, CNRS 5286, centre Léon Bérard, université Claude Bernard Lyon 1
,
Lyon
,
France MeSH keywords: Lignée cellulaire tumorale, Humains, Facteur de transcription NF-kappa B |
Les travaux des dernières années ont formellement établi le lien entre croissance tumorale et qualité de la réponse immunitaire. Ces études ont notamment permis le développement et l’utilisation en clinique de différentes immunothérapies, notamment l’utilisation d’inhibiteurs de points de contrôle immunitaire, qui ont révolutionné la prise en charge de certains cancers [
1
] (
→
).
(→) Voir la Synthèse de M. Dubois
et al., m/s
n° 12, décembre 2019, page 937
Néanmoins, les voies de signalisation et les facteurs de transcription impliqués dans les réponses pro- et anti-tumorales restent imparfaitement définis. Historiquement, le facteur de transcription NF-κB (
nuclear factor kappa-light-chain-enhancer of activated B cells
) a été décrit comme un modulateur majeur des réponses immunitaires innées et adaptatives [
2
]. NF-κB est un complexe multi-moléculaire constitué de plusieurs sous-unités qui fonctionnent sous la forme de différents homo- ou hétérodimères : les sous-unités NF-κB1, RelA et c-Rel de la voie canonique ; et les sous-unités NF-κB2 et RelB de la voie alternative. Le rôle spécifique de chacune des protéines, qui sont des facteurs de transcription, reste mal compris, mais plusieurs études récentes ont mis en évidence un rôle délétère de différentes sous-unités au cours du processus d’échappement des tumeurs au système immunitaire.
|
La sous-unité c-Rel favorise la fonction des populations immunitaires suppressives
Deux études ont récemment illustré les rôles critiques de la sous-unité c-Rel de NF-κB dans l’inhibition des réponses anti-tumorales reposant sur les lymphocytes T (LT) régulateurs exprimant Foxp3
+
(LTreg) et les cellules suppressives myéloïdes MDSC (
myeloid-derived suppressor cells
) [
3
] (
→
).
(→) Voir la Synthèse de M. Bruchard et F. Ghiringhelli,
m/s
n° 4, avril 2014, page 429
La première étude a révélé que l’ablation spécifique de c-Rel dans les LTreg, dans un modèle de souris Foxp3
Cre
x c-Rel
flox/flox
transplantées avec des mélanomes, diminue l’activation de ces cellules suppressives et induit l’expression de cytokines pro-inflammatoires normalement pas exprimées par les LTreg [
4
]
(
Figure 1
)
. En levant l’inhibition de la réponse anti-tumorale par les LTreg, cette absence de c-Rel conduit ainsi à une importante réduction de la croissance tumorale. Confirmant ce rôle inhibiteur de c-Rel dans l’immunité anti-tumorale, l’équipe de Youhai Chen a ensuite démontré le rôle pivot de c-Rel dans le maintien du métabolisme et de la fonction suppressive des MDSC dans la tumeur. c-Rel contrôle notamment l’expression de gènes associés à l’immunosuppression comme celui codant l’interleukine(IL)-10) [
5
]. Ainsi les souris LysM
Cre
x c-Rel
flox/flox
, dans lesquelles le gène codant c-Rel est éliminé spécifiquement dans les cellules myéloïdes, présentent une amélioration de l’immunité anti-tumorale et une diminution de la progression du mélanome. D’un point de vue thérapeutique, l’administration d’inhibiteurs de c-Rel, comme la pentoxifylline (un dérivé de xanthine induisant la dégradation de c-Rel) ou le composé R96A (une petite molécule inhibant la liaison de c-Rel à l’ADN), réduit significativement la croissance tumorale dans le mélanome chez la souris ; de plus, ces composés potentialisent les effets de l’immunothérapie par anticorps anti-PD-1 (
programmed cell death-1
). Ces premières données mettent en évidence l’intérêt de la caractérisation précise de la fonction de chacune des sous-unités de NF-κB en onco-immunologie. Ces travaux sur c-Rel ont récemment été complétés par une analyse du rôle de NF-κB1.
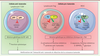 | Figure 1.
Rôles inhibiteurs de NF-κB1 et c-Rel dans l’immunité anti-tumorale.
Alors que NF-κB1 inhibe la fonction cytotoxique des lymphocytes T CD8
+
en réprimant l’expression du granzyme B, c-Rel favorise l’expansion et l’activité suppressive des lymphocytes T régulateurs (LTreg) et des MDSC (
myeloid-derived suppressor cells
) et inhibe leur expression de cytokines inflammatoires. En conséquence, l’ablation ou l’inhibition de c-Rel et de NF-κB1 permet l’amélioration des réponses anti-tumorales chez la souris. OXPHOS : phosphorylation oxydative ;
Gzmb
: granzyme B ;
Ifng
: interféron-gamma,
Tnf
:
tumor necrosis factor-alpha
;
Ikzf2
: Helios ;
Ikzf4
: Eos ;
Il1b
: interleukine 1-beta ;
Cebpb
:
CCAAT/enhancer-binding protein beta
;
Arg1
: Arginase ;
Il10
: interleukine-10.
|
|
La sous-unité NF-κB1 promeut la progression du cancer colorectal chez la souris
Dans une étude publiée en 2020, Lu
et al.
se sont intéressés au rôle de la sous-unité NF-κB1 sur la réponse lymphocytaire T dans un modèle de cancer colorectal (CRC) induit par une inflammation chronique [
6
]. Avant toute stimulation cellulaire, NF-κB1, protéine ubiquitaire, est retenue dans le cytoplasme dans sa forme entière, la protéine p105. Après stimulation, la forme clivée p50 de NF-kB1 est transloquée dans le noyau où elle se lie au promoteur des gènes dont elle induit l’expression.
Les auteurs ont observé tout d’abord par EMSA (
electromotility shift assay
) une forte activation de la voie NF-κB, en particulier de p50, dans le côlon des souris atteintes de CRC. De même, l’analyse par immunohistochimie du microenvironnement tumoral de patients atteints de CRC a mis en évidence une activation de NF-κB1 dans les cellules immunitaires et, dans une moindre mesure, dans les cellules tumorales. Ces résultats ont conduit à questionner le rôle de la sous-unité NF-κB1 dans la tumorigenèse et la réponse immunitaire anti-tumorale. Pour étudier cette question, Lu
et al.
ont alors analysé l’effet de la délétion du gène
Nfkb1 (
codant la sous-unité NF-κB1) sur la croissance tumorale. En utilisant un modèle de tumeur induite par plusieurs cycles de traitement par une combinaison de molécules qui provoque une inflammation du côlon et induit le développement de tumeurs (AOM-DSS [azoxyméthane - dextran-sulfate de sodium]), ces chercheurs ont montré une réduction significative du nombre de nodules chez les souris
Nfkb1
-knock-out (KO) par rapport aux souris témoins. Des résultats similaires ont été observés dans un modèle d’adénocarcinome de côlon àù les cellules MC-38 sont injectées par voie sous-cutanée. Ces résultats suggèrent que NF-κB1 a un rôle pro-tumoral et favorise le développement du CRC. Dans ce modèle, la diminution de la croissance tumorale que l’on observe peut être liée à l’absence d’expression de NF-κB1 dans les cellules épithéliales de l’intestin ou dans les cellules du système immunitaire, ou dans les deux types de cellules. Pour répondre à cette question, les auteurs ont utilisé un modèle de chimères de moelle osseuse, pour restreindre l’invalidation de
Nfkb1
au système hématopoïétique. Ces expériences ont montré que les souris dont le gène
Nfkb1
a été invalidé spécifiquement dans les cellules hématopoïétiques, présentent significativement moins de nodules que les souris témoins. À l’inverse, l’ablation du gène dans les cellules tumorales, en utilisant la technique CRISPR/Cas9, semble accélérer leur croissance. Cela montre que l’expression de NF-κB1 dans les cellules immunitaires a une fonction pro-tumorale.
|
NF-κB1 inhibe l'expression du granzyme B par les lymphocytes T cytotoxiques
Afin de comprendre les mécanismes moléculaires contrôlés par NF-κB1 et responsables du contrôle de la croissance tumorale, les auteurs ont analysé le transcriptome et le phénotype immunitaire des tumeurs issues de souris témoins et de souris
Nfkb1
-KO traitées par AOM-DSS. Parmi les nombreux gènes dont l'expression est affectée par NF-κB1, l'expression du gène codant le granzyme B est significativement augmentée dans les tumeurs de souris
Nfkb1
-KO, à la fois en termes de transcription en ARN et de traduction en protéine, alors que la proportion de LT CD8
+
reste inchangée. Cela suggère que NF-κB1 réprime l'expression du gène codant le granzyme B, une molécule importante pour l'activité cytotoxique des LT. Pour confirmer ces résultats, l'expression du granzyme B par les LT après restimulation
in vitro
, a été évaluée par cytométrie en flux. À nouveau, les LT dont le gène
NFKB1
a été invalidé expriment un niveau plus important de granzyme B. En ce qui concerne les mécanismes moléculaires impliqués, les auteurs ont montré, par des expériences d'immuno-précipitation de la chromatine, que NF-κB1 est capable de se fixer directement au promoteur du gène codant le granzyme B, suggérant une répression directe de la transcription du gène.
Les auteurs ont ensuite évalué la fonction de NF-κB1 dans la réponse aux immunothérapies effectuées avec des anticorps anti-PD-1. Alors que l'anticorps anti-PD-1 induit une forte diminution du volume des tumeurs MC-38 dans des souris témoins, l'effet bénéfique de la délétion de
NFKB1
n'est pas accru par l'immunothérapie. Ces résultats suggèrent que l'ablation de
Nfkb1
et l'anticorps anti-PD1 activent un programme cytotoxique similaire dans les LT. Enfin, à partir de leurs propres données, les auteurs établissent tout d'abord une signature de gènes contrôlés par NF-κB1. La comparaison de cette signature spécifique avec la base de données TCGA, qui collecte les données transcriptomiques de patients atteints de cancers, montre une corrélation inverse entre l'expression du granzyme B et la signature NF-κB1 chez les patients atteints de CRC. Enfin, chez les patients atteints de mélanome et traités par un anticorps anti-PD-1 (nivolumab), on peut observer une baisse du score NF-κB1 et une augmentation de l'expression du granzyme B.
Ce travail apporte un éclairage nouveau sur le rôle spécifique de NF-κB1 dans la réponse lymphocytaire T anti-tumorale. Toutefois, certains mécanismes moléculaires et cellulaires restent à élucider :
-
NF-κB1, à la fois
via
sa forme native p105 et sa forme active p50, semble agir comme un répresseur de l'activité des LT CD8
+
. À l'inverse, RelA et c-Rel sont des régulateurs «positifs» de nombreuses fonctions des LT, en particulier la prolifération et la production de cytokines comme l'IL-2 [
7
]. Il semble donc indispensable d'élucider le rôle de ces deux sous-unités dans la fonction anti-tumorale des LT cytotoxiques, afin de conclure quant au rôle de NF-κB dans ce contexte.
-
Dans l'étude de Lu
et al.
, les fonctions intrinsèques de NF-κB dans les différentes sous-populations de LT, en particulier les LT CD8
+
cytotoxiques, ne sont pas clairement élucidées. En effet, dans le modèle
Nfkb1-
KO, le gène est inactivé dans toutes les cellules de l'organisme. Les effets délétères de NF-κB1 pourraient donc reposer sur d'autres populations immunitaires, notamment les LTreg ou les MDSC.
|
Vers un ciblage des sous-unités de NF-κB pour une immunothérapie du cancer ?
Ces données suggèrent un rôle délétère de NF-κB1 et de c-Rel dans la progression tumorale,
via
l'effet de ces deux facteurs de transcription dans différentes populations immunitaires
(
Figure 1
)
. Cela fournit un nouveau rationnel pour le ciblage de ces protéines qui semble être prometteur pour développer une thérapie anti-cancéreuse. L'inhibition totale de NF-kB a déjà été envisagée à de multiples reprises dans le passé du fait du rôle délétère de la voie NF-κB dans la progression tumorale et le processus métastatique, mais le manque de spécificité de cette approche globale a représenté un frein majeur [
8
]. Afin de développer des traitements spécifiques et de s'assurer de leurs efficacité et de leur sûreté, il serait néanmoins important de disséquer la fonction des différentes sous-unités de NF-κB, notamment celles impliquées dans la voie alternative, à la fois dans les cellules cytotoxiques, dans les cellules immunomodulatrices et dans les cellules tumorales elles-mêmes.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Dubois
M
,
Ardin
C
,
Andre
F
,
et al.
L’immunothérapie, une révolution en oncologie - Revue de l’efficacité des inhibiteurs de points de contrôle immunitaire.
.
Med Sci (Paris).
2019;
;
35
:
:937.
–
45
.
2.
Taniguchi
K
,
Karin
M
.
NF-κB, inflammation, immunity and cancer: coming of age.
.
Nat Rev Immunol.
2018;
;
18
:
:309.
–
24
.
3.
Bruchard
M
,
Ghiringhelli
F
.
Microenvironnement tumoral : cellules régulatrices et cytokines immunosuppressives.
.
Med Sci (Paris).
2014;
;
30
:
:429.
–
35
.
4.
Grinberg-Bleyer
Y
,
Oh
H
,
Desrichard
A
,
et al.
NF-κB c-Rel is crucial for the regulatory T cell immune checkpoint in cancer.
.
Cell.
2017;
;
170
:
:1096.
–
108.e13
.
5.
Li
T
,
Li
X
,
Zamani
A
,
et al.
c-Rel is a myeloid checkpoint for cancer immunotherapy.
.
Nat Cancer.
2020;
;
1
:
:507.
–
17
.
6.
Lu
C
,
Klement
JD
,
Smith
AD
,
et al.
p50 suppresses cytotoxic T lymphocyte effector function to regulate tumor immune escape and response to immunotherapy.
.
J Immunother Cancer.
2020;
;
8
:
:e001365.
.
7.
Lalle
G
,
Twardowski
J
,
Grinberg-Bleyer
Y
.
NF-κB in cancer immunity: friend or foe?
Cells.
2021;
;
10
:
:355.
.
8.
Baud
V
,
Karin
M
.
Is NF-κB a good target for cancer therapy? Hopes and pitfalls.
.
Nat Rev Drug Discov.
2009;
;
8
:
:33.
–
40
.
|