| |
| Med Sci (Paris). 38(2): 227–229. doi: 10.1051/medsci/2022012.
Une coopération moléculaire originale régule la fonction immunosuppressive des lymphocytes T régulateurs CD8
+
Axel Conchon1* and Saidi Soudja2** 1Master 1 Cancer, université Claude Bernard Lyon 1
,
France 2Centre de recherche en cancérologie de Lyon
,
France MeSH keywords: Lymphocytes T CD8+, Humains, Immunosuppresseurs, Lymphocytes T régulateurs |
Les lymphocytes T régulateurs CD8+, une nouvelle population encore mal définie
Les lymphocytes T régulateurs (Treg) représentent une population essentielle au bon fonctionnement du système immunitaire. En effet, si l’immunité des vertébrés permet d’éliminer les menaces microbiologiques ou cellulaires pouvant altérer l’intégrité de l’organisme, elle peut aussi avoir des effets délétères, tels qu’une inflammation excessive, des maladies auto-immunes ou des allergies [
1
]. Il est donc nécessaire de contrôler le système immunitaire. C’est là qu’interviennent les capacités immunosuppressives des lymphocytes Treg. Initialement caractérisés comme une sous-population de lymphocytes T CD4
+
exprimant le facteur de transcription Foxp3 ainsi que la chaîne α du récepteur de l’IL-2 (Interleukine-2), CD25 [
2
], les lymphocytes Treg CD4
+
permettent de réguler négativement le système immunitaire, notamment par la production de molécules et de cytokines immunosuppressives, telles que le TGF-β (
transforming growth factor-β
) ou l’interleukine (IL)-10, ou par la consommation de l’IL-2 [
3
].
De nombreuses autres populations de lymphocytes Treg exprimant des marqueurs non canoniques furent par la suite identifiées, en particulier les lymphocytes Treg CD8
+
dont les fonctions ne sont pas totalement élucidées. Cependant, de récents travaux ont permis de montrer leur rôle dans le maintien de la tolérance face aux antigènes du soi et dans le contrôle de l’auto-immunité dans les centres germinatifs, des structures anatomiques apparaissant dans les organes lymphoïdes secondaires et qui permettent l’activation, la maturation et la prolifération des lymphocytes B. Il a été montré que les lymphocytes Treg CD8
+
régulent les centres germinatifs par l’inhibition des lymphocytes T
FH
(
T follicular helper
) qui permettent normalement la différenciation et la maturation des lymphocytes B [
4
]. D’autres équipes, comme celle de Gupta, ont mis en évidence la capacité des lymphocytes Treg CD8
+
à inhiber les lymphocytes B et leur production d’immunoglobulines
via
une interaction cellulaire directe et des médiateurs solubles [
5
].
Les mécanismes immunosuppresseurs exercés par les lymphocytes Treg CD8
+
sont peu décrits, mais il a été montré que ces cellules inhibent la sécrétion d’IFN-γ (interféron gamma) par les lymphocytes T CD4
+
[
6
] et qu’elles sécrètent des cytokines inhibitrices, comme l’IL-10 [
7
]. Au niveau moléculaire, les lymphocytes Treg CD8
+
forment une population très hétérogène avec des marqueurs divers, comme CD122, Ly-49, PD-1 ou encore des molécules du complexe majeur d’histocompatibilité non classiques, comme Qa-1 [
8
].
Ces données récentes sur les lymphocytes Treg CD8
+
permettent de réexaminer les fonctions des lymphocytes T CD8
+
longtemps considérées comme des cellules uniquement pro-inflammatoires et cytotoxiques. Cependant, la population des lymphocytes Treg CD8
+
reste sujette à controverse en raison du manque de caractérisation de son phénotype, de sa régulation et de ses effets immunosuppresseurs. De plus, il n’y a pas de consensus quant au rôle déterminant de ces lymphocytes Treg puisque ces derniers pourraient avoir des fonctions redondantes avec les lymphocytes Treg CD4
+
, notamment les lymphocytes CD4
+
T
FR
(
T follicular regulatory
) qui inhibent l’activation et la maturation des lymphocytes B par les lymphocytes T
FH
. C’est dans ce contexte que l’équipe de chercheurs dirigée par Nu Zhang a publié dans le
Journal of Experimental Medicine
[
9
] une étude pour mieux caractériser la régulation et l’action de ces lymphocytes Treg CD8
+
.
|
Régulation des lymphocytes Treg CD8+ par l’action conjuguée du TGF-β et du facteur de transcription Eomes
La découverte des mécanismes moléculaires régulant l’homéostasie des lymphocytes Treg CD8
+
est fortuite. L’équipe de Nu Zhang cherchait initialement à comprendre les interférences entre la signalisation du TGF-β, qui est une cytokine immunosuppressive clé régulant l’activation des lymphocytes T, et Eomes, un facteur de transcription impliqué dans l’activation et la différentiation des lymphocytes T matures. Pour cela, les chercheurs ont généré des souris doublement déficientes dans les lymphocytes T : ils ont invalidé les gènes codant la chaîne II du récepteur du TGF-β, rendant les lymphocytes T de ces animaux insensibles au TGF-β, et le facteur de transcription Eomes. Étonnamment, ils ont observé une mortalité accrue du fait d’une auto-immunité létale chez ces souris doublement déficientes, associée à une hyperplasie de la rate, à la présence de nodules et à la formation spontanée de centres germinatifs [
9
]. En analysant le nombre de lymphocytes Treg chez ces souris, les chercheurs ont observé une chute drastique des lymphocytes Treg CD8
+
(définis par les marqueurs CD8
+
, Ly49
+
et CD122
hi
) alors que le nombre de lymphocytes Treg CD4
+
restait inchangé par rapport à celui des animaux témoins. Ces résultats suggèrent donc que le TGF-β et Eomes sont des acteurs importants du maintien de l’homéostasie des Treg CD8
+
.
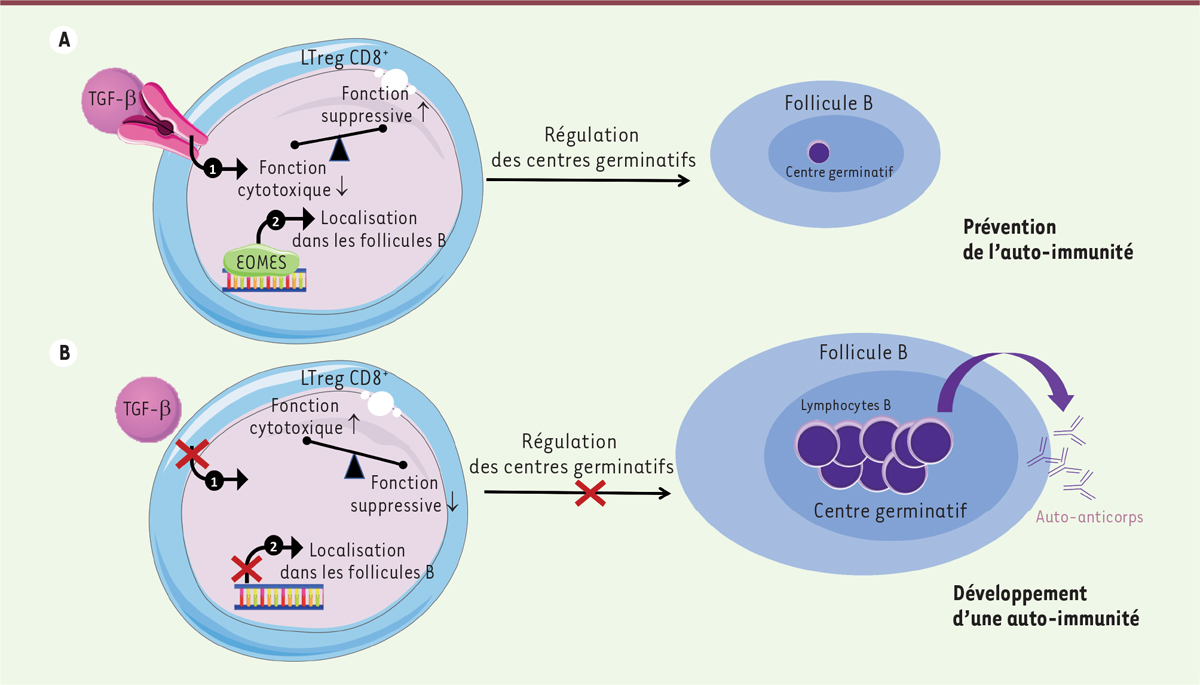
 | Figure 1.
La régulation des lymphocytes Treg CD8
+
par la coopération du TGF-β et de Eomes.
A. Population de lymphocytes Treg CD8
+
(LTreg CD8
+
) fonctionnelle permettant la régulation de la formation des centres germinatifs. Le TGF-β régule la fonction suppressive des Treg CD8
+
(1). Le facteur de transcription Eomes est un acteur majeur pour leur localisation dans les follicules B (2). B. Population de lymphocytes Treg CD8
+
non fonctionnelle chez des souris dont les gènes codant la chaîne II du récepteur du TGF-β et Eomes ont été invalidés. Cette double délétion conduit à un phénotype auto-immun léthal associé notamment à la formation spontanée de centres germinatifs.
|
L’équipe de Nu Zhang a donc ensuite voulu comprendre le rôle exact de ces deux acteurs dans la régulation des lymphocytes Treg CD8
+
. Ils se sont d’abord concentrés sur l’élucidation du rôle du TGF-β en générant des souris déficientes uniquement pour le gène codant la chaîne II du récepteur du TGF-β et ont observé, chez ces animaux, la perte d’expression du facteur de transcription Helios, important pour la fonction régulatrice des lymphocytes Treg [
10
]. Ils ont également remarqué chez ces souris une augmentation de l’expression des granzymes A et B, des molécules cytotoxiques produites par différentes lymphocytes, dans les lymphocytes Treg CD8
+
résiduels. Les granzymes A et B sont normalement liés à l’activité effectrice cytotoxique des lymphocytes CD8
+
mais pas à une fonction régulatrice. Ainsi, le TGF-β permettrait à la fois de freiner la fonction cytotoxique et de promouvoir la fonction régulatrice des lymphocytes Treg CD8
+
.
Afin de préciser le rôle d’Eomes dans la fonction des lymphocytes Treg CD8
+
, des souris déficientes pour ce facteur de transcription ont été également générées. Avec ce modèle, les chercheurs ont découvert que Eomes était capable de réguler spatialement les lymphocytes Treg CD8
+
. En effet, au niveau des organes lymphoïdes secondaires, les souris déficientes pour Eomes avaient un plus grand nombre de lymphocytes Treg CD8
+
localisés en dehors des follicules B où apparaissent les centres germinatifs. Ce défaut de localisation des lymphocytes Treg CD8
+
pourrait favoriser une génération incontrôlée de centres germinatifs [
9
].
Ainsi, le TGF-β et Eomes agissent à différents niveaux : ils ont un impact, respectivement, sur la fonction régulatrice et sur la localisation des lymphocytes Treg CD8
+
, ces deux facteurs étant nécessaires au maintien de ces cellules dans l’organisme et à leur bon fonctionnement.
|
Les lymphocytes Treg CD8+ ont des fonctions vitales et non redondantes
Si les fonctions immunosuppressives des lymphocytes Treg CD4
+
avaient été largement étudiées, ce n’était pas le cas des lymphocytes Treg CD8
+
. L’étude de Nu Zhang a permis de montrer que ces lymphocytes Treg CD8
+
jouent un rôle majeur dans la régulation des centres germinatifs. En effet, l’injection de lymphocytes Treg CD8
+
aux souris porteuses de la double délétion de la chaîne II du récepteur du TGF-α et du facteur de transcription Eomes permet de rétablir un phénotype normal, ce qui n’est pas le cas lorsque des lymphocytes Treg CD4
+
sont injectés. Ces résultats révèlent un rôle primordial et non redondant des lymphocytes Treg CD8
+
sur la régulation des centres germinatifs [
9
].
Enfin, les lymphocytes Treg CD8
+
pourraient aussi jouer un rôle dans l’apparition de certaines maladies auto-immunes chez l’homme. L’équipe de Nu Zhang a en effet mis en évidence chez des patients, une corrélation entre l’occurence d’un lupus érythémateux disséminé, une maladie auto-immune, et un faible pourcentage de lymphocytes Treg CD8
+
.
|
Il reste encore beaucoup de zones d’ombre dans la compréhension des mécanismes régulateurs impliquant les lymphocytes Treg CD8
+
. L’équipe de Nu Zhang n’a pas pu mettre en évidence les voies de signalisations précises impliquant le TGF-β et Eomes dans ces cellules. En particulier, on ne connaît pas encore le lien qui existe entre le TGF-β et le facteur de transcription Helios. Il est donc important de comprendre par quelle voie canonique ou non, le TGF-β, pourrait induire la transcription d’Helios et ainsi réguler les fonctions régulatrices des lymphocytes Treg CD8
+
.
Pour Eomes, la caractérisation du gène sur lequel agit ce facteur de transcription reste un défi. Pour l’équipe de Nu Zhang, il s’agirait d’un gène codant un récepteur de chimiokine qui permettrait ensuite de guider les lymphocytes Treg CD8
+
dans les centres germinatifs afin de les localiser correctement.
La régulation précise des centres germinatifs reste également incomprise. Pourquoi les lymphocytes Treg CD4
+
ne sont-ils pas suffisants pour empêcher la formation spontanée de centres germinatifs ? Quel est le lien entre les lymphocytes Treg CD8
+
et les lymphocytes T
FR
? Nul doute que l’importance des lymphocytes Treg CD8
+
a été sous-estimée et que ces prochaines années seront cruciales pour mieux appréhender leurs fonctions et les acteurs qui les régulent.
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Sakaguchi
S
,
Yamaguchi
T
,
Nomura
T
,
et al.
Regulatory T cells and immune tolerance.
.
Cell.
2008;
;
133
:
:775.
–
787
.
2.
Sakaguchi
S.
Naturally arising Foxp3-expressing CD25
+
CD4
+
regulatory T cells in immunological tolerance to self and non-self
.
.
Nat Immunol.
2005;
;
6
:
:345.
–
352
.
3.
Vignali
DA
,
Collison
LW
,
Workman
C
How regulatory T cells work.
.
Nat Rev Immunol.
2008;
;
8
(
(7)
):
:523.
–
532
.
4.
Kim
HJ
,
Verbinnen
B
,
Tang
X
,
et al.
Inhibition of follicular T-helper cells by CD8
+
regulatory T cells is essential for self-tolerance
.
.
Nature.
2010;
;
467
:
:328.
–
332
.
5.
Gupta
S
,
Su
H
,
Agrawal
S
.
CD8 Treg cells inhibit B-cell proliferation and immunoglobulin pProduction.
.
Int Arch Allergy Immunol.
2020;
;
181
:
:947.
–
55
.
6.
Yang
N
,
Li
Z
,
Jiao
Z
,
et al.
A Trichosanthin-derived peptide suppresses type 1 immune responses by TLR2-dependent activation of CD8(+)CD28(-) Tregs.
.
Clin Immunol.
2014;
;
153
:
:277.
–
287
.
7.
Filaci
G
,
Fravega
M
,
Negrini
S
,
et al.
Nonantigen specific CD8
+
T suppressor lymphocytes originate from CD8
+
CD28
−
T cells and inhibit both T-Cell proliferation and CTL function
.
.
Hum Immunol.
2004;
;
65
:
:142.
–
156
.
8.
Niederlova
V
,
Tsyklauri
O
,
Chadimova
T
,
et al.
CD8
+
Tregs revisited: A heterogeneous population with different phenotypes and properties
.
.
Europ J Immunol.
2021;
;
51
:
:512.
–
30
.
9.
Mishra
S
,
Liao
W
,
Liu
Y
,
et al.
TGF-β and Eomes control the homeostasis of CD8
+
regulatory T cells
.
.
J Exp Med.
2020;
;
218
:
:e20200030.
.
10.
Kim
HJ
,
Bartniz
RA
,
Kreslavsky
T
,
et al.
Stable inhibitory activity of regulatory T cells requires the transcription factor Helios.
.
Science.
2015;
;
350
:
:334.
–
339
.
|