| |
| Med Sci (Paris). 38(2): 218–221. doi: 10.1051/medsci/2021259.La longévité des sébastes Chroniques génomiques Bertrand Jordan1* 1Biologiste, généticien et immunologiste, président d’Aprogène (Association pour la promotion de la génomique)
,
13007Marseille
,
France MeSH keywords: Vieillissement, Animaux, Humains, Longévité, Perciformes, génétique |
La longévité des organismes est très variable au sein des espèces, et elle est certainement sous l’influence de facteurs génétiques. L’existence d’espèces très proches dont la longévité est très différente offre une opportunité d’accès à ces facteurs grâce à l’analyse comparée des ADN de ces différentes espèces. Pour être réellement révélatrices, ces comparaisons doivent porter sur la séquence de l’ensemble de l’ADN et non sur celle de quelques gènes choisis de manière plus ou moins arbitraire. Les progrès récents des techniques de séquençage de l’ADN rendent cette approche techniquement possible et financièrement abordable, et des études récemment publiées montrent comment elle peut être mise en œuvre [
1
] ; c’est le sujet de cette chronique.
|
Les sébastes du Pacifique et leur ADN
Les sébastes (
rockfish
en anglais) sont des poissons
(
Figure 1
)
appartenant à un genre qui comprend plus d’une centaine d’espèces réparties dans le Pacifique Nord-Est et Ouest. Elles vivent généralement à des profondeurs de 400 à 600 mètres (donc au bord du plateau continental) et sont vivipares, chaque femelle libérant une fois par an des dizaines ou centaines de milliers de larves après fécondation et éclosion interne des œufs. Elles font l’objet d’une pêche commerciale qui en prélève plusieurs dizaines de milliers de tonnes par an et peut mettre en danger la survie de ces espèces à maturation très lente (cinq à dix ans). La détermination de l’âge des spécimens capturés
(
Encadré 1
)
montre que leur longévité peut aller de 11 ans (pour l’espèce
Sebastes minor
) à plus de 200 ans pour
Sebastes aleutianus.
Précisons qu’il s’agit ici de l’âge maximum observé et non d’un âge moyen ou d’une espérance de vie qui n’aurait pas de sens pour ces poissons soumis à une forte prédation et dont l’effectif diminue rapidement avec l’âge.
 | Figure 1.
Sebastes aleutianus dans son cadre naturel
(© Wikipedia commons).
|
Un ensemble d’équipes (aux États-Unis, au Canada, au Chili) a donc décidé d’utiliser ce modèle pour rechercher dans l’ADN des déterminants de la longévité [
1
]. Pour cela, ces équipes ont séquencé l’ADN de 102 sébastes appartenant à 88 espèces différentes. Le génome de ces poissons, long d’environ 900 mégabases (900 millions de bases, soit 3,5 fois plus petit qu’un génome humain), a été lu par la technique
Illumina
(séquences courtes d’environ 500 bases) ainsi que, pour sept espèces, par le système
Pacific Biosciences
qui autorise des lectures beaucoup plus longues (plusieurs kilobases). Ces lectures longues ont permis l’assemblage
de novo
de sept génomes de sébastes et, de proche en proche, celui des génomes lus en séquences courtes. L’analyse de ces séquences révèle environ 25 000 gènes, une valeur proche de celle des mammifères, y compris
Homo sapiens
. Leur étude comparative apporte des informations très intéressantes sur les corrélats et déterminants de la longévité.
|
Phylogénie, réparation de l’ADN et régulation immunitaire
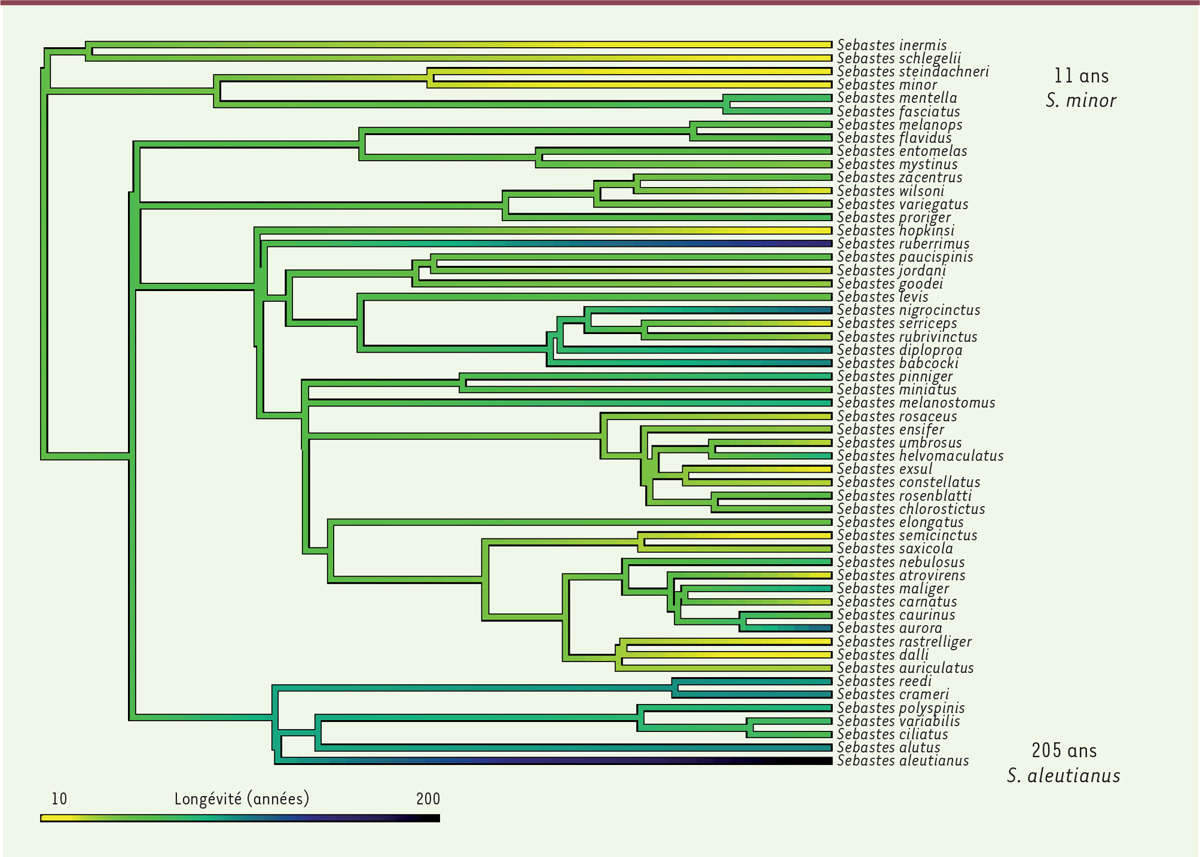
La disponibilité des séquences complètes de ces 88 espèces a permis d’établir leur arbre phylogénétique
(
Figure 2
)
. On note une tendance au regroupement des espèces à faible longévité (les quatre premières branches, en jaune sur la figure) ou à forte longévité (les sept dernières, en vert foncé). Néanmoins des longévités importantes (plus de 100 ans) sont visibles dans différentes régions de l’arbre
(
Figure 2
)
, indiquant que cette caractéristique est apparue de façon indépendante dans différentes branches. L’analyse génétique confirme cette conclusion : le catalogue des gènes portant des traces de sélection positive (excès de mutations non silencieuses) et associés à la longévité montre que ceux-ci diffèrent souvent d’une espèce à l’autre, même s’ils concernent généralement le même type de fonction.
 | Figure 2.
Arbre phylogénétique des 88 espèces de sébastes dont l’ADN a été intégralement séquencé.
La couleur indique la longévité de chaque espèce (échelle en bas), de 10 ans (jaune) à 200 ans (bleu foncé).
Sebastes minor
(11 ans) est la quatrième à partir du haut,
Sebastes aleutianus
(205 ans) la dernière en bas (extrait modifié de la figure supplémentaire S7 de [
1
]).
|
Comme on pouvait s’y attendre [
2
] (
→
), ces gènes sélectionnés chez les espèces à grande longévité concernent souvent la réparation de l’ADN. Les auteurs en identifient 16, en général différents d’une espèce à l’autre, comme par exemple
WRAP53 (WD repeat-containing protein antisense to TP53)
, impliqué dans l’entretien des télomères,
FEN1 (flap structure-specific endonuclease 1)
, associé à la réparation de bases excisées, ou
MCM6 (minichromosome maintenance complex component 6)
, qui fait partie du complexe de réplication de l’ADN. L’adaptation à une grande longévité chez les sébastes semble donc impliquer une sélection parallèle de composants plus performants dans les voies critiques d’entretien de l’ADN.
(→) Voir la Synthèse de P. Fontanilla
et al
.,
m/s
n° 12, décembre 2020, page 1118
L’obtention de séquences fondées sur des lectures longues (technique
Pacific Biosciences
) a permis aussi aux auteurs de rechercher de manière efficace les modifications structurales (principalement duplications) associées aux espèces à forte longévité. Ces dernières présentent effectivement un nombre de duplications plus élevé que les espèces à vie courte, et la majeure partie de ces duplications est concentrée sur le locus contenant six gènes qui codent des membres de la famille de la butyrophiline. Il s’agit de protéines transmembranaires membres de la superfamille des immunoglobulines
1
, qui portent deux domaines d’immunoglobuline et sont impliquées dans la régulation des réponses inflammatoires [
3
]. Le nombre de gènes de cette famille trouvés chez les sébastes varie de 18 à 36, et on peut penser que cette expansion d’une famille de protéines immunorégulatrices joue un rôle dans la longévité des espèces correspondantes.
|
L’âge d’un poisson Comment peut-on dire qu’un poisson est âgé de 205 ans ? La précision qu’implique ce nombre semble étonnante lorsqu’on pense à la difficulté d’estimer l’âge de squelettes humains, et aux catégories larges dans lesquelles on les range en conséquence (enfant, adolescent, adulte, âgé). La réponse se trouve dans de petites structures osseuses, les otolithes. Il s’agit de concrétions minérales présentes dans le système vestibulaire de l’oreille interne, et impliquées dans l’équilibration de l’organisme. Ils sont particulièrement développés chez les poissons des profondeurs qui doivent se repérer dans un environnement complexe et obscur, et peuvent dans ce cas mesurer une vingtaine de millimètres.
L’intérêt de ces otolithes réside dans le fait qu’ils continuent de croître tout au long de la vie du poisson et présentent des anneaux de croissance correspondant aux variations annuelles d’environnement et de nourriture : les sébastes vivent en hiver à de grandes profondeurs, et plus près de la surface en été. Moyennant une préparation minutieuse (section de l’otolithe et traitement thermique pour accentuer le relief des anneaux), on peut les compter (comme les anneaux de croissance d’un tronc d’arbre) et ainsi déterminer l’âge du poisson correspondant [
6
]. On trouve même sur Internet un tutoriel montrant les étapes de ce procédé
1
dont le nom savant est otolithométrie.
C’est ainsi qu’ont été évaluées les longévités des différentes espèces de sébaste mentionnées dans cet article. Soulignons que ce que l’on détermine ainsi est l’âge du spécimen examiné, 205 ans pour un exemplaire de
Sebastes aleutianus
pêché dans le sud de l’Alaska [
6
] : ce n’est pas nécessairement la longévité maximale de l’espèce (il peut exister des poissons plus âgés qui n’ont pas été capturés). Quant à l’espérance de vie, elle est très différente puisque les poissons âgés (les plus gros) sont rares et que, sur le million de larves relâchées par une femelle, seules quelques-unes parviennent à l’âge adulte, en raison de la présence de nombreux prédateurs, y compris l’homme.
1
https://www.youtube.com/watch?v=RMcGxT_1d68
|
|
Sélection pour la longévité ?
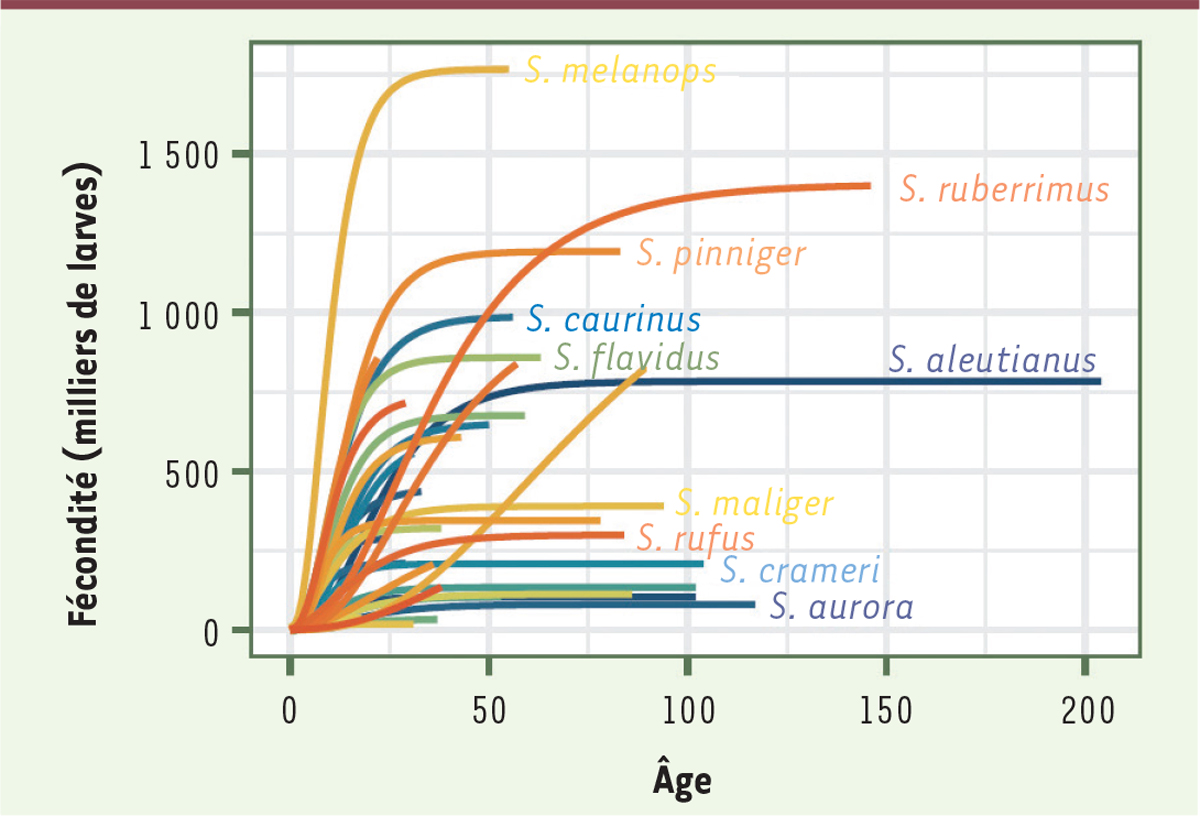
Les sébastes présentent une caractéristique particulière qui les différencie de nombreuses autres espèces (dont la nôtre) : leur fécondité augmente avec l’âge (et la taille de l’individu dont la croissance se poursuit), puis reste constante tout au long de la vie de l’animal, sans diminution
(
Figure 3
)
. Chez l’une de ces espèces,
S. ruberrimus
, un individu âgé de 150 ans peut produire un million de larves par saison ! Certes, la quasi-totalité de ces larves n’atteindra pas l’âge adulte, mais cette fécondité prolongée signifie que les allèles favorisant une grande longévité peuvent être sélectionnés par l’évolution puisqu’ils augmentent le nombre de descendants. C’est très différent pour les humains, dont la fonction reproductive cesse vers 50 ans et dont la survie au-delà de cet âge ne constitue donc pas un avantage sélectif [
4
]… Pour l’espèce humaine, il n’y a pas de sélection pour la longévité, ce qui n’annule pas l’intérêt de l’étude génétique de centenaires, mais diminue peut-être la probabilité d’identifier des gènes très significatifs de ce point de vue.
 | Figure 3.
Fécondité (nombre de larves produites par saison) en fonction de l’âge (années) pour différentes espèces de sébastes
(extrait partiel et modifié de la figure 5 de [
1
]).
|
Ces indications soulignent l’intérêt du modèle sébaste pour l’étude des corrélats génétiques de la longévité, puisqu’elles renforcent l’idée que les différences observées dans l’ADN sont bien liées à la sélection de ce caractère. |
Les éléments brièvement présentés dans cette chronique – l’article est bien plus complet et par ailleurs très intéressant – montrent bien l’intérêt de cette approche comparative, rendue possible par l’existence d’espèces très proches mais dont la longévité varie beaucoup, et par les performances actuelles des techniques de séquençage qui permettent des explorations difficilement imaginables il y a seulement dix ans. On en retient notamment l’implication fortement soulignée des mécanismes de réparation de l’ADN [
2
]. Conclusion logique
a priori
, mais encore fallait-il la démontrer. On aimerait évidemment savoir si ces conclusions se vérifient en dehors du genre
Sebastes
: ce sera l’objet de la prochaine chronique, qui fera l’analyse de résultats comparant l’efficacité de la réparation de l’ADN de mammifères dont les longévités sont très différentes (de 4 à 115 ans) [
5
]. Il s’agit là encore, on le verra, de techniques très sophistiquées (séquençage intégral de l’ADN de cellules isolées), qui commençaient tout juste à apparaître il y a une décennie. Le progrès des techniques reste un puissant facteur pour l’avancement des connaissances…
|
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Kolora
SRR
,
Owens
GL
,
Vazquez
JM
,
et al.
Origins and evolution of extreme life span in Pacific Ocean rockfishes.
.
Science.
2021;
;
374
:
:842.
–
7
.
2.
Fontanilla
P
,
Willaume
S
,
Thézé
B
,
et al.
Le vieillissement : une histoire de dommages de l’ADN, d’enveloppe nucléaire altérée et d’inflammation ?
Med Sci (Paris).
2020;
;
36
:
:1118.
–
28
.
3.
Arnett
HA
,
Viney
JL
.
Immune modulation by butyrophilins.
.
Nat Rev Immunol.
2014;
;
14
:
:559.
–
569
.
4.
Sebastiani
P
,
Solovieff
N
,
Dewan
AT
,
et al.
Genetic signatures of exceptional longevity in humans.
.
PLoS One.
2012;
;
7
:
:e29848.
.
5.
Zhang
L
,
Dong
X
,
Tian
X
,
et al.
Maintenance of genome sequence integrity in long- and short-lived rodent species.
.
Sci Adv.
2021;
;
7
:
:eabj3284.
.
|