| |
| Med Sci (Paris). 38(2): 182–190. doi: 10.1051/medsci/2022003.Transition de soins de l’enfance et de l’adolescence à l’âge adulte en néphrologie Marie-Alice Macher,1* Robert Novo,2 and Véronique Baudouin1 1Service de néphrologie pédiatrique, Hôpital universitaire Robert Debré, AP-HP
,
48 boulevard Sérurier
,
75019Paris
,
France 2Service de néphrologie pédiatrique, Hôpital Jeanne de Flandre, CHU de Lille
,
avenue Eugène Avinée
,
59000Lille
,
France |
Vignette (Photo © Inserm/Michel Depardieu). Lorsqu’une maladie chronique débute dans l’enfance, l’enfant qui en est atteint va devoir vivre toute sa vie, le mieux possible, avec cette maladie. Au cours de l’enfance et de l’adolescence, la prise en charge médicale et les divers soins associées sont assurés par une équipe pédiatrique, souvent la même, pendant des années, avec la participation des parents, dont le rôle peut être prépondérant dans certaines maladies (nutrition entérale assistée, dialyse péritonéale, etc.). Les soins seront ensuite poursuivis par une équipe médicale pour adultes spécialisée, et le jeune adulte, désormais autonome, devra se prendre en charge. Ce passage se situe à une période sensible de la vie, où les contraintes d’une maladie chronique sont particulièrement difficiles à accepter. Les risques associés à cette période sont identifiés depuis plus de 20 ans, et ont conduit à développer le concept de transition. Plus qu’un simple transfert, la transition est un processus étalé sur plusieurs années, visant à accompagner, à responsabiliser, et à rendre autonomes les adolescents et les jeunes adultes. Ce processus doit être structuré et planifié pour minimiser le risque de rupture dans le suivi médical, avec ses conséquences parfois dramatiques sur la santé. Depuis une dizaine d’années, de gros progrès ont été réalisés dans l’organisation de cette transition, avec une prise de conscience dont témoignent l’augmentation des publications sur ce sujet, les recommandations des sociétés savantes, et la mise en place de plus en plus fréquente d’un parcours coordonné entre équipes pédiatriques et de soins pour adultes. En néphrologie, c’est sur la transition des adolescents porteurs d’un greffon rénal que les publications et recommandations se sont souvent focalisées en raison des enjeux particuliers et du risque accru de perte du greffon lors du passage dans une équipe de soins pour adultes. Mais les maladies rénales chroniques débutant dans l’enfance, souvent dès la naissance, sont nombreuses, et nécessitent également la mise en place d’un processus de transition. De plus, il s’agit souvent de maladies rares, touchant moins d’une personne sur 2 000 habitants, mal connues des médecins d’adultes, qui doivent être informés des particularités de leur prise en charge. |
Quelles sont les maladies rénales chroniques débutant dans l’enfance ? (
Tableau I
) [
1
,
2
]
Les anomalies congénitales du développement rénal (
congenital anomalies of the kidney and the urinary tract
, CAKUT) représentent la principale cause d’insuffisance rénale sévère au cours de l’enfance. Elles se caractérisent par des reins de structure anormale (dysplasie rénale) ou de petite taille (hypoplasie rénale). Ces anomalies peuvent être associées à des malformations de l’appareil urinaire et, dans certains cas, à des anomalies extra-rénales. Dans la grande majorité des cas, on ne retrouve pas d’anomalie génétique, et le risque que la maladie se reproduise dans la fratrie ou la descendance est très faible.
Les néphropathies héréditaires associées à une anomalie génétique, en règle monogénique, sont nombreuses, mais il s’agit de maladies rares. Des progrès considérables ont été réalisés dans la caractérisation génétique de ces maladies, et pour certaines, des traitements permettent d’éviter ou de reculer l’évolution vers l’insuffisance rénale chronique, comme dans la cystinose et la plupart des syndromes hémolytiques et urémiques atypiques. Les glomérulopathies acquises sont principalement représentées en pédiatrie par les syndromes néphrotiques idiopathiques. Les néphropathies à IgA (Maladie de Berger et purpura rhumatoïde) sont également fréquentes chez l’enfant, alors que les néphropathies associées à une maladie systémique (lupus érythémateux disséminé, ou vascularites autres que le purpura rhumatoïde) sont beaucoup plus rares que chez l’adulte.
Tableau I.
|
Les anomalies du développement des reins et des voies urinaires :
Hypoplasies et dysplasies rénales associées ou pas à des anomalies des voies urinaires
|
|
|
Les néphropathies héréditaires :
|
|
– Les maladies kystiques
: polykystoses rénales dominantes et récessives, néphronophtise et autres ciliopathies, maladie kystique associée aux mutations du gène
HNF1
β,
etc.
|
|
– Les tubulopathies
: syndromes de Bartter, Gitelman, Lowe, Fanconi, Dent, hypouricémie, acidoses tubulaires, rachitisme hypophosphatémique, cystinose, etc.
|
|
– Les néphropathies glomérulaires :
|
|
• Syndromes néphrotiques cortico-résistants héréditaires
: syndrome néphrotique finlandais, syndromes de Denys-Drash, Frasier, Pierson, Schimke, Galloway, sclérose mésangiale diffuse récessive autosomique, onycho-ostéo-dysplasie (
nail patella syndrome
),
etc.
|
|
• Syndrome d’Alport
|
|
• Certaines néphropathies glomérulaires à dépôts de C3
|
|
– Syndromes hémolytiques et urémiques atypiques
|
|
– Certaines tumeurs rénales : éphroblastome et syndromes associés
|
|
|
Les lithiases métaboliques :
Oxalose, cystinurie-lysinurie, déficit en hypoxanthine-guanine phosphoribosyl-transférase, syndrome de Lesh-Nyhan,
etc.
|
|
|
Les glomérulopathies acquises :
|
| – drome néphrotique idiopathique. |
| – Néphropathies à IgA. |
| – Glomérulonéphrite extra-membraneuse primitive. |
| – Glomérulonéphrite des maladies systémiques : lupus érythémateux disséminé, vascularites… |
|
|
L’insuffisance rénale chronique
(quelle qu’en soit la cause)
|
Maladies rénales chroniques chez l’enfant.
|
|
L’insuffisance rénale chronique chez l’enfant
Depuis la classification internationale des maladies rénales KDIGO (
kidney disease: Improving global outcomes
) en 2012 [
3
], le terme de maladie rénale chronique a remplacé celui d’insuffisance rénale chronique. En effet, cette classification inclut les anomalies structurales des reins sans diminution du débit de filtration glomérulaire, et souligne le caractère progressif des maladies rénales, qui impose un suivi à vie.
Les données épidémiologiques concernant les stades moins avancés de la maladie rénale chronique sont limitées [
4
–
8
]. En Europe, l’incidence de l’insuffisance rénale chronique de stade 3 à 5
1
est évaluée à 12 cas par million d’habitants du même âge (pmh), avec un rapport du nombre de garçons atteints sur le nombre de filles atteintes de 1,3, et une prévalence de 55 à 75 pmh selon le niveau d’insuffisance rénale retenu. Ces données sous-estiment la fréquence de la maladie rénale chronique chez l’enfant et l’adolescent en ne prenant pas en compte les stades où la maladie est encore silencieuse sur le plan clinique. Or son caractère progressif, et la possibilité de ralentir cette progression par des mesures de protection du rein et d’en limiter les complications, notamment cardiovasculaires, imposent un suivi « à vie » et donc une transition vers une structure de néphrologie pour adultes. Toute réduction néphronique sévère évolue pour son propre compte, avec une détérioration progressive dépendant de l’importance de la réduction néphronique mais aussi de facteurs environnementaux, nutritionnels et génétiques. En pédiatrie, les hypo-dysplasies rénales sans uropathie et les réductions néphroniques secondaires à une insuffisance rénale aiguë, modèles de réduction néphronique isolée, illustrent ce risque. Notamment, le risque d’évolution vers l’insuffisance rénale chronique terminale, à très long terme, de l’insuffisance rénale aiguë [
9
], en particulier des syndromes hémolytiques et urémiques post-infectieux avec une anurie supérieure à huit jours, justifie cette surveillance à l’âge adulte [
10
,
11
].
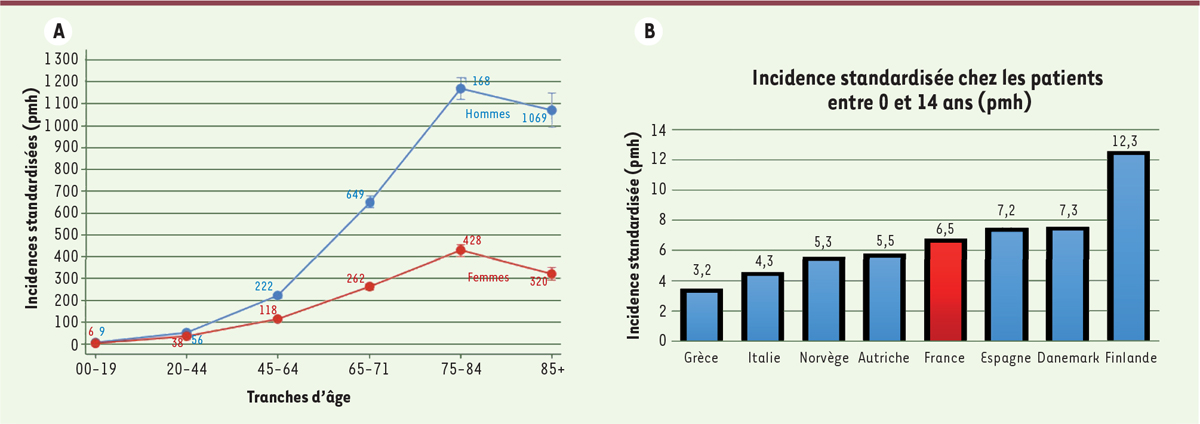
L’épidémiologie de l’insuffisance rénale chronique sévère ou terminale (stades 4 et 5), qui nécessite un traitement de suppléance rénale (dialyse ou transplantation rénale), est bien documentée
(
Figure 1
)
. L’incidence de l’insuffisance rénale chronique terminale augmente avec l’âge, surtout après 45 ans. En France, elle est, chez les moins de 20 ans, de 8 par million d’habitants de cet âge, ce qui représente entre 120 et 140 nouveaux patients chaque année, et seulement 1 % des plus de 10 000 nouveaux patients issus de la population générale (où l’incidence est de 168 pmh) [
12
]. Ces données sont comparables en Europe, aux États-Unis, et en Australie [
4
,
13
-
15
], où l’incidence est comprise entre 6 et 12 pmh pour les moins de 20 ans, et entre 3 et 10 pmh pour les moins de 15 ans. Cette incidence est relativement stable au fil du temps, alors qu’elle augmente chez l’adulte. En France, la prévalence pour les sujets âgés de moins de 20 ans est de 60 pmh, soit 933 patients (1 359 pmh pour la population générale, soit plus de 90 000 patients). Dans les différents pays d’Europe, la prévalence varie entre 30 et 105 pmh. Aux États-Unis, elle est de 99 pmh, et augmente avec le temps, à la différence de l’incidence. Cette augmentation s’explique par l’amélioration de la prise en charge de ces patients, et conduit de plus en plus d’adolescents et de jeunes adultes vers les services de néphrologie pour adultes. La part des patients ayant bénéficié d’une greffe de rein varie selon les pays : elle est de 80 % en France.
 | Figure 1.
Incidence de l’insuffisance rénale chronique terminale selon l’âge et les pays
(données du registre REIN, Rapport 2018 [
12
]).
A.
Incidence de l’insuffisance rénale terminale en France par âge et par sexe (par million d’habitants).
B.
Incidence, en 2018, de l’insuffisance rénale chronique terminale chez les enfants âgés de 0 à 14 ans (rapport REIN, d’après les registres ESPN, ERA, EDTA).
|
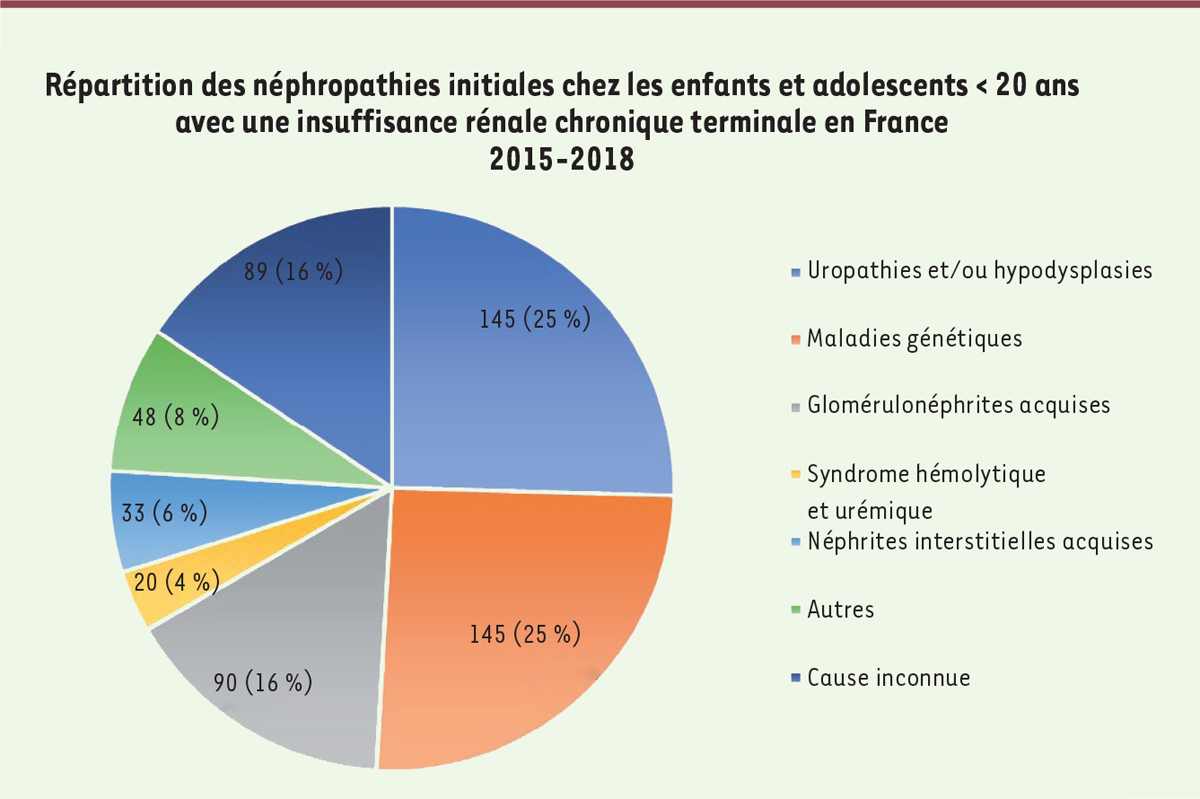
Les maladies rénales chroniques responsables d’une insuffisance rénale terminale chez les enfants et les adolescents sont, dans la moitié des cas, des maladies congénitales ou héréditaires, dont 30 à 40 % d’uropathies et hypoplasies rénales [
12
]. Les glomérulopathies acquises représentent 15 à 20 %, avec une prédominance des syndromes néphrotiques idiopathiques
(
Figure 2
)
. Cette répartition est bien différente de celle chez les adultes, qui est dominée par le diabète et l’hypertension artérielle.
 | Figure 2.
Maladies rénales primitives chez les enfants et adolescents âgés de moins de 20 ans ayant atteint le stade de l’insuffisance rénale terminale en France entre 2015 et 2018 (d’après les données des rapports annuels du registre REIN [
12
]).
|
La survie des enfants et adolescents en insuffisance rénale chronique terminale s’est améliorée au fil du temps dans les pays industriellement développés. En Europe, la survie à cinq ans varie entre 82 et 96 %, et la survie à 10 ans entre 76 et 89 % [
4
,
16
]. Elle est moins bonne chez les enfants en insuffisance rénale terminale avant l’âge de quatre ans. La transplantation rénale est le meilleur traitement de l’insuffisance rénale chronique terminale. Elle permet une qualité de vie nettement meilleure qu’avec la dialyse, et doit être proposée dès que possible, en évitant la dialyse chaque fois que c’est possible (greffe préemptive). L’espérance de vie est réduite de 37 ans chez un garçon de 15 ans en dialyse, et seulement de 23 ans s’il est transplanté [
12
]. Chez les transplantés, les risques d’infection, de maladie cardio-vasculaire, et dans une moindre mesure, de cancer lié à l’exposition prolongée aux traitements immunosuppresseurs, sont augmentés.
|
Les obstacles à la transition de la médecine pour enfants à celle pour adultes [
17
–
22
]
Une population vulnérable
La période de la transition médicale, entre 18 et 21 ans, est également la période de transition de l’adolescence à l’âge adulte. Si la maturation corporelle est souvent achevée, la maturation cérébrale se poursuit au début de la troisième décennie, jusqu’à l’âge de 25 ans environ. Indépendamment de l’état de santé, c’est une période au cours de laquelle les conduites à risque sont fréquentes, associées à une augmentation de la mortalité liée aux accidents. La maladie chronique, avec ses traitements et sa surveillance contraignants, s’accorde mal avec la remise en question fréquente de toute autorité et contrainte à cet âge de la vie. La préoccupation de l’image corporelle rend particulièrement difficile l’acceptation des effets secondaires cosmétiques des médicaments. Par ailleurs, la maladie rénale peut être responsable d’une maturité retardée et de difficultés d’ordre psychique, et dans les insuffisances rénales terminales, en particulier celles ayant débuté dès le très jeune âge, des troubles cognitifs peuvent exister. Ces troubles peuvent également être associés à certains syndromes d’origine génétique [
23
–
24
].
La non adhésion au traitement est rapportée chez 30 à 70 % des enfants et adolescents transplantés, chez qui elle est responsable de près de la moitié des pertes du greffon, et elle est deux fois plus fréquente à l’adolescence, qui représente une période à haut risque [
25
]. Le risque de perte du greffon est également plus élevé chez les jeunes adultes : l’augmentation de ce risque chez les 13-24 ans par rapport aux enfants et aux adultes de 30 à 40 ans apparaît dans des études de registres en France [
26
], aux États-Unis [
27
,
28
], et en Australie et Nouvelle-Zélande [
29
], indépendamment de l’âge de la transplantation. Autrement dit, le risque de perte du greffon évolue au cours de la vie des receveurs, et tous les enfants transplantés vont passer par cette fenêtre à haut risque observée chez les adolescents et jeunes adultes. La mauvaise adhésion thérapeutique est considérée comme la principale cause de l’augmentation des pertes du greffon chez les adolescents et jeunes adultes atteints d’une maladie rénale chronique et transplantés. L’immaturité de cette population rend compte des difficultés de gestion autonome de la maladie. Il n’y a pas d’argument immunologique en faveur d’une diminution, à ces âges, de la tolérance immunitaire induite par le traitement immunosuppresseur.
En 2003, l’Organisation mondiale de la santé a individualisé cinq groupes de facteurs de risque de mauvaise adhésion aux traitements : ceux liés au patient, aux facteurs socio-économiques, à la maladie, aux traitements, et aux systèmes de santé [
30
].
La réticence à quitter la pédiatrie
Une histoire très ancienne de la maladie, parfois présente depuis la naissance, et la forte implication des parents dans les soins créent un lien affectif intense avec l’équipe médicale pédiatrique, qui est rapporté par les adolescents et les parents dans de nombreuses études [
21
]. Ce lien avec une équipe qui, souvent, a vu l’enfant grandir, explique que le jeune lui confie facilement ses préoccupations. Or, la perspective du changement vers une équipe médicale pour adultes est inquiétante et stressante. La crainte de devenir anonyme, d’être avec d’autres patients beaucoup plus âgés, est souvent exprimée. La réticence est également forte chez les parents, qui vont devoir apprendre à « lâcher » peu à peu leur enfant et contribuer à le rendre autonome.
La réticence des néphrologues d’adultes La prise en charge des jeunes patients atteints de maladies ayant débuté tôt dans la vie, parfois mal connues des néphrologues pour adultes, et dont les comportements sont encore immatures, n’est pas toujours simple. Par ailleurs, les médecins d’adultes peuvent éprouver des difficultés à se positionner par rapport aux parents qui, non seulement sont utiles, mais ont besoin d’être accueillis comme partenaires. La réticence des pédiatres Les pédiatres peuvent avoir du mal à « lâcher » leurs jeunes patients, qu’ils redoutent de voir se perdre dans le système de soins pour adultes, et peuvent présenter le transfert vers la médecine d’adultes comme une épreuve. Ils vont pourtant avoir un rôle central pour instaurer la confiance entre les jeunes adultes et la nouvelle équipe médicale, et pour présenter ce passage comme une étape positive de leur maturation, au même titre que l’obtention du permis de conduire. Le système de santé Face à cette population vulnérable et à cette période de transition délicate, le système de santé, et, en particulier, les équipes médicales, ont longtemps insuffisamment pris en compte les difficultés. Les différences entre les structures médicales pédiatriques et celles pour adultes sont importantes. Le plus petit nombre de patients en pédiatrie permet une relation étroite entre l’enfant ou l’adolescent, sa famille et les soignants (l’alliance thérapeutique). Le plus souvent, les consultations se font toujours avec le même néphrologue, et en cas de consultation oubliée ou de bilan non fait, les patients sont systématiquement rappelés. En néphrologie pour adultes, en particulier dans le suivi des patients transplantés, le nombre des patients est beaucoup plus grand, et l’obligation de consultations courtes, souvent avec des médecins différents, rend difficile l’établissement de la même relation de confiance. Les patients adultes doivent être capables de gérer eux-mêmes leur maladie. Concrètement, la principale différence entre les équipes médicales pédiatriques et les équipes médicales pour adultes est l’existence d’une équipe pluridisciplinaire souvent insuffisante pour la prise en charge des adultes. |
La transition médicale enfants-adultes en néphrologie : synthèse des recommandations [
18
,
21
,
31
,
32
]
La transition de prise en charge médicale est un processus lent, qui doit s’étaler sur plusieurs années, et qui a pour but de préparer les adolescents et jeunes adultes atteints d’une maladie chronique au passage à une équipe médicale pour adultes. La transition inclut le transfert et son suivi. Ce processus doit être écrit, planifié et personnalisé pour chaque jeune. Il implique des membres des équipes pédiatriques et des équipes pour adultes, qui collaborent pour structurer et accompagner le parcours du patient. Les objectifs
-
Délivrer les informations nécessaires et évaluer les capacités et la maturation du jeune, mais également le niveau de sa préparation et de sa responsabilisation.
-
Accompagner son évolution et l’aider à devenir un adulte autonome et responsable, capable de gérer sa maladie et de vivre au mieux avec elle.
-
Guider les parents vers l’autonomisation progressive de leur enfant.
Certains facteurs socio-économiques et culturels, le niveau intellectuel, la nature de la maladie, ne sont pas modifiables, bien qu’intervenant considérablement dans la prise en charge. Le programme de transition doit cibler les facteurs modifiables : connaissances, croyances, et développement de la maturité psycho-affective. Les connaissances indispensables à acquérir
Elles ont été listées
(
Tableau II
)
et vont être délivrées par étapes en fonction de l’âge et de la compréhension du jeune patient, avec des vérifications de la réalité des acquis, du degré de préparation (
readiness
) et de responsabilisation (
empowerment
).
Tableau II.
|
Connaître et savoir décrire sa maladie rénale et la nécessité de la transplantation rénale
|
|
|
Avoir conscience des implications à long terme de la transplantation : risques infectieux, risques oncologiques…
|
|
|
Compréhension de l’impact de la maladie sur la sexualité et la reproduction :
|
| Grossesses |
| Médicaments et fertilité |
| Médicaments et tératogénicité |
| Maladies sexuellement transmissibles |
|
|
Responsabilisation pour la prise en charge des soins :
|
| Noms, dosages et indications des différents médicaments |
| Anticiper le renouvellement des médicaments et de l’ordonnance |
| Savoir préparer ses médicaments |
| Savoir communiquer directement avec ses médecins en cas de besoin |
| Connaître les situations urgentes et savoir qui joindre, y compris les numéros des urgences |
| Capacité à tenir un calendrier de ses rendez-vous médicaux |
| Connaître les assurances-maladies et son éligibilité |
|
|
Capacité à assurer sa prise en charge médicale de façon indépendante
|
|
|
Avoir exprimé sa volonté de transfert vers le milieu médical pour adultes
|
|
|
Être en possession de ses informations médicales (résumé concis et facilement accessible)
|
Étapes indispensables avant le transfert dans une équipe de soins pour adultes
([
18
,
36
,
37
]).
|
Quand débuter ? Il est important de débuter tôt le travail de transition, dès l’âge de 12 à 14 ans. Qui sont les acteurs de la transition ?
-
Le jeune est le principal acteur. La transition doit être individualisée pour chaque patient.
-
Les parents. Jusqu’alors les parents ont été les garants du traitement de leur enfant, avec parfois des fonctions de soignants. Il est difficile pour eux de se départir de ce rôle. Le programme de transition va les aider à changer de rôle : de soignant dans la petite enfance, à « superviseur de soins » à l’adolescence, puis à « conseiller » du jeune adulte.
-
Les autres acteurs sont des membres désignés des équipes soignantes, qui vont accompagner la transition : membres de l’équipe pédiatrique dans la phase initiale, puis membres de l’équipe pour adultes, avec une collaboration qui doit être institutionnalisée et structurée. Les membres des équipes impliqués sont habituellement le néphrologue, le chirurgien urologue, la psychologue, l’infirmière d’éducation ou l’infirmière coordinatrice de greffe ou l’infirmière de pratique avancée ou l’infirmière de dialyse, l’assistante sociale, la diététicienne.
La nécessité de désigner un coordinateur ou « champion » dans chaque équipe (pédiatrique et pour adultes) a été soulignée. Ce superviseur va piloter le programme et coordonner les acteurs et les différentes phases. Il est le référent. En règle, c’est le néphrologue de chaque équipe qui joue ce rôle. Le néphrologue pédiatre connaît l’enfant et sa famille souvent depuis le début de la maladie, et va contribuer à donner confiance, au jeune et à sa famille, en la nouvelle équipe médicale. Dans l’équipe pour adultes, il peut s’agir de l’infirmière de coordination de greffe ou d’éducation. Mais un référent médical adulte est requis, avec lequel l’adolescent ou le jeune adulte doit pouvoir renouer une nouvelle alliance thérapeutique. Quels sont les outils et les étapes de la transition ?
-
Les évaluations soulignant les points spécifiques à travailler : état cognitif, mental, et psychologique, évaluation de l’adhésion thérapeutique par des moyens objectifs.
-
Les documents écrits d’information.
-
Le compte-rendu médical détaillé
-
Les rencontres avec l’équipe pour adultes avant le transfert :
-
une réunion conjointe des néphrologues avant le transfert avec, si possible, une première consultation conjointe,
-
visite du centre médical pour adultes par le jeune avant le transfert.
-
Les réunions de groupe avec des pairs, les camps de vacances si possible.
-
La création, au sein des services de néphrologie pour adultes, de cliniques ou plateformes pour adolescents et jeunes adultes, regroupant les patients transférés de pédiatrie et les jeunes de 15 à 25 ans arrivés directement dans ces services pour adultes.
Quand faire le transfert ?
-
Quand le patient n’a plus de besoins spécifiques pédiatriques.
-
Quand le patient à des besoins spécifiques d’adulte (
e.g.
, désir de grossesse).
-
Dans une période de stabilité :
-
stabilité médicale et, pour les transplantés, après la première année de transplantation, en l’absence de problème intercurrent, et pas lorsque la perte du greffon est imminente,
-
stabilité familiale, sociale et éducative (fin d’un cycle d’étude, vie professionnelle, etc.).
-
Et surtout quand le patient est prêt et se sent prêt.
En pratique, le transfert se situe entre 18 et 22 ans en fonction de l’état de maturité (et de l’existence, dans certains pays, d’une limite d’âge pour la prise en charge pédiatrique). Et après le transfert ? La transition n’est terminée qu’après un transfert réussi. La surveillance doit être poursuivie avec une coordination des équipes pour vérifier la prise des rendez-vous et l’adhésion thérapeutique. Il est souhaitable de laisser la porte ouverte en pédiatrie pendant quelque temps après le transfert. |
L’application des recommandations et la mise en place de protocoles individualisés de transition-transfert
Les principaux protocoles publiés [
21
]
Plusieurs protocoles sont disponibles avec, pour certains, la mise à disposition des documents pédagogiques (informations, questionnaires quiz et échelle de préparation) suivants :
ON TRAC
au Canada [
33
], Oxford [
34
],
Ready, steady, go
[
35
] au Royaume Uni, Protocole RISE (
recognition, insight, self-reliance, establish to transition
) aux États-Unis [
32
,
36
], et récemment, le protocole « À vos marques, prêt, partez ! » en France [
37
].
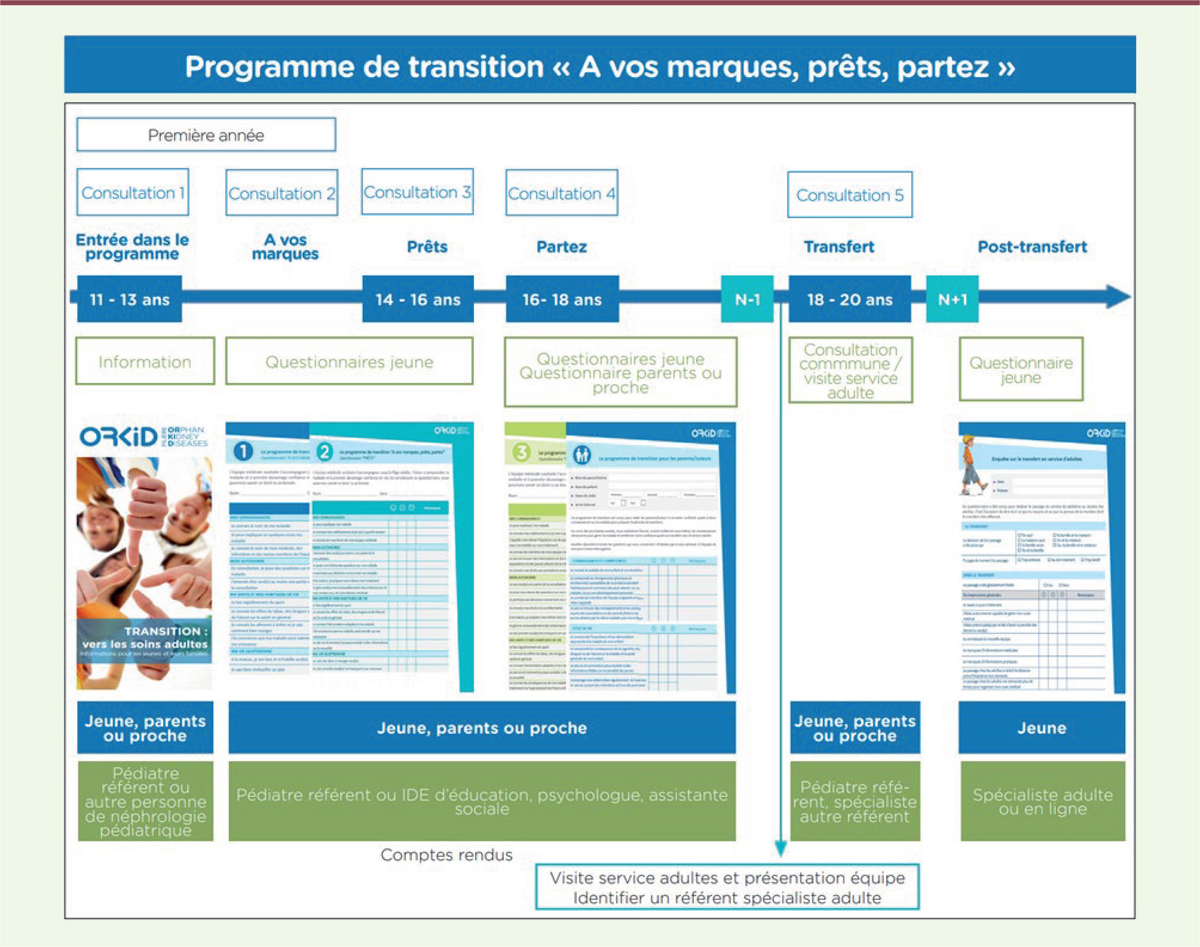
Le protocole français, inspiré du protocole anglais, a été élaboré au sein de la filière de santé ORKID (
orphan kidney diseases
), une structure mise en place par le ministère des Affaires sociales et de la santé qui anime et coordonne un réseau d’acteurs impliqués dans la prise en charge des maladies rénales rares de l’enfant et de l’adulte. L’ensemble des documents du protocole est accessible sur le site internet de ORKID [
38
]
(
Figure 3
)
. Le protocole s’adresse aux jeunes atteints d’une maladie rénale chronique.
 | Figure 3.
Transition-transfert. Optimisation de la prise en charge des patients atteints de maladies rénales (chroniques) ou transplantés rénaux suivis en pédiatrie et arrivant à l’âge adulte. Filière ORKID. Protocole « À vos marques, prêts, partez ! » (d’après [
37
,
38
]).
|
Un protocole spécifique concernant la cystinose est également disponible [
39
]. En revanche, il n’y a pas de protocole spécifique concernant le transfert d’un jeune d’un centre de dialyse pédiatrique à un centre de dialyse pour adultes. Le protocole dédié aux jeunes ayant une maladie rénale chronique peut être utilisé. Dans ce cas particulier, il faut insister sur trois points :
-
Le rôle des infirmier(es) d’hémodialyse pour éduquer les jeunes patients à la gestion des séances, incluant une formation technique à la préparation des machines, voire des ponctions de la fistule. Cela permettra d’orienter le jeune adulte, chaque fois que possible, vers un centre d’hémodialyse autonome, permettant une meilleure insertion sociale.
-
L’importance d’un espace dédié à l’accueil des jeunes, alors que la moyenne d’âge des patients dialysés est élevée (71 ans en France).
-
Le transfert du centre de dialyse doit être couplé au transfert du centre de transplantation. Sauf exception, tous ces jeunes ont un projet de transplantation rénale, et doivent être inscrits sur la liste d’attente. Cela doit être organisé parallèlement pour éviter toute perte de temps.
|
Le concept de transition-transfert Processus planifié et personnalisé, incluant le transfert, qui a pour objectif la préparation et la responsabilisation des adolescents et des jeunes adultes avant leur passage dans un système de soins pour adultes. Initiation : vers l’âge de 12 ans Introduction de la période de transition utilisant un schéma écrit du programme. Démarrage du processus : vers 12-13 ans Identification des besoins et des capacités du jeune. Évaluation du contexte social : famille, école, travail, loisirs. Impliquer le jeune et ses parents. Délivrance des informations de manière adaptée à l’âge. Approfondissement : vers 14 à 16 ans Individualisation du protocole en fonction des besoins. Utilisation d’un programme écrit, auquel on se réfère pour vérifier les acquis au fil du temps. Interventions ciblées sur les points faibles. Préparation au transfert : 16-18 ans Évaluation de la préparation et de la responsabilisation. Favoriser l’accompagnement par des pairs. Vérifier la stabilité de la situation médicale, familiale et personnelle (cursus scolaire, vie professionnelle, vie affective). Rencontre avec l’équipe pour adultes. Transfert : 18-21 ans (âge flexible) «Au bon moment ». En période stable. Après coordination entre les équipes médicales pédiatriques et celles pour adultes. L’équipe pédiatrique s’assure de la présence aux premiers rendez-vous avec l’équipe pour adultes. L’équipe médicale pour adultes assure l’accompagnement nécessaire.
|
État des lieux des pratiques
Alors que les données de la littérature analysées dans des études américaine [
36
] et australienne [
21
] récentes démontrent que les programmes de transition améliorent l’adhésion thérapeutique et le devenir à long terme des transplantés, l’application des recommandations datant de 10 ans ou plus est loin d’être la règle. Une enquête menée dans les centres de néphrologie pédiatrique européens indiquait, en 2014, que si les deux tiers des équipes connaissaient les recommandations, seulement un tiers avait mis en place un protocole structuré [
40
]. Plus récemment, une enquête européenne, datant de 2019, sur la transition dans les maladies rénales rares indique toujours une hétérogénéité des pratiques [
41
]. Aux États-Unis, en 2018, une enquête auprès de néphrologues a révélé qu’un tiers seulement des répondeurs disposent d’un protocole écrit, que 61 % déclarent que les patients sont préparés à leurs futures responsabilités, mais que seulement 23 % utilisent un questionnaire ou une
check-list
pour valider les étapes et la responsabilisation. Moins de 60 % partagent protocoles et traitements entre équipes pédiatriques et pour adultes, et seulement 25 % impliquent l’équipe adulte un an avant le transfert [
36
]. Enfin, en 2020, une revue systématique des publications explorant les expériences des adolescents, parents et soignants concernant le processus de transition des jeunes avec une maladie rénale chronique indique que plus de la moitié ne se sentaient pas suffisamment préparés au moment du transfert [
22
].
Les perspectives Pour répondre aux besoins des adolescents et des familles, les pratiques de transition-transfert doivent être généralisées à tous les services de néphrologie. La dissémination des protocoles existants doit permettre de favoriser la mise en place de ces pratiques. L’intégration du médecin généraliste dans ce processus est nécessaire. La formation spécifique des équipes de transition, en particulier au sein des équipes médicales pour adultes, doit se poursuivre avec plus de moyens pour assurer un soutien suffisant aux adolescents et jeunes adultes. L’utilisation des techniques « nouvelles » dans les méthodes d’information (sites internet accessibles aux jeunes dans les hôpitaux avec possibilités d’échanges, rappels de rendez-vous par smartphone, etc.) et dans les outils de surveillance de l’adhésion aux traitements, ainsi que les espaces dédiés aux adolescents et jeunes adultes doivent se développer. De nouvelles évaluations qualitatives de l’impact des protocoles mis en place, avec une définition plus précise de la transition médicale « réussie », permettront de juger si le défi que représente cette transition est mieux maîtrisé. |
Au cours des dix dernières années, la meilleure connaissance des obstacles et des risques de la transition médicale enfant-adulte en néphrologie, qui concerne une population particulièrement vulnérable, a permis l’élaboration de recommandations détaillées sur la préparation nécessaire, l’évaluation de celles-ci et la mise en place de collaborations structurées entre les équipes pédiatriques et les équipes pour adultes. Des protocoles pratiques ont été mis en place et ont montré leur efficacité. La mise en pratique de ces protocoles reste cependant insuffisante, de même que la formation des personnels soignants, en particulier dans les équipes médicales pour adultes. Le développement des structures dédiées à l’accueil des adolescents et de jeunes adultes, encore trop peu nombreuses, est souhaitable. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
3.
Inker
LA
,
Astor
BC
,
Fox
CH
,
et al.
KDOQI US commentary on the 2012 KDIGO clinical practice guideline for the evaluation and management of CKD.
.
Am J Kidney Dis.
2014;
;
63
:
:713.
–
735
.
4.
Harambat
J
,
van Stralen
KJ
,
Kim
JJ
,
Tizard
EJ
.
Epidemiology of chronic kidney disease in children.
.
Pediatr Nephrol.
2012;
;
27
:
:363.
–
373
.
5.
Deleau
J
,
andre
JL
,
Briancon
S
,
Musse
JP
.
Chronic renal failure in children: an epidemiological survey in Lorraine (France) 1975–1990.
.
Pediatr Nephrol.
1994;
;
8
:
:472.
–
6
.
6.
Wong
CJ
,
Moxey-Mims
M
,
Jerry-Fluker
J
,
et al.
CKiD (CKD in children) prospective cohort study: a review of current findings.
.
Am J Kidney Dis.
2012;
;
60
:
:1002.
–
1011
.
7.
Warady
BA
,
Chadha
V
.
Chronic kidney disease in children: the global perspective.
.
Pediatr Nephrol.
2007;
;
22
:
:1999.
–
2009
.
8.
Esbjörner
E
,
Berg
U
,
Hansson
S
.
Epidemiology of chronic renal failure in children: a report from Sweden 1986–1994.
.
Swedish pediatric nephrology association. Pediatr Nephrol.
1997;
;
11
:
:438.
–
442
.
9.
Greenberg
JH
,
Coca
S
,
Parikh
CR
.
Long-term risk of chronic kidney disease and mortality in children after acute kidney injury: a systematic review.
.
BMC Nephrol.
2014;
;
15
:
:184.
.
11.
Spinale
JM
,
Ruebner
RL
,
Copelovitch
L
,
Kaplan
BS
.
Long-term outcomes of Shiga toxin hemolytic uremic syndrome.
.
Pediatr Nephrol.
2013;
;
28
:
:2097.
–
2105
.
14.
https://www.usrds.org/adr.aspx
.
U.S. renal data system (USRDS). annual data report 2019: atlas of chronic kidney disease and end-stage renal disease in the United States. Volume 2: End-stage renal disease in the United States.
16.
Chesnaye
NC
,
van Stralen
KJ
,
Bonthuis
M
,
et al.
Survival in children requiring chronic renal replacement therapy.
.
Pediatr Nephrol.
2018;
;
33
:
:585.
–
594
.
17.
Foster
BJ
.
Heightened graft failure risk during emerging adulthood and transition to adult care.
.
Pediatr Nephrol.
2015;
;
30
:
:567.
–
576
.
18.
Bell
LE
,
Bartosh
SM
,
Davis
CL
,
et al.
Adolescent transition to adult care in solid organ transplantation: A consensus conference report.
.
Am J Transplant.
2008;
;
8
:
:2230.
–
2242
.
19.
Steinberg
EA
,
Moss
M
,
Buchanan
CL
,
Goebel
J
.
Adherence in pediatric kidney transplant recipients: solutions for the system.
.
Pediatr Nephrol.
2018;
;
33
:
:361.
–
372
.
20.
Campagna
BR
,
Weatherley
K
,
Shemesh
E
,
annunziato
RA
.
Adherence to medication during transition to adult services.
.
Pediatr Drugs.
2020;
;
22
:
:501.
–
9
.
21.
Francis
A
,
Johnson
DW
,
Craig
JC
,
Wong
G
.
Moving on: transitioning young people with chronic kidney disease to adult care.
.
Pediatr Nephrol.
2018;
;
33
:
:973.
–
983
.
22.
Crawford
K
,
Wilson
C
,
Low
JK
,
et al.
Transitioning adolescents to adult nephrology care: a systematic review of the experiences of adolescents, parents, and health professionals.
.
Pediatr Nephrol.
2020;
;
35
:
:555.
–
67
.
23.
Groothoff
JW
.
Long-term outcomes of children with end-stage renal disease.
.
Pediatr Nephrol.
2005;
;
20
:
:849.
–
853
.
24.
Johnson
RJ
,
Warady
BA
.
Long-term neurocognitive outcomes of patients with end-stage renal disease during infancy.
.
Pediatr Nephrol.
2013;
;
28
:
:1283.
–
1291
.
25.
Dobbels
F
,
Ruppar
T
,
De Geest
S
,
et al.
Adherence to the immunosuppressive regimen in pediatric kidney transplant recipients: a systematic review.
.
Pediatr Transplant.
2010;
;
14
:
:603.
–
613
.
26.
Kaboré
R
,
Couchoud
C
,
Macher
M-A
,
et al.
Age-dependent risk of graft failure in young kidney transplant recipients.
.
Transplantation.
2017;
;
101
:
:1327.
–
1335
.
27.
Van Arendonk
KJ
,
James
NT
,
Boyarsky
BJ
,
et al.
Age at graft loss after pediatric kidney transplantation: Exploring the high-risk age window.
.
Clin J Am Soc Nephrol.
2013;
;
8
:
:1019.
–
1026
.
28.
Foster
BJ
,
Platt
RW
,
Dahhou
M
,
et al.
The impact of age at transfer from pediatric to adult-oriented care on renal allograft survival.
.
Pediatr Transplant.
2011;
;
15
:
:750.
–
759
.
29.
Ritchie
AG
,
Clayton
PA
,
McDonald
SP
,
Kennedy
SE
.
Age-specific risk of renal graft loss from late acute rejection or non-compliance in the adolescent and young adult period.
.
Nephrology (Carlton).
2018;
;
23
:
:585.
–
591
.
30.
Sabate
AL
Adherence to long-term therapies.
.
Geneva:
:
Evidence for action. World Health Organisation;
,
2003
.
31.
Watson
AR
,
Harden
P
,
Ferris
M
,
et al.
Transition from pediatric to adult renal services: a consensus statement by the International Society of Nephrology (ISN) and the International Pediatric Nephrology Association (IPNA).
.
Pediatr Nephrol.
2011;
;
26
:
:1753.
–
1757
.
32.
Singh
SP
,
anderson
B
,
Liabo
K
,
Ganeshamoorthy
T
.
Guideline committee. Supporting young people in their transition to adults’ services: summary of NICE guidance.
.
BMJ.
2016;
;
353
:
:i2225.
.
33.
Paone
MC
,
Wigle
M
,
Saewyc
E
.
The ON TRAC model for transitional care of adolescents.
.
Prog Transplant.
2006;
;
16
:
:291.
–
302
.
34.
Harden
PN
,
Walsh
G
,
Bandler
N
,
et al.
Bridging the gap: an integrated paediatric to adult clinical service for young adults with kidney failure.
.
BMJ.
2012;
;
344
:
:e3718.
–
e3718
.
35.
Nagra
A
,
McGinnity
PM
,
Davis
N
,
Salmon
AP
.
Implementing transition: Ready Steady Go.
.
Arch Dis Child Educ Pract Ed.
2015;
;
100
:
:313.
.
36.
Raina
R
,
Wang
J
,
Krishnappa
V
,
Ferris
M
.
Pediatric renal transplantation: Focus on current transition care and proposal of the “RISE to transition” protocol.
.
ann Transplant.
2018;
;
23
:
:45.
–
60
.
37.
Lemoine
S
,
Radenac
J
,
Baudouin
V
,
et al.
Transition et transfert de la néphrologie pédiatrique à la néphrologie adulte : recommandations de la filière maladies rénales rares ORKiD.
.
Néphrologie & Thérapeutique.
2021
;
S1769725520304132.
.
39.
Raina
R
,
Wang
J
,
Krishnappa
V
.
Structured transition protocol for children with cystinosis.
.
Front Pediatr.
2017;
;
5
:
:191.
.
40.
European paediatric dialysis working group.
,
Forbes
TA
,
Watson
AR
,
et al.
Adherence to transition guidelines in European paediatric nephrology units.
.
Pediatr Nephrol.
2014;
;
29
:
:1617.
–
1624
.
41.
Kreuzer
M
,
Drube
J
,
Prüfe
J
,
Schaefer
F
,
Pape
L
.
Members of the ERKNet Taskforce ‘QoL & Transition’. Current management of transition of young people affected by rare renal conditions in the ERKNet.
.
Eur J Hum Genet.
2019;
;
27
:
:1783.
–
1790
.
|