| |
| Med Sci (Paris). 38(2): 152–158. doi: 10.1051/medsci/2022007.Circulation du virus de la dengue en Afrique de l’Ouest Une problématique émergente de santé publique Bachirou Tinto,1* Dramane Kania,1 Thérèse Samdapawindé Kagone,1 Amadou Dicko,2 Isidore Traore,1 Nathalie de Rekeneire,3,4 Brice Wilfried Bicaba,5 Hervé Hien,6 Philippe Van de Perre,7 Yannick Simonin,7 and Sara Salinas7 1Laboratoire national de référence des fièvres hémorragiques virales, Centre Muraz, Institut national de santé publique (INSP)
,
Bobo-Dioulasso
,
Burkina Faso 2Laboratoire central de référence, INSP
,
Ouagadougou
,
Burkina Faso 3Centre Muraz, INSP
,
Bobo-Dioulasso
,
Burkina Faso 4Expertise France
,
Paris
,
France 5Centre des opérations de réponse aux urgences sanitaires (CORUS), INSP
,
Ouagadougou
,
Burkina Faso 6INSP
,
Ouagadougou
,
Burkina Faso 7Pathogenèse et contrôle des infections chroniques, université de Montpellier, Inserm, Établissement français du sang
,
60 rue de Navacelles
,
34000Montpellier
,
France |
Vignette (© Bachirou Tinto)
Le terme arbovirus (ou
arthropod-borne virus
) regroupe plusieurs familles de virus transmis aux vertébrés par la piqûre de vecteurs arthropodes hématophages, tels que les moustiques, les tiques et les phlébotomes [
1
]. La dengue est l’arbovirose (maladie causée par un arbovirus) la plus répandue dans le monde, avec environ 390 millions de cas par an dont 96 millions présentent des manifestations cliniques [
2
]. Selon certaines estimations, environ la moitié de la population mondiale serait exposée à la dengue qui est endémique dans plus de 100 pays en Afrique, en Amérique et en Asie. La dengue serait responsable de 25 000 décès par an [
3
]. L’adaptation des espèces, le développement du commerce international, le réchauffement climatique, l’urbanisation et la croissance démographique mal contrôlée ont favorisé l’expansion de la circulation de ce virus à travers différents continents.
La dengue constitue un problème de santé publique dans les zones tropicales et en Asie du Sud et du Sud-Est, où les enfants âgés de cinq à quinze ans représentent la classe d’âge de la population la plus touchée [
4
]. En Afrique de l’Ouest, la circulation du virus chez les populations humaines a été décrite pour la première fois dans les années 1960 au Nigéria [
5
]. Depuis, plusieurs pays d’Afrique ont signalé des cas sporadiques ou des flambées épidémiques associés à ce virus. En Afrique subsaharienne, les cas de dengue sont probablement sous-déclarés, en raison du faible niveau de sensibilisation des soignants, et de la confusion avec d’autres maladies fébriles courantes comme le paludisme [
6
]. En effet, la forte prévalence du paludisme dans cette région rend difficile la détection des arboviroses ainsi que celle des autres maladies fébriles non-palustres du fait de la similitude des symptômes. Environ 70 % des maladies fébriles diagnostiquées en Afrique Sub-saharienne sont ainsi traitées comme des cas de paludisme [
7
]. Des études de population sur les maladies fébriles sont donc nécessaires pour déterminer l’épidémiologie et l’incidence réelle de la dengue en Afrique.
|
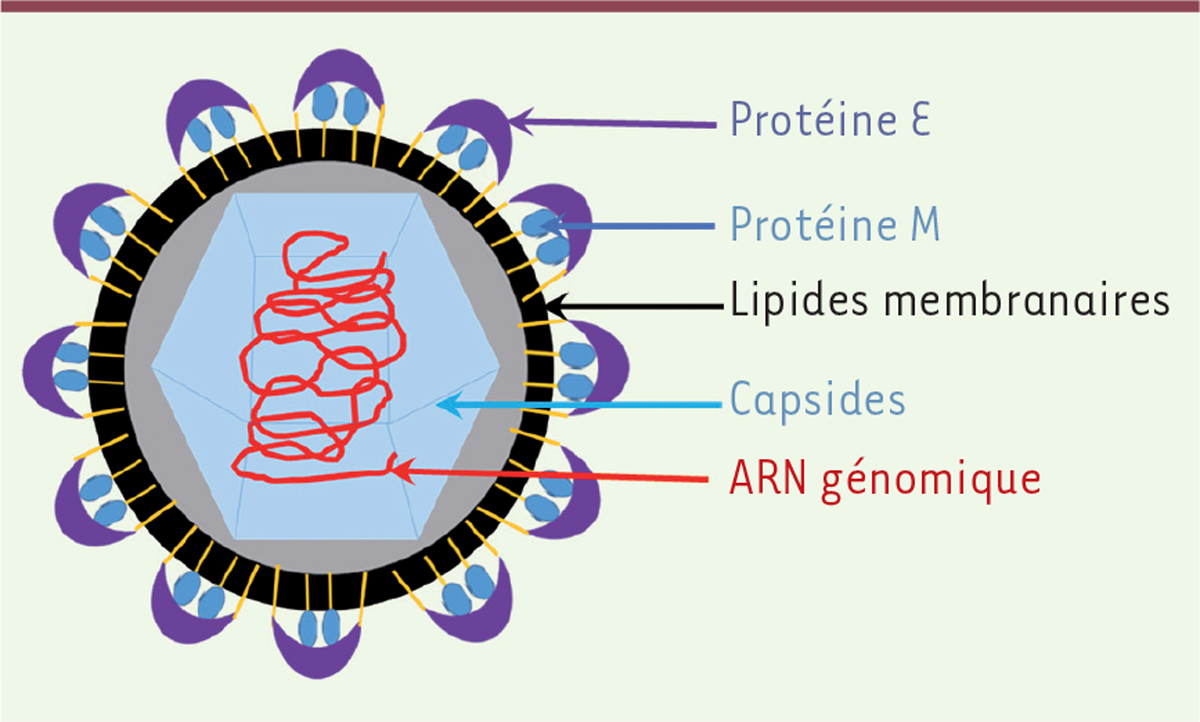
Caractéristiques
Le virus de la dengue (DENV pour
dengue virus
) appartient à la famille des
Flaviviridae
, et au genre Flavivirus. Quatre sérotypes de virus de la dengue existent : DENV-1, DENV-2, DENV-3 et DENV-4. Ces sérotypes sont similaires du point de vue antigénique, mais suffisamment différents pour ne pas conférer une protection croisée à long terme. Le DENV est un virus enveloppé d’un diamètre d’environ 50 nm. Son génome, constitué d’un ARN simple brin de polarité positive d’environ 10 700 nucléotides
(
Figure 1
)
, code trois protéines structurales formant les composants du virion, et sept protéines non structurales (NS1, NS2A, NS2B, NS3, NS4A, NS4B et NS5) impliquées dans la réplication de l’ARN viral [
8
]. Les trois protéines structurales sont des composants de la particule virale mature. Elles correspondent à la protéine membranaire (prM/M), la glycoprotéine d’enveloppe (E) et la protéine de capside (C). La glycoprotéine E est impliquée dans la liaison du virus aux récepteurs cellulaires mais aussi dans l’hémagglutination des érythrocytes et dans l’induction de la réponse immunitaire de l’hôte [
8
]. Les protéines NS sont uniquement exprimées dans la cellule infectée [
8
]. NS1 et NS4B sont associées à la pathogénicité de la dengue. Il existe en effet une corrélation entre la concentration plasmatique de NS1 et la sévérité clinique de la maladie [
9
]. NS1 est ainsi utilisée comme marqueur diagnostique de l’infection. Cette protéine peut également interagir avec le système immunitaire de l’hôte et moduler la réponse des lymphocytes T [
10
].
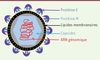 | Figure 1.
Structure du virus de la dengue.
|
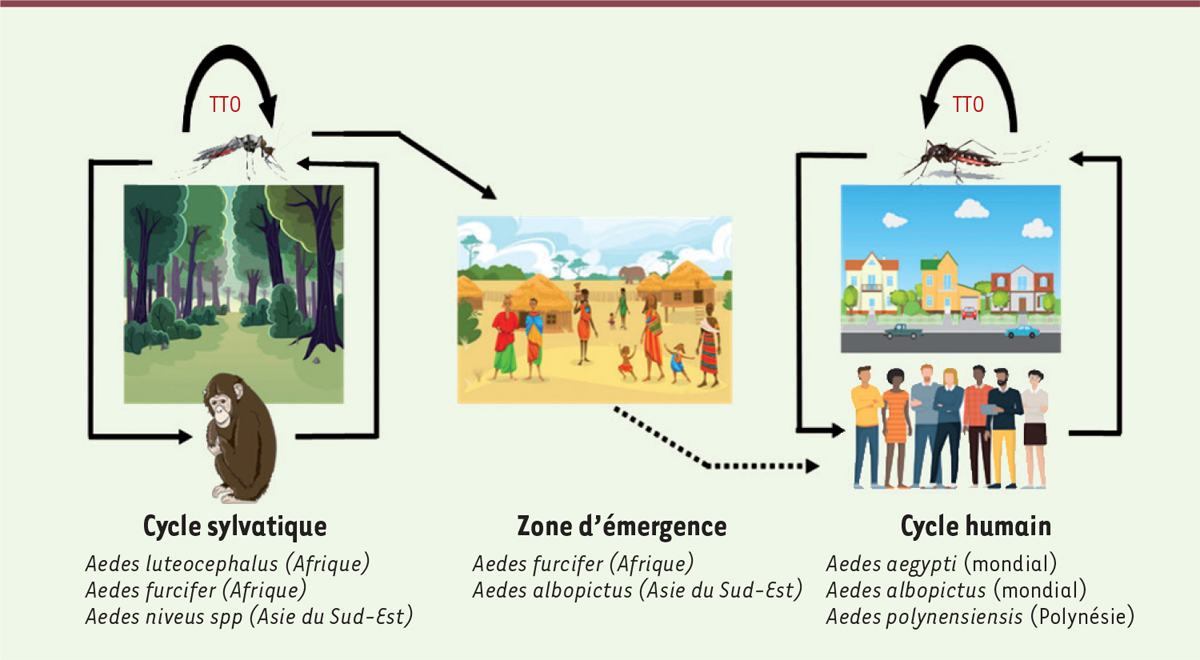
Modes de transmission
La dengue est transmise par la piqûre des moustiques du genre
Aedes,
principalement
Aedes albopictus
et
Aedes aegypti
[
11
]. Originaire d’Afrique [
6
],
Aedes aegypti
est présent dans tous les pays du continent africain. La transmission de la dengue suit deux cycles : un cycle sylvatique au cours duquel le virus circule entre les primates non humains et des moustiques du genre
Aedes
(
Aedes luteocephalus et Aedes furcifer
), et un cycle urbain dans lequel le virus circule entre les hommes et les moustiques urbains
(Aedes aegypti
et
Aedes albopictus)
[
11
]
(
Figure 2
)
. Les moustiques du genre
Aedes
ont une activité diurne : ils effectuent leur repas sanguin principalement pendant la journée. Ils s’infectent à la suite d’un repas sanguin sur des hôtes vertébrés ayant une virémie élevée ; la période habituelle de virémie chez l’homme est d’environ cinq jours [
12
]. Le virus ingéré par le moustique migre du tractus intestinal de l’insecte jusqu’à ses glandes salivaires : ce processus, appelé phase extrinsèque, dure environ dix jours. Il peut être accéléré lorsque la température ambiante est élevée [
12
]. Après cette période d’incubation, le moustique sera susceptible d’infecter l’homme lors d’un repas sanguin, en injectant sa salive chargée de particules virales infectieuses [
12
].
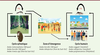 | Figure 2.
Cycles de transmission du virus de la dengue.
Le cycle sylvatique se produit en zone forestière et implique les primates et les moustiques sauvages du genre
Aedes
. La zone d’émergence est constituée par les habitations à proximité de ces forêts. Le cycle avec la transmission aux hommes est induit par l’infection par les moustiques urbains. TTO : transmission transovarienne.
|
Bien que le mode de transmission privilégié de la dengue soit par piqûre de moustique, plusieurs autres modes de transmission non vectorielle ont été rapportés. Ainsi, des cas de transmission par transfusion sanguine [
13
], par accident d’exposition aux liquides biologiques chez les personnels de santé (transmission nosocomiale) [
14
] et de transmission mère-enfant (transmission verticale) [
15
], en particulier par l’allaitement maternel [
16
], ont été observés.
|
Physiopathologie et manifestations cliniques
La période d’incubation de la dengue varie d’une personne à l’autre, en fonction de son statut immunitaire [
17
]. Cette période dure de quatre à sept jours (pouvant atteindre onze jours) chez les personnes partiellement immunisées [
17
]. À la suite de la contamination, le virus entre dans les cellules dendritiques immatures de la peau en utilisant des récepteurs non spécifiques, comme DC-SIGN (
dendritic cell-specific intercellular adhesion molecule-3-grabbing non-integrin
), un récepteur de lectine de type C. Les cellules dendritiques infectées migrent ensuite vers les ganglions lymphatiques dans lesquels les antigènes viraux qu’elles présentent seront reconnus par les lymphocytes T, déclenchant alors des réponses immunitaires cellulaires et humorales [
12
]. Une importante réplication virale a également été observée dans les cellules parenchymateuses du foie et dans les macrophages des ganglions lymphatiques du foie et de la rate.
La maladie revêt différentes formes plus ou moins graves. Selon le tableau clinique, l’Organisation mondiale de la santé (OMS) classe ainsi la dengue en deux catégories : la dengue avec ou sans signe d’alerte et la dengue sévère. La gravité de la maladie dépend du sérotype du virus infectant, les sérotypes divergeant génétiquement les uns des autres. Certaines études tendent ainsi à montrer que le sérotype 2 (DENV-2) serait plus susceptible de provoquer des cas graves [
18
]. Des infections séquentielles par différents sérotypes augmenteraient également le risque de complications, pouvant entraîner un syndrome de choc (diminution aiguë du volume intravasculaire résultant de la fuite plasmatique ou sanguine) et le décès du patient [
19
]. Ce tableau clinique a pour origine le mécanisme d’ADE (
antibody-dependent enhancement
), un mécanisme de facilitation de l’infection par les anticorps, dont la dengue est l’un des prototypes : les anticorps, produits par les lymphocytes B mémoires éduqués lors de l’infection par un premier sérotype et réactivés lors d’une seconde infection, ne neutralisent pas le virus si son sérotype est différent [
20
]. Au contraire, ils formeraient avec les nouvelles particules virales des complexes qui favoriseraient l’infection des cellules myéloïdes (monocytes et macrophages) en permettant l’entrée du virus
via
la fixation des immunoglobulines complexées au virus à leurs récepteurs (les récepteurs de la région Fc des immunoglobulines, RFc) présents sur ces cellules, augmentant ainsi la réplication virale. L’infection des cellules myéloïdes, qui conduit à une présentation de différents antigènes viraux, induit alors une augmentation du nombre de lymphocytes T mémoire ayant une réactivité croisée contre différents sérotypes du virus [
21
]. Produits lors d’une primo-infection, ces lymphocytes T se multiplient massivement lors d’une seconde infection. Ils sécrètent alors de grandes quantités de cytokines pro-inflammatoires, telles que l’IFN-g (interféron gamma) et le TNF-α (
tumor necrosis factor alpha
) [
20
], ainsi que de médiateurs vasoactifs, qui sont à l’origine d’une augmentation de la perméabilité capillaire, provoquant le syndrome de perméabilité vasculaire aiguë responsable de la dengue hémorragique [
3
]. La sévérité de ce syndrome est fonction de l’âge du patient et serait plus sévère chez les jeunes enfants [
12
]. Le mécanisme d’ADE a également été observé entre des virus différents, chez des patients ayant été exposés au virus Zika et ayant secondairement contracté la dengue [
22
].
La survenue des formes graves pourrait également être liée à des facteurs génétiques de l’hôte. Les Africains et les personnes d’ascendance africaine pourraient en effet présenter une certaine résistance génétique face à la dengue [
23
]. Une étude a été menée pour tester l’ADE dans le contexte de l’infection par le virus de la dengue. Elle a été réalisée en utilisant des cellules mononucléées isolées du sang périphérique soit de personnes d’ascendance africaine soit de personnes d’ascendance européenne ayant été exposées au sérotype 1 du virus et présentant, ou non, des anticorps anti-DENV-1. Ces différentes cellules ont été infectées par le sérotype 2 du virus (DENV-2). Dans les cellules des personnes d’ascendance africaine, présentant ou non des anticorps anti-DENV-1, aucune réplication de DENV-2 n’a été observée. Au contraire, dans les cellules des personnes d’ascendance européenne, qui avaient des anticorps anti-DENV-1, une importante augmentation de la multiplication virale a été mesurée [
23
].
Bien que, dans la majorité des cas, la dengue soit asymptomatique ou bénigne, certains patients présentent des manifestations cliniques allant d’une simple fièvre à des formes graves, voire mortelles [
19
]. La fièvre s’accompagne souvent d’autres symptômes : myalgie, arthralgie, anorexie, douleurs rétro-orbitaires, nausées et vomissements, mal de gorge, céphalées, éruption cutanée. Dans les formes graves (dengues hémorragiques), les patients présentent une thrombocytopénie, une fuite plasmatique (augmentation du taux d’hématocrite), un épanchement pleural avec une hypoalbuminémie ou une hypoprotéinémie, ainsi qu’une augmentation de la perméabilité vasculaire pouvant entraîner des complications hémorragiques majeures ou mineures, avec ou sans syndrome de choc. Chez certains patients, des atteintes neurologiques ont également été observées : syndrome de Guillain-Barré, myélite, encéphalites et méningites. Ce sont les sérotypes 2 et 3 qui sont le plus à l’origine de complications neurologiques ; des antigènes viraux ont été détectés dans le système nerveux central et dans le liquide céphalo-rachidien [
24
]. Une étude réalisée chez la souris a ainsi montré que le virus pouvait entraîner une rupture des jonctions serrées de la barrière hémato-encéphalique et causer un œdème cérébral vasogénique. Ce phénomène qui semble se produire également chez l’homme, est provoqué par une réponse immunitaire marquée par une forte production de cytokines induite lors de l’infection [
25
].
|
Épidémiologie : circulation du virus en Afrique
La dengue est endémique dans la plupart des régions tropicales et subtropicales dans lesquelles elle constitue l’une des principales causes de maladie [
4
]. Cette virose s’est rapidement répandue à travers le monde et, actuellement, plus de la moitié de la population mondiale vit dans des zones à risque [
4
]. L’Asie est le continent le plus touché, suivi de l’Amérique et, plus récemment, de l’Afrique [
26
].
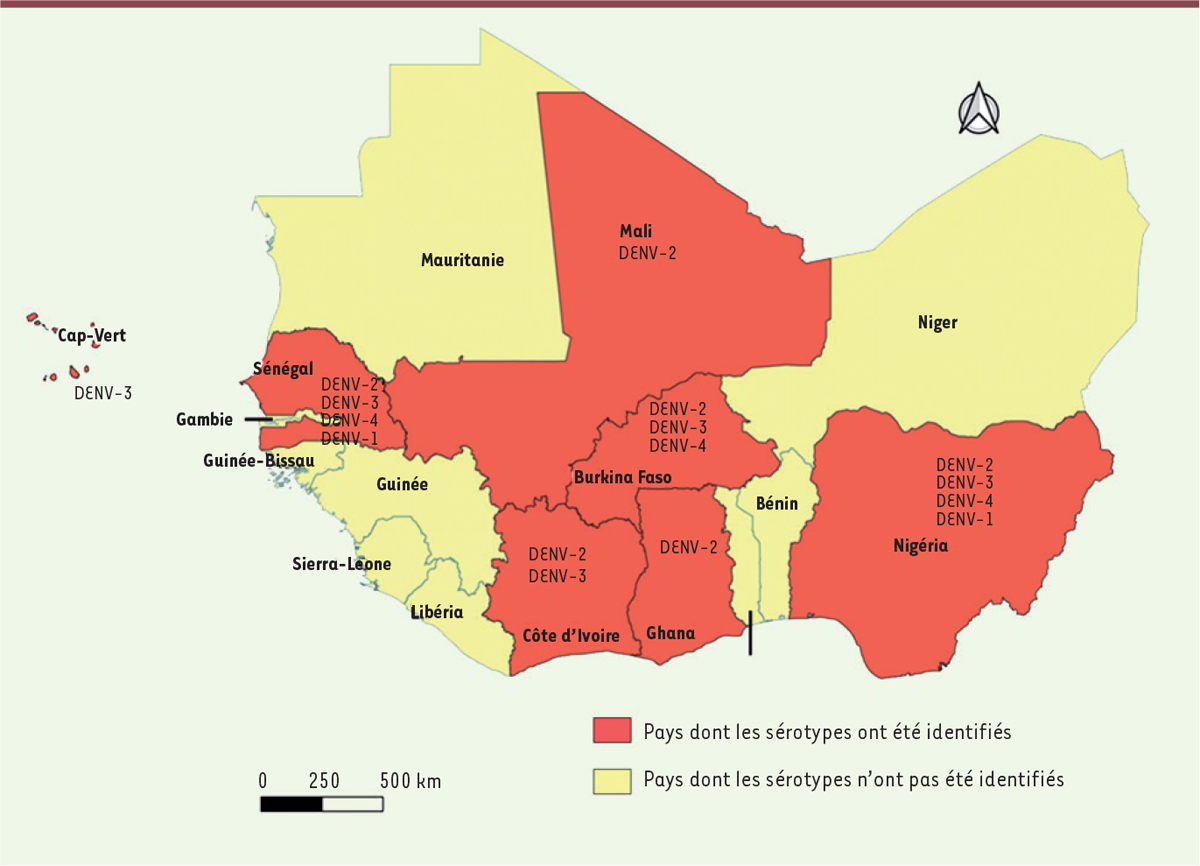
La première épidémie de dengue documentée en Afrique est survenue à Durban, en Afrique du Sud, en 1927 [
27
]. Bien que des études supplémentaires soient nécessaires pour mieux comprendre l’épidémiologie de la dengue en Afrique, les données publiées rapportent que 22 pays africains ont déclaré entre 1960 et 2010 des cas sporadiques ou des épidémies de dengue [
28
]. La maladie est aujourd’hui endémique dans plus de 34 pays africains [
6
]. Une transmission sylvatique du sérotype 2 a été rapportée au Sénégal et au Burkina Faso avec la notification de cas sporadiques. Les sérotypes 1 et 2 ont été rendus responsables de la majorité des épidémies sur le continent [
6
,
29
]. À partir des années 2000, le sérotype 3 a également été détecté en Afrique de l’Ouest, notamment au Burkina Faso (en 2003, 2004, 2007 et 2014) et en Côte d’Ivoire en 2008. En 2009, ce sérotype était responsable des épidémies survenues au Sénégal [
30
,
31
]. Au Mali, une étude de séroprévalence a montré une circulation de la dengue en 2006 [
32
]. Le sérotype 4, qui n’avait jamais été associé à une épidémie en Afrique, a été détecté pour la première fois en Angola et au Sénégal, en 1980 [
27
]. Plus récemment, une épidémie de dengue à virus de sérotypes 1, 2 et 3, avec des manifestations hémorragiques, a été signalée au Burkina Faso en 2016 [
33
]. La Côte d’Ivoire a également connu une épidémie de dengue en 2017 et le Ghana a enregistré des cas de dengue entre 2016 et 2017 [
1
]
(
Figure 3
)
.
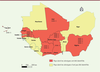 | Figure 3.
Distribution des sérotypes de la dengue (DENV) en Afrique de l’Ouest.
|
|
Le diagnostic de la dengue et la problématique des ictères fébriles en Afrique
En Afrique de l’Ouest, le diagnostic des ictères fébriles pose un réel problème de santé publique. Les ictères fébriles peuvent être causés par différentes infections : parasitaires (paludisme), bactériennes (fièvre typhoïde, leptospirose), ou virales (dengue, hépatites) [
34
]. La similarité des symptômes existant entre ces maladies rend difficile le diagnostic, pouvant conduire à des erreurs dans la prise en charge clinique des patients [
34
]. Il est donc essentiel d’identifier les pathogènes responsables de ces maladies en recourant à un diagnostic biologique spécifique (sérologique ou moléculaire). Ces diagnostics biologiques requièrent des équipements de qualité et un personnel formé, ce qui n’est pas toujours le cas dans les pays à faible revenu où, souvent, les équipements manquent dans les laboratoires nationaux. Les pénuries d’eau et le manque d’électricité dans certaines régions ont également un impact considérable sur la qualité des analyses de laboratoire.
Les causes réelles d’ictères fébriles ne sont donc pas documentées et elles sont le plus souvent traitées par le clinicien, faute d’informations, comme des cas de paludisme, le conduisant à une prise en charge thérapeutique erronée qui peut avoir des conséquences importantes sur l’évolution de l’état de santé des patients [
7
].
Différentes approches permettent le diagnostic biologique de la dengue : isolement du virus, après culture
ex vivo
sur cellules ; détection directe de l’ARN génomique viral par RT-PCR (transcription inverse suivie de réaction en chaîne par polymérase) à partir du sang du patient ; détection de la protéine NS1 virale sécrétée dans le sang, par
enzyme-linked immunosorbent assay
(ELISA) (tests immuno-enzymatiques de capture d’antigène) ; évaluation de la réponse immunitaire de l’hôte par la mesure des taux sanguins d’IgM (immunoglobulines d’isotype M) et d’IgG spécifiques du virus [
19
]. La RT-PCR et l’ELISA ont progressivement remplacé l’isolement du virus, qui était la méthode de diagnostic traditionnelle pour détecter une infection par la dengue [
19
].
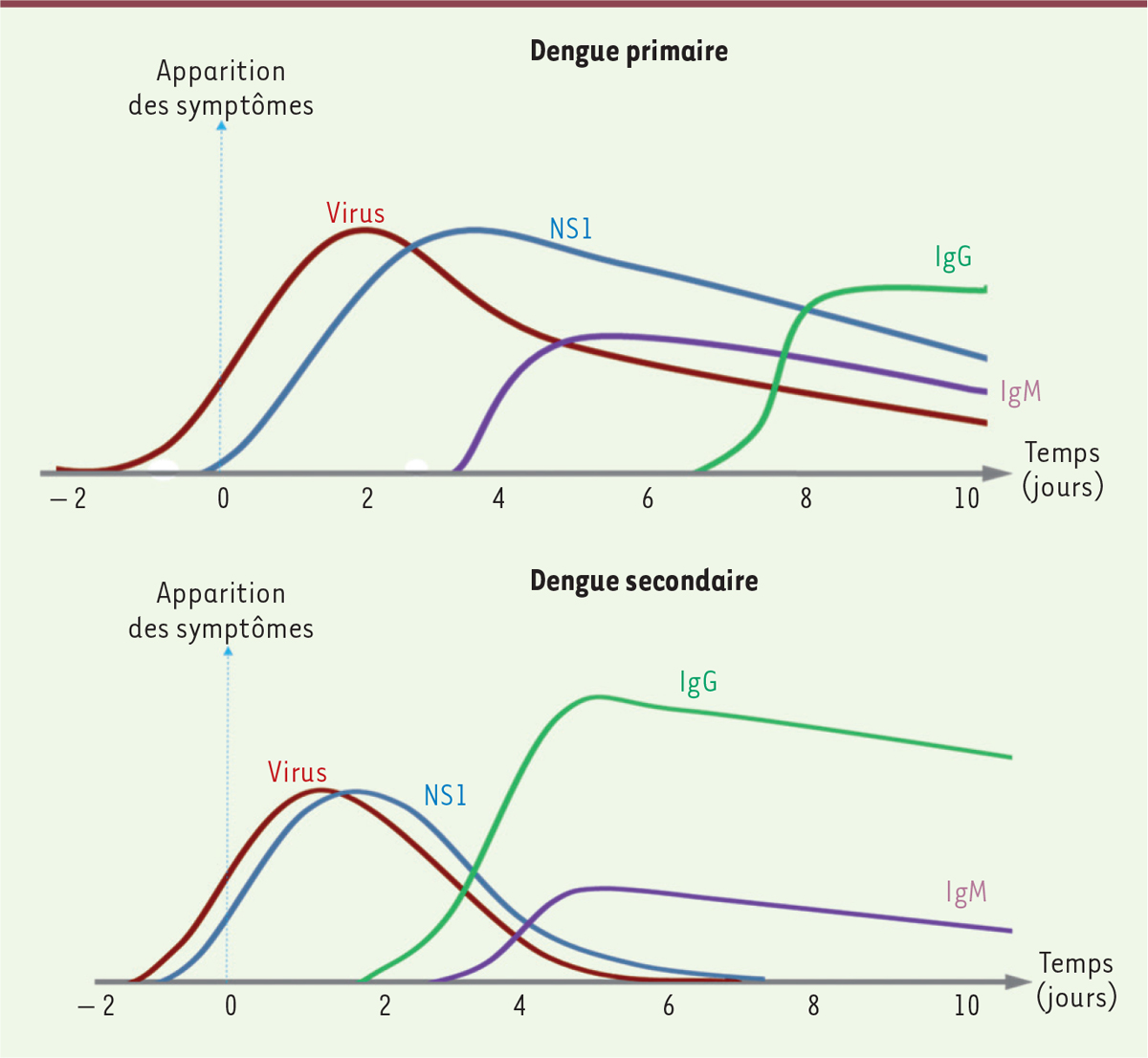
L’algorithme utilisé pour le diagnostic est fondé sur la cinétique des marqueurs d’infection
(
Figure 4
)
. Au cours d’une infection primaire, le virus et sa protéine NS1 peuvent être détectés très tôt au début de la maladie. Les IgM spécifiques apparaissent autour du troisième jour de la maladie et les IgG vers la fin de la période aiguë, c’est-à-dire environ sept jours après les premiers signes cliniques. Lors d’une infection secondaire, ce sont les IgG qui apparaissent au début de la phase aiguë de la maladie. La détection de NS1 et celle du virus dans le sang sont également plus précoces [
19
]
 | Figure 4.
Cinétique de l’apparition des biomarqueurs de la dengue (virus, IgM et IgG spécifiques, protéine non structurale NS1) chez les patients présentant une infection primaire (en haut) et secondaire (en bas).
|
La technique de RT-PCR permet la détection de l’ARN viral dès le début de la maladie avec une bonne spécificité et une bonne sensibilité. Cette technique est rapide, facile à réaliser et moins coûteuse que les méthodes d’isolement viral et de culture cellulaire [
19
]. Cependant, elle nécessite un équipement spécial avec du personnel formé, ce qui n’est pas toujours le cas de nombreux pays à faible revenu comme certains pays d’Afrique de l’Ouest. Bien qu’il existe de nombreux tests commerciaux utilisant la RT-PCR, la plupart sont développés en interne et manquent souvent de standardisation.
De nombreux tests sérologiques commerciaux ou développés par les laboratoires sont disponibles. Cependant, ce type de tests donne des résultats qui sont difficiles à interpréter en Afrique de l’Ouest. En effet, plusieurs Flavivirus circulent dans cette région et des réactions immunitaires croisées, liées à la présence de la protéine d’enveloppe E chez tous ces virus, existent [
19
]. Ces réactions croisées peuvent donc être à l’origine de résultats faussement positifs et non spécifiques. Il est cependant possible de coupler les tests sérologiques (IgM et IgG) à des tests de capture de l’antigène NS1, pour une meilleure interprétation des résultats [
19
]. Le test de séroneutralisation, ou test de neutralisation par réduction de plaques, reste une bonne alternative pour remédier au problème des réactions croisées, même si ces tests manquent souvent de standardisation et nécessitent du personnel très bien formé.
Des tests commerciaux de diagnostic rapide de la dengue (
SD Bioline
,
Abbott
®
) ont été homologués par l’OMS. Ils pourraient être utilisés pour orienter les cliniciens dans la prise en charge clinique. Ces tests permettent en effet de détecter la protéine NS1 et les IgM et IgG avec une spécificité de 98 % et une sensibilité de 92 %. Cependant, ces tests ne sont pas toujours accessibles dans les pays à ressources limitées.
Ces dernières décennies, de nombreux efforts ont été consentis par l’OMS afin d’améliorer la surveillance et le contrôle de la dengue par la mise à disposition de nouvelles stratégies et de nouveaux outils pour les acteurs de la santé de différents pays [
12
]. En Afrique de l’Ouest, certains pays ont mis en place des laboratoires nationaux de référence pour la surveillance et le diagnostic des arbovirus, tels que la dengue. C’est le cas du Burkina Faso, avec la création, en 2017, du laboratoire national de référence des fièvres hémorragiques virales qui a en charge la surveillance des arboviroses par site sentinelle, et le diagnostic de la dengue, des ictères fébriles et des autres maladies apparentées.
|
Il n’existe à ce jour aucun traitement curatif contre la dengue ; le traitement disponible est en effet uniquement symptomatique. En plus du repos, les patients doivent s’hydrater régulièrement pour lutter contre la déshydratation en cas de diarrhées et de vomissements et, en cas de fièvre, des analgésiques et des antipyrétiques sont prescrits. L’aspirine est à éviter, pouvant augmenter les risques d’hémorragie par altération de la fonction plaquettaire [
35
].
Le meilleur moyen de lutte contre la dengue demeure ainsi la prévention. Celle-ci repose sur la lutte contre les vecteurs (moustiques) et sur le développement d’un vaccin. Depuis 2016,
Sanofi Pasteur
développe un vaccin appelé Dengvaxia®. Mais celui-ci a montré de nombreuses limites, notamment une efficacité moindre chez les personnes n’ayant jamais été infectées par rapport à celles ayant déjà fait une primo-infection, ainsi qu’une augmentation de survenue de dengue sévère chez les jeunes enfants. Ce vaccin augmenterait également le risque de survenue d’une dengue sévère chez des sujets vaccinés et n’ayant jamais été en contact avec le virus [
36
], sans doute en raison du mécanisme d’ADE dû à la réponse immunitaire induite par la vaccination. Ce vaccin n’est ainsi indiqué que pour les personnes vivant dans des zones d’endémie et ayant un antécédent prouvé d’infection. D’autres candidats vaccins sont en cours d’évaluation [
12
]. La lutte anti-vectorielle et la protection individuelle restent donc actuellement les meilleurs moyens de prévention pour réduire la propagation du virus. La lutte anti-vectorielle repose sur la destruction des gites larvaires et la pulvérisation d’insecticides dans les domiciles. Mais cela nécessite d’impliquer les communautés villageoises et citadines avec des campagnes de sensibilisation. Un tel engagement communautaire a montré son efficacité en Amérique centrale et en Amérique du Sud avec la réduction de la transmission de la dengue, ce qui n’est pas le cas en Afrique [
37
]. Il est nécessaire que les gouvernements mettent en place des stratégies de surveillance entomologique et de lutte anti-vectorielle et organisent des campagnes de sensibilisation des populations afin de les impliquer davantage dans la lutte contre la prolifération des vecteurs. Une étude réalisée au Burkina Faso rapporte que plus de 95 % des ménages approuvaient les interventions proposées par le gouvernement dans la prévention contre la dengue lors des épidémies de 2016 et 2017 et seraient disposés à s’y investir [
37
]. Ces interventions concernaient la sensibilisation des ménages sur la transmission de la dengue, l’identification et l’élimination des gîtes de reproduction des moustiques et l’utilisation d’insecticides non dangereux pour la santé dans les domiciles [
37
]. En Afrique de l’Ouest, la lutte anti-vectorielle reste difficile en raison de son coût élevé, et du fait que la dengue n’est pas toujours une priorité dans la majorité des pays endémiques.
|
La dengue est devenue aujourd’hui la maladie arbovirale la plus répandue dans le monde. Même si, dans la majorité des cas, l’infection est bénigne, elle présente parfois des manifestations cliniques, allant d’une simple fièvre à des formes graves pouvant entraîner le décès du patient. En Afrique de l’Ouest, les cas de dengue sont sous-évalués et la maladie est souvent confondue avec le paludisme, comme c’est le cas de plusieurs autres infections fébriles. Il est donc nécessaire de mettre en place des systèmes de surveillance des infections fébriles d’origine inconnue en Afrique en renforçant les capacités diagnostiques des laboratoires nationaux. Des études de séroprévalence en population générale pourraient également permettre de cartographier plus précisément la circulation de la dengue dans ces régions afin de prévenir sa dissémination.
Tableau I.
| Pays |
Année |
Sérotype |
Référence |
|
Burkina Faso
|
1925, 2007, 2013, 2016, 2017 |
1, 2, 3, 4 |
[
29
–
31
]
|
|
|
Côte d’Ivoire
|
2006, 2007, 2008, 2017 |
3, 2 |
[
27
,
32
]
|
|
|
Nigéria
|
1964-1968, 1972-1975, 2008, 2014 |
1, 2, 3, 4 |
[
33
,
34
]
|
|
|
Ghana
|
1932, 1987, 1993, 2002-2005, 2016-2017 |
2 |
[
1
,
6
]
|
|
|
Cap-Vert
|
2009 |
3 |
[
6
]
|
|
|
Mali
|
2006 |
2 |
[
35
]
|
|
|
Sénégal
|
1927, 1928, 2007, 2009 |
1, 2, 3, 4 |
[
6
,
27
]
|
|
|
Togo
|
1987, 1993, 1999, 2002 |
- |
[
6
]
|
|
|
Bénin
|
1987, 1993, 2006 |
- |
[
6
,
27
]
|
Situation épidémiologique de la dengue en Afrique de l’Ouest. |
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
1.
Manu
SK
,
Bonney
JHK
,
Pratt
D
,
et al.
Arbovirus circulation among febrile patients at the greater Accra Regional Hospital, Ghana.
.
BMC Res Notes.
2019
;
:12.
.
2.
Beltrán-Silva
SL
,
Chacón-Hernández
SS
,
Moreno-Palacios
E
,
et al.
Clinical and differential diagnosis: Dengue, chikungunya and Zika.
.
Revista Médica del Hospital General de México.
2018;
;
81
:
:146.
–
153
.
3.
Gubler
DJ
.
Dengue and Dengue Hemorrhagic Fever.
.
CABI Publishing;
,
1998
,
:496.
p.
4.
Guzman
MG
,
Gubler
DJ
,
Izquierdo
A
,
et al.
Dengue infection. Nat Rev Dis Primers.
2016;
;
2
:
:1.
–
25
.
5.
Moore
DL
,
Causey
OR
,
Carey
DE
,
et al.
Arthropod-borne viral infections of man in nigeria, 1964–1970.
.
Ann Trop Med Parasitol.
1975;
;
69
:
:49.
–
64
.
6.
Amarasinghe
A
,
Kuritsky
JN
,
William Letson
G
,
et al.
Dengue virus infection in Africa.
.
Emerg Infect Dis.
2011;
;
17
:
:1349.
–
1354
.
7.
Stoler
J
,
Dashti
R
al,
Anto
F
,
et al.
Deconstructing “malaria”: West Africa as the next front for dengue fever surveillance and control.
.
Acta Trop.
2014;
;
134
:
:58.
–
65
.
8.
Perera
R
,
Kuhn
RJ
.
Structural proteomics of dengue virus.
.
Curr Opin Microbiol.
2008;
;
11
:
:369.
–
377
.
9.
Libraty
DH
,
Young
PR
,
Pickering
D
,
et al.
High Circulating Levels of the Dengue Virus Nonstructural Protein NS1 Early in Dengue Illness Correlate with the Development of Dengue Hemorrhagic Fever.
.
J Infect Dis.
2002;
;
186
:
:1165.
–
1168
.
10.
Diamond
MS
,
Pierson
TC
.
Molecular Insight into Dengue Virus Pathogenesis and Its Implications for Disease Control.
.
Cell.
2015;
;
162
:
:488.
–
492
.
11.
Hanley
KA
,
Monath
TP
,
Weaver
SC
,
et al.
Fever versus fever: The role of host and vector susceptibility and interspecific competition in shaping the current and future distributions of the sylvatic cycles of dengue virus and yellow fever virus.
.
Infect Genet Evol.
2013;
;
19
:
:292.
–
311
.
12.
Guzman
MG
,
Halstead
SB
,
Artsob
H
,
et al.
Dengue: A continuing global threat.
.
Nat Rev Microbiol.
2010;
;
8
:
:S7.
–
S16
.
13.
Wilder-Smith
A
,
Chen
LH
,
Massad
E
,
et al.
Threat of dengue to blood safety in dengue-endemic countries.
.
Emerg Infect Dis.
2009;
;
15
:
:8.
–
11
.
14.
Chen
LH
,
Wilson
ME
.
Transmission of dengue virus without a mosquito vector: nosocomial mucocutaneous transmission and other routes of transmission.
.
Clin Infect dis.
2004;
;
39
:
:e56.
–
e60
.
15.
Basurko
C
,
Matheus
S
,
Hildéral
H
,
et al.
Estimating the risk of vertical transmission of dengue: A prospective study.
.
Am J Trop Med Hyg.
2018;
;
98
:
:1826.
–
1832
.
16.
Perre
P
Van de, Molès
JP
,
Nagot
N
,
et al.
Revisiting Koch’s postulate to determine the plausibility of viral transmission by human milk.
.
Pediat Allergy Immunol.
2021;
;
00
:
:pai.13473.
.
17.
Siler
JF
,
Hall
MW
,
Hitchens
AP
.
Dengue: Its History, Epidemiology, Mechanism of Transmission, Etiology, Clinical Manifestations, Immunity, and Prevention.
.
Philipp J Sci.
1926
;
:29.
.
18.
Balmaseda
A
,
Hammond
SN
,
Pérez
L
,
et al.
Serotype-specific differences in clinical manifestations of dengue.
.
Am J Trop Med Hyg.
2006;
;
74
:
:449.
–
456
.
19.
Muller
DA
,
Depelsenaire
ACI
,
Young
PR
.
Clinical and laboratory diagnosis of dengue virus infection.
.
J Infect Dis.
2017;
;
215
:
:S89.
–
S95
.
20.
Mangada
MM
,
Rothman
AL
.
Altered Cytokine Responses of Dengue-Specific CD4 + T Cells to Heterologous Serotypes.
.
J Immunol.
2005;
;
175
:
:2676.
–
2683
.
21.
Mongkolsapaya
J
,
Dejnirattisai
W
,
Xu
XN
,
et al.
Original antigenic sin and apoptosis in the pathogenesis of dengue hemorrhagic fever.
.
Nat Med.
2003;
;
9
:
:921.
–
927
.
22.
Katzelnick
LC
,
Narvaez
C
,
Arguello
S
,
et al.
Zika virus infection enhances future risk of severe dengue disease.
.
Science.
2020;
;
369
:
:1123.
–
8
.
23.
Sierra
BDLC
,
Kourí
G
,
Guzmán
MG
.
Race: A risk factor for dengue hemorrhagic fever.
.
Arch Virol.
2007;
;
152
:
:533.
–
542
.
24.
Puccioni-Sohler
M
,
Orsini
M
,
Soares
CN
.
Dengue: A new challenge.
.
Neurol Int.
2012;
;
4
:
:65.
–
70
.
25.
Chaturvedi
UC
,
Dhawan
R
,
Khanna
M
,
et al.
Breakdown of the blood-brain barrier during dengue virus infection of mice.
.
J Gen Virol.
1991;
;
72
:
:859.
–
866
.
26.
Whitehorn
J
,
Farrar
J
.
Dengue.
.
Br Med Bull.
2010;
;
95
:
:161.
–
173
.
27.
Franco
L
,
di Caro
A
,
Carletti
F
,
et al.
Recent expansion of dengue virus serotype 3 in West Africa.
.
Eurosurveillance.
2010;
;
15
:
:1.
–
4
.
28.
Murray
NEA
,
Quam
MB
,
Wilder-Smith
A
.
Epidemiology of dengue: Past, present and future prospects.
.
Clin Epidemiol.
2013;
;
5
:
:299.
–
309
.
29.
World Health Organization.
.
Report of the Scientific Working Group meeting on Dengue.
.
Geneva:
;
1–5 October 2006.
.
:2006.
.
30.
Ridde
V
,
Agier
I
,
Bonnet
E
,
et al.
Presence of three dengue serotypes in Ouagadougou (Burkina Faso): Research and public health implications.
.
Infect Dis Poverty.
2016;
;
5
:
:23.
.
31.
Ninove
L
,
Parola
P
,
Baronti
C
,
et al.
Dengue virus type 3 infection in traveler returning from West Africa.
.
Emerg Infect Dis.
2009;
;
15
:
:1871.
–
1872
.
32.
Phoutrides
EK
,
Coulibaly
MB
,
George
CM
,
et al.
Dengue virus seroprevalence among febrile patients in Bamako, Mali: Results of a 2006 surveillance study.
.
Vector Borne Zoonotic Dis.
2011;
;
11
:
:1479.
–
1485
.
33.
Eldin
C
,
Gautret
P
,
Nougairede
A
,
et al.
Identification of dengue type 2 virus in febrile travellers returning from Burkina Faso to France, related to an ongoing outbreak, October to November 2016.
.
Eurosurveillance.
2016
;
:21.
.
34.
Gulati
S
,
Maheshwari
A
.
Dengue fever-like illnesses: How different are they from each other?
.
Scand J Infect Dis.
2012;
;
44
:
:522.
–
530
.
35.
Tuiskunen
Bäck A
,
Lundkvist
Å
.
Dengue viruses – an overview.
.
Infect Ecol Epidemiol.
2013;
;
3
:
:19839.
.
36.
Sridhar
S
,
Luedtke
A
,
Langevin
E
,
et al.
Effect of Dengue Serostatus on Dengue Vaccine Safety and Efficacy.
.
N Engl J Med.
2018;
;
379
:
:327.
–
340
.
37.
Ouédraogo
S
,
Degroote
S
,
Barro
SA
,
et al.
Recurrence of dengue epidemics in Burkina Faso: Community preference for an intervention to prevent the disease.
.
Revue d’Epidemiologie et de Sante Publique.
2019;
;
67
:
:375.
–
382
.
38.
Lim
JK
,
Seydou
Y
,
Carabali
M
,
et al.
Clinical and epidemiologic characteristics associated with dengue during and outside the 2016 outbreak identified in health facility-based surveillance in Ouagadougou.
.
Burkina Faso. PLoS Negl Trop Dis.
2019;
;
13
:
:e0007882.
.
39.
Onoja
AB
,
Adeniji
JA
,
Olaleye
OD
.
High rate of unrecognized dengue virus infection in parts of the rainforest region of Nigeria.
.
Acta Trop.
2016;
;
160
:
:39.
–
43
.
40.
Fagbami
AH
,
Onoja
AB
.
Dengue haemorrhagic fever: An emerging disease in Nigeria.
.
West Africa. J Infect Public Health.
2018;
;
11
:
:757.
–
762
.
|