Le syndrome de Gougerot-Sjögren est une maladie auto-immune caractérisée par une infiltration lymphocytaire des glandes exocrines, principalement lacrymales et salivaires, et par la production d’autoanticorps contre des antigènes nucléaires solubles [ 1 ]. Cette maladie inflammatoire chronique se manifeste souvent par une triade associant sécheresse (oculaire, buccale, cutanée, génitale, ou bronchique), douleur (articulaire ou musculaire), et fatigue. Elle touche entre 0,1 et 0,4 % de la population adulte, principalement les femmes, avec un pic d’incidence entre 55 et 65 ans. Le diagnostic en est difficile, souvent retardé de plusieurs années, en raison de sa présentation clinique hétérogène et de sa progression insidieuse. Celle-ci peut se compliquer d’une atteinte pulmonaire, neurologique, ou rénale, et le risque de développer un lymphome est majoré. Le diagnostic repose actuellement sur une combinaison de critères cliniques, sérologiques, histologiques et fonctionnels, ces derniers mesurant la détérioration de la qualité de vie des patients. Bien que de nombreux travaux aient souligné l’implication physiopathologique des interférons [ 2 ], les mécanismes immunopathologiques à l’origine des manifestations cliniques restent mal compris. Le traitement est principalement symptomatique, visant à améliorer la qualité de vie du patient, et n’agit pas sur la progression de la maladie. Les échecs de nombreux essais thérapeutiques peuvent en partie s’expliquer par l’hétérogénéité de la maladie au plan moléculaire, qui n’est pas prise en compte dans les classifications cliniques. L’établissement d’une taxonomie moléculaire du syndrome de Gougerot-Sjögren pourrait donc permettre d’identifier des marqueurs prédictifs de complications de la maladie ou de la réponse au traitement, et déboucher sur une approche thérapeutique personnalisée. Cela a été l’objectif d’un travail collaboratif réalisé par les équipes de recherche de l’Unité 1227 de l’Inserm et de l’Institut de recherches internationales Servier [ 3 ]. Dans le prolongement de notre contribution au projet PRECISESADS IMI JU [ 4 ], nous avons exploité la base de données collectées à partir de la cohorte de patients atteints du syndrome de Gougerot-Sjögren et nous avons déterminé un profil moléculaire intégré à partir des données disponibles, pour 304 patients et 330 volontaires sains appariés pour l’âge et le sexe. Le diagnostic de la maladie a été confirmé par la présence d’autoanticorps anti-SSA/Ro 1, ou d’une sialadénite (inflammation d’une glande salivaire) lymphocytaire focale attestée par un focus score > 1 2 . Pour chaque patient, nous disposions de données multi-omiques (génétiques, épigénomiques, transcriptomiques) complétées par des analyses immuno-phénotypiques par cytométrie en flux et d’expression de cytokines, que nous avons exploitées en lien avec les données cliniques et sérologiques habituellement collectées chez ces patients.
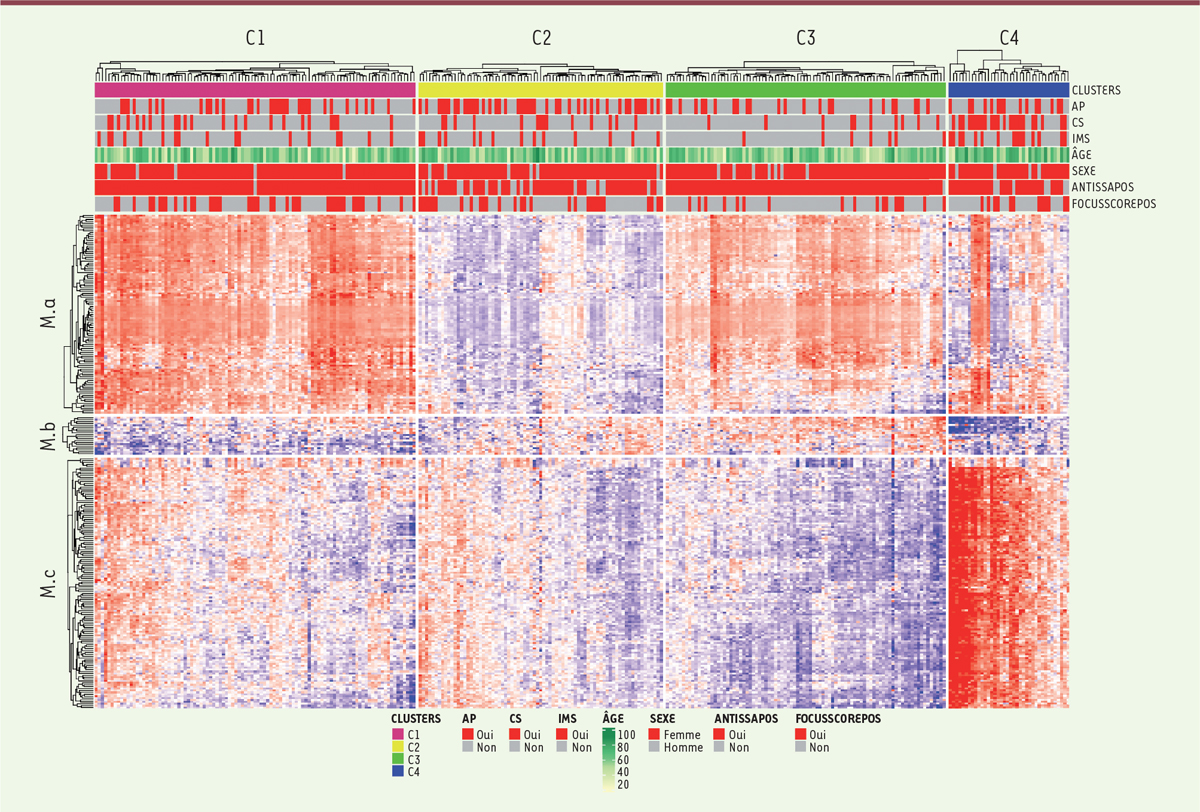
Les données transcriptomiques ont été examinées en utilisant une méthode appliquée précédemment au cancer du sein [ 5 ], et qui fait alterner des étapes supervisées et non supervisées. Par ailleurs, nous avons réparti les échantillons en deux groupes, à des fins respectivement d’identification (75 % des patients) et de validation (25 % restants). Trois méthodes différentes de regroupement ont été testées pour établir une stratification des patients en quatre groupes. Une signature de 257 gènes, identifiée au cours de l’étape supervisée, permet de séparer les 304 patients atteints du syndrome de Gougerot-Sjögren en quatre groupes ( Figure 1 ). Cette signature peut être décomposée en trois modules : M.a (105 gènes), M.b (20 gènes) et M.c (132 gènes).
| Figure 1.
Distribution des profils transcriptomiques des patients présentant un syndrome de Gougerot-Sjögren en quatre groupes.
Carte « de chaleur » (
heatmap
) montrant la distribution des profils d’expression des transcrits dans les quatre groupes de patients. Les groupes de patients (
clusters
C1, C2, C3, C4) sont disposés en colonnes, et les trois modules fonctionnels de gènes (M.a, M.b, M.c) en lignes. Chaque groupe de patients est représenté séparément. La surexpression d’un gène est indiquée en rouge, et son expression réduite en bleu. En haut de la figure sont indiqués les traitements reçus pour chaque patient (AP : antipaludéens ; CS : corticostéroïdes ; IMS : immunosuppresseurs), son âge et son sexe. ANTISSAPOS : présence d’autoanticorps anti-SSA/Ro
; FOCUSSCOREPOS :
focus score
> 1.
|
Les gènes différemment exprimés entre les groupes de patients et de volontaires sains ont été ensuite analysés à l’aide du programme Ingenuity pathway analysis . Cette analyse d’enrichissement a été complétée à l’aide d’un répertoire de 382 modules transcriptomiques établi dans le sang [ 6 ]. Les quatre groupes de patients se distinguent par leurs profils moléculaires immunologiques. Trois des quatre groupes ( clusters C1, C3 et C4) présentent une hyper-expression notable des gènes de la voie des interférons. En revanche, ils se différencient par leur enrichissement en transcrits des gènes associés à la présence des différents types d’interférons (de type I ou de type II). Le groupe C1 se distingue par la plus forte signature interféron (signature mixte d’interférons de type I et II), tandis que la signature interféron du groupe C3 est moindre, avec une prédominance des transcrits des gènes exprimés en présence des interférons de type I. Celle du groupe C4 est plus orientée vers les transcrits de gènes exprimés lors d’une stimulation par l’interféron de type II. L’enrichissement en transcrits de gènes impliqués dans la signature interféron de type II est cependant comparable entre les groupes C3 et C4. Le profil transcriptomique du groupe C2 est proche de celui des volontaires sains, avec toutefois une surexpression significative de gènes impliqués dans la signature interféron de type I et II, notamment chez les patients possédant des autoanticorps anti-SSA.
Les anomalies transcriptomiques constatées pour le groupe C1 concernent principalement la voie de l’interféron, le rôle antiviral et antibactérien des récepteurs PRR ( pattern recognition receptor ) et l’activation du facteur régulateur de l’interféron ( interferon regulatory factor , IRF). Le groupe C3 se caractérise par une augmentation significative de l’activité de voies canoniques de signalisation liées à l’activation des lymphocytes B, notamment à la transduction du signal déclenché par l’activation de leur récepteur de l’antigène et à leur prolifération. Le groupe C4 est le groupe qui présente le plus grand nombre de gènes exprimés de manière différentielle, reflétant notamment l’activation des lymphocytes B et T (Th1 et Th2), ainsi qu’une signature inflammatoire fortement associée aux cytokines comprenant les interleukines IL(interleukine)-6, IL-10 et IL-15, et à la voie de signalisation impliquant le facteur de transcription STAT3 ( signal transducer and activator of transcription 3 ).
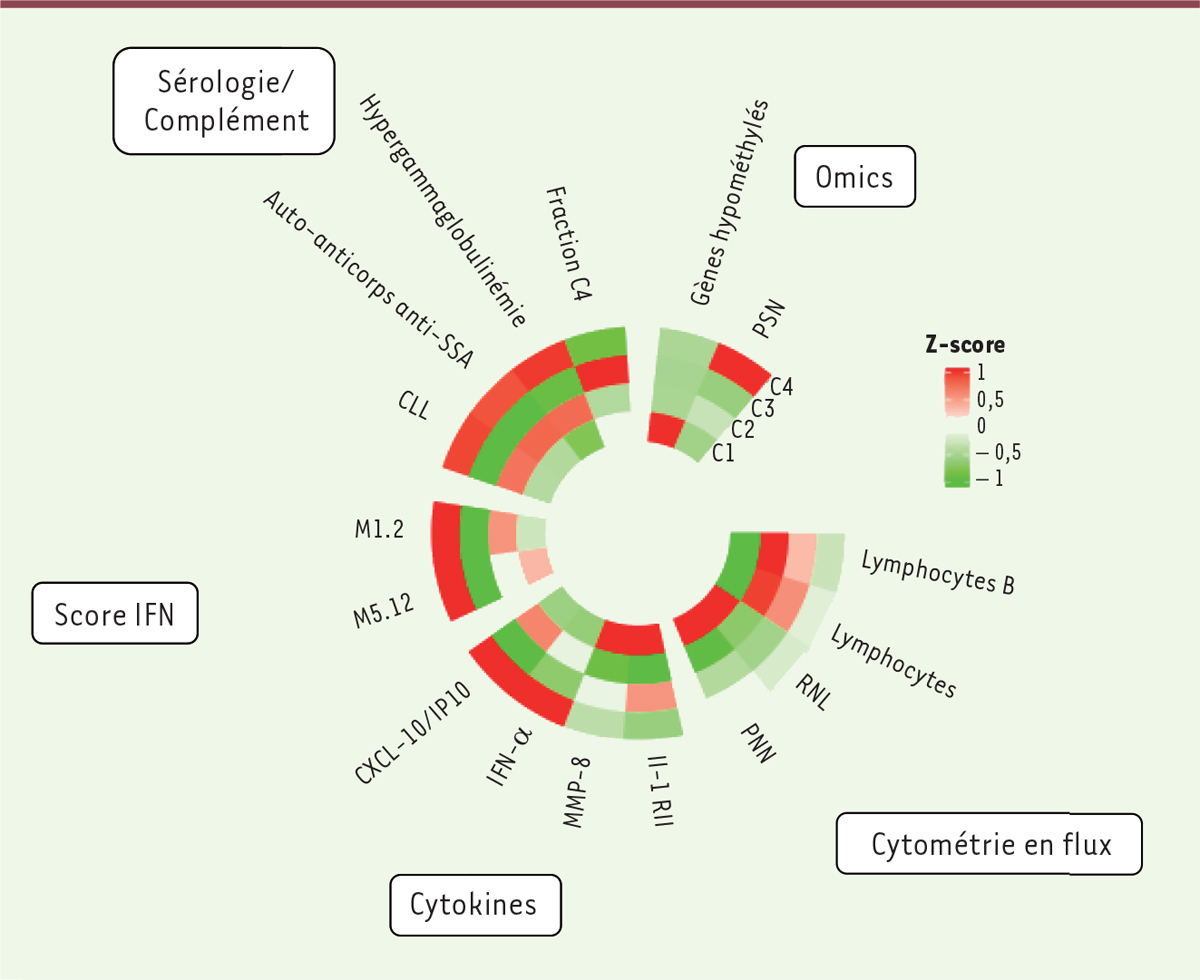
Les données omiques et cliniques disponibles ont permis de compléter la caractérisation de chacun de ces quatre groupes de patients. Leurs caractéristiques principales sont résumées dans la Figure 2 .
| Figure 2.
Combinaison des paramètres biologiques permettant la caractérisation des patients par endotypes.
Distribution des paramètres biologiques à partir des Z-score (
 où
x
représente la mesure du paramètre biologique,
mean
(
x
) sa valeur moyenne, et
sd
(
x
) l’écart-type). Une présence importante du paramètre est indiquée en rouge, et sa sous-représentation en vert. Lymphocytes B : rapport du nombre de lymphocytes B sur celui des leucocytes ; Lymphocytes : rapport du nombre de lymphocytes totaux sur celui des leucocytes ; RNL : rapport du nombre de granulocytes neutrophiles sur celui des lymphocytes ; PNN : rapport du nombre de polynucléaires neutrophiles sur celui des leucocytes ; IL-1 RII : concentration du récepteur de l’interleukine 1 de type II ; MMP-8 : concentration de la métalloprotéinase matricielle-8 ; IFN-α : concentration de l’interféron de type I alpha ; CXCL-10/IP-10 : concentration du ligand 10 de la chimiokine à motif C-X-C ; M1.2 : niveau d’expression du module de gènes inductibles par l’interféron [
11
] ; M5.12 : niveau d’expression d’un module de gènes inductibles par l’interféron [
11
] ; CLL : concentration de chaînes légères d’immunoglobulines libres
; Auto-anticorps anti-SSA : concentration d’autoanticorps anti-SSA/Ro ; Fraction C4 : concentration de la fraction C4 du complément ; PSN : abondance des polymorphismes d’un seul nucléotide.
où
x
représente la mesure du paramètre biologique,
mean
(
x
) sa valeur moyenne, et
sd
(
x
) l’écart-type). Une présence importante du paramètre est indiquée en rouge, et sa sous-représentation en vert. Lymphocytes B : rapport du nombre de lymphocytes B sur celui des leucocytes ; Lymphocytes : rapport du nombre de lymphocytes totaux sur celui des leucocytes ; RNL : rapport du nombre de granulocytes neutrophiles sur celui des lymphocytes ; PNN : rapport du nombre de polynucléaires neutrophiles sur celui des leucocytes ; IL-1 RII : concentration du récepteur de l’interleukine 1 de type II ; MMP-8 : concentration de la métalloprotéinase matricielle-8 ; IFN-α : concentration de l’interféron de type I alpha ; CXCL-10/IP-10 : concentration du ligand 10 de la chimiokine à motif C-X-C ; M1.2 : niveau d’expression du module de gènes inductibles par l’interféron [
11
] ; M5.12 : niveau d’expression d’un module de gènes inductibles par l’interféron [
11
] ; CLL : concentration de chaînes légères d’immunoglobulines libres
; Auto-anticorps anti-SSA : concentration d’autoanticorps anti-SSA/Ro ; Fraction C4 : concentration de la fraction C4 du complément ; PSN : abondance des polymorphismes d’un seul nucléotide.
|
Le groupe C2 présente un profil transcriptomique très similaire à celui des volontaires sains, et les patients de ce groupe ont des signes cliniques de fatigue, sécheresse ou douleur comparables à ceux des patients des autres groupes [ 7 ]. Ce groupe est également enrichi en patients présentant des manifestations glandulaires attestées par un focus score > 1 et l’absence d’autoanticorps anti-SSA.
Les groupes C1 et C3 se distinguent par une hypergammaglobulinémie, la présence d’autoanticorps anti-nucléaires, anti-SSA52/anti-SSA60, et un titre élevé de chaînes libres circulantes d’immunoglobulines, sans caractéristique clinique particulière. L’analyse des données du méthylome 3 confirme la forte signature interféron observée dans ces deux groupes [ 8 ]. Par ailleurs, les concentrations de CXCL10/IP-10 ( interferon γ -induced protein ), CCL8/MCP-2 ( chemokine [C-C motif] ligand/monocyte chemo attractant protein 2 ) et TNF-α ( tumor necrosis factor α) sont élevées dans les groupes C1 et C3, en accord avec leur forte signature interféron. Le groupe C1 est également caractérisé par l’enrichissement en CXCL13/BLC ( chemokine [C-X-C motif] ligand 13/B lymphocyte chemo attractant ), IL-6 et IL-1RA (antagoniste du récepteur de l’IL-1). Les taux sériques de l’interféron α (dosé avec le test SIMOA [ single-molecule array ]) sont positivement corrélés avec la signature interféron de type I, notamment pour le groupe C1 et, à un moindre degré, pour le groupe C3. Les taux sériques de l’interféron α ne sont pas corrélés au score total ESSDAI ( EULAR Sjögren’s syndrome disease activity index ) d’activité de la maladie, mais il existe une association entre les taux élevés de cet interféron et les domaines biologiques et hématologiques de ce score. Des SNP ( single nucleotide polymorphisms ) associés aux gènes du complexe majeur d’histocompatibilité de classe II sont surtout observés chez les patients du groupe C1, et sont corrélés avec l’intensité de la signature interféron et le titre élevé d’autoanticorps [ 9 ]. Enfin une augmentation du nombre des lymphocytes B dans le sang est retrouvée dans le groupe C3, en lien avec la stimulation des voies canoniques d’activation de ces lymphocytes dans ce groupe.
Le groupe C4 présente une tendance à un phénotype clinique plus sévère. Ce groupe se caractérise par une forte signature inflammatoire transcriptomique, avec une activation des cytokines pro-inflammatoires. L’analyse des données du méthylome révèle un profil aberrant, avec plus de 3 600 gènes différemment méthylés et principalement associés à la voie de dégranulation des granulocytes. Les patients appartenant à ce groupe ont une lymphopénie massive et des taux élevés de granulocytes [ 10 ].
Un modèle composite de prédiction des patients présentant un syndrome de Gougerot-Sjögren pour chacun des quatre groupes identifiés a été construit en deux étapes à l’aide d’outils de machine learning , avec une précision globale de 95 % (99 % pour la première étape et 96 % pour la seconde). Les patients sont évalués pour leur appartenance au groupe C4 en fonction de l’expression de 10 gènes, puis l’évaluation de l’expression de 31 gènes permet leur allocation aux groupes C1, C2 ou C3. Une fonction d’interpolation fondée sur six gènes d’expression constante permet l’utilisation de cet algorithme 4 dans différentes bases de données transcriptomiques.
Ainsi, cette étude a permis de caractériser et de stratifier les patients atteints du syndrome de Gougerot-Sjögren d’après leur profil moléculaire détaillé obtenu à partir de l’analyse d’un échantillon de sang. Ses résultats apportent des clés pour une stratégie thérapeutique personnalisée fondée sur des combinaisons médicamenteuses ciblant des mécanismes physiopathologiques complémentaires. Ces travaux confirment la nécessité d’approfondir notre compréhension physiopathologique du syndrome de Gougerot-Sjögren, notamment celle de la relation entre ces anomalies moléculaires, l’activité de la maladie et l’effet de différents traitements sur son évolution. De même, l’étude des liens entre ces profils endotypiques systémiques et l’expression tissulaire ou les caractéristiques de l’infiltrat des glandes salivaires devra être approfondie. Ces questions sont en cours d’investigation dans le cadre d’un projet européen 5 .