| |
| Med Sci (Paris). 38(2): 141–144. doi: 10.1051/medsci/2021256.Les phtalates Un facteur de risque pour la fonction cérébro-vasculaire chez la souris mâle Delnia Ahmadpour,1 Sakina Mhaouty-Kodja,1 and Valérie Grange-Messent1* 1CNRS UMR 8246, Inserm U1130, Institut de biologie Paris-Seine, Sorbonne Université
,
7 quai Saint-Bernard
,
75005Paris
,
France MeSH keywords: Animaux, Exposition environnementale, Polluants environnementaux, Humains, Mâle, Souris, Acides phtaliques, Appréciation des risques, Facteurs de risque |
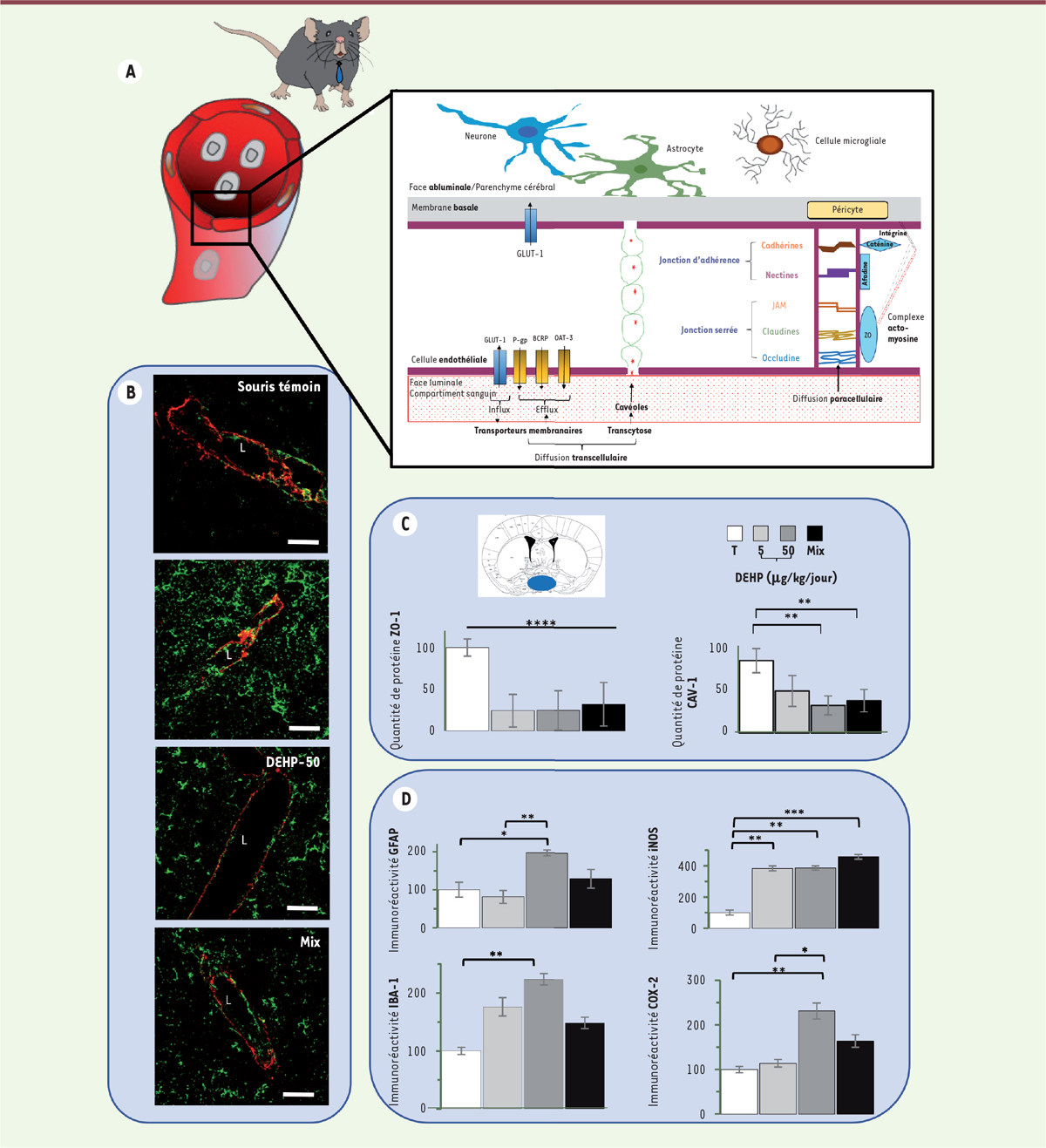
La barrière hémato-encéphalique : une interface contrôlant les échanges entre le sang et le tissu cérébral Le cerveau est protégé de la toxicité des xénobiotiques circulants et des agents pathogènes par une interface spécifique avec le sang des capillaires cérébraux : la barrière hémato-encéphalique. Celle-ci assure également l’homéostasie essentielle à l’activité neuronale.
La barrière hémato-encéphalique joue un rôle de filtre sélectif qui contrôle la communication entre, d’une part, les systèmes circulatoire et immunitaire, et, d’autre part, le parenchyme cérébral. Elle est constituée de cellules endothéliales reliées entre elles par des jonctions serrées et des jonctions adhérentes limitant la diffusion paracellulaire des molécules. Les échanges entre le compartiment sanguin et le parenchyme cérébral sont contrôlés par les transporteurs et les vésicules d’endocytose issues de cavéoles des cellules endothéliales, qui limitent également le passage transcellulaire des molécules. Les cellules endothéliales sont entourées par une membrane basale englobant des péricytes. Elles interagissent, par l’intermédiaire de cette membrane basale avec des cellules gliales (astrocytes et cellules microgliales) et des neurones (
Figure 1A
) [
1
]. Un dysfonctionnement de la barrière hémato-encéphalique est associé à certaines maladies neurodégénératives. Celui-ci peut également compliquer la récupération à la suite d’un accident vasculaire cérébral [
1
].
 | Figure 1.
Effets de l’exposition de souris mâles adultes aux phtalates sur l’unité neuro-vasculaire. (A)
Les principaux éléments cellulaires constituant la barrière hémato-encéphalique entre le compartiment sanguin et le parenchyme cérébral sont : la couche continue des cellules endothéliales des capillaires (non fenestrés), la membrane basale, les péricytes, des cellules microgliales, des neurones et des extrémités des astrocytes [
2
]. BCRP : protéine de résistance au cancer du sein ; GLUT-1 : transporteur de glucose 1 ; JAM : molécules des jonctions d’adhérence ; OAT-3 : transporteur d’anions organiques 3 ; P-gp : P-glycoprotéine ; ZO : protéines des jonctions serrées (
zonula occludens
).
(B)
Images illustrant la fuite des immunoglobulines circulantes endogènes (vert) vers le parenchyme de l’aire préoptique médiane de l’hypothalamus des souris mâles adultes après l’exposition orale au DEHP seul aux doses quotidiennes de 5 µg/kg (DEHP-5) ou 50 µg/kg (DEHP-50), ou à un mélange de phtalates (Mix). La paroi des capillaires est visualisée par la présence de laminine (rouge), un composant de la membrane basale péri-endothéliale. Barre d’échelle : 10 µm.
(C)
Analyses quantitatives de l’effet de l’exposition orale au DEHP seul aux doses quotidiennes de 5 µg/kg (DEHP-5) ou 50 µg/kg (DEHP-50), ou à un mélange de phtalates (Mix) sur la protéine ZO-1 des jonctions serrées et la protéine Cav-1 des cavéoles dans les capillaires de l’hypothalamus. Ces protéines limitent le passage, respectivement paracellulaire et transcellulaire, de molécules entre le sang et le cerveau. Le groupe témoin (T) rassemble les animaux ayant reçu une alimentation non contaminée par les phtalates. Les différences statistiquement significatives entre les groupes sont indiquées par * (p < 0,05), ** (p < 0,01), *** (p < 0,001), ou **** (p < 0,0001).
|
|
Les capillaires cérébraux sous contrôle des hormones stéroïdes sexuelles
Le rôle des hormones stéroïdes sexuelles ne se limite pas aux fonctions neuroendocrines et aux comportements liés à la reproduction : elles agissent également sur les vaisseaux cérébraux, qui font partie de leurs tissus cibles. Il existe d’ailleurs une différence de sensibilité vasculaire aux stéroïdes sexuels dépendante du genre, en relation avec l’évolution de la concentration plasmatique des œstrogènes et de la testostérone au cours de la vie. Ces hormones peuvent modifier le tonus vasculaire, le fonctionnement des cellules endothéliales, la réponse au stress oxydant et la réponse inflammatoire [
2
]. La testostérone peut agir soit directement,
via
les récepteurs des androgènes, soit indirectement, par activation des récepteurs des œstrogènes. Nous avons précédemment montré un rôle réversible de la testostérone sur le fonctionnement de la barrière hémato-encéphalique et sur la neuroinflammation chez la souris mâle adulte, dans l’aire préoptique médiane de l’hypothalamus, impliquée dans le comportement sexuel. Une déplétion chronique en testostérone circulante induit une augmentation de la perméabilité de la barrière hémato-encéphalique avec une altération des jonctions serrées entre les cellules endothéliales, qui s’accompagne d’une activation des cellules gliales (astrocytes et microglie), d’une augmentation de la production de molécules impliquées dans la réaction inflammatoire, et d’une dégénérescence cellulaire [
3
].
|
Perturbation endocrinienne par les phtalates
Les phtalates sont des composés chimiques entrant dans la composition de produits en matière plastique. Ce sont des perturbateurs endocriniens, c’est à dire des substances capables d’altérer le fonctionnement des systèmes endocriniens d’organismes vivants ou de leur progéniture [
4
], comme l’a montré leur capacité à diminuer la production de testostérone fœtale [
5
]. En raison de leur importante utilisation, les phtalates, en particulier le di(2-éthylhexyl) phtalate (DEHP), sont très présents dans notre environnement [
6
], et leurs effets nocifs représentent un véritable enjeu de santé publique. Jusqu’à présent, la majorité des études
in vivo
portant sur les effets de l’exposition aux phtalates sur le système nerveux se sont concentrées sur leurs effets lors d’une exposition périnatale, ou lors d’une exposition plus tardive, mais à des doses élevées. En revanche, les effets d’une exposition à de faibles doses de phtalates à l’âge adulte ont été peu étudiés.
Nous avons récemment montré que l’exposition par voie orale, à l’âge adulte, à de faibles doses de DEHP, perturbe le comportement sexuel des souris mâles [
7
]. Cette altération comportementale n’est pas due à des modifications des taux de testostérone circulante, mais est associée à une diminution de l’expression du récepteur des androgènes dans l’aire préoptique médiane [
7
]. Cette diminution induite par l’exposition à de faibles doses de DEHP, sans affecter le nombre de récepteurs des œstrogènes α (ERα), s’accompagnent d’une activation des astrocytes [
7
]. Nos résultats préliminaires ont montré également une diminution de l’expression du récepteur des androgènes dans une autre région cérébrale sensible à ces hormones : l’hippocampe, où ce récepteur joue un rôle important dans la modulation des processus cognitifs.
Dans ce contexte, cette nouvelle étude avait pour objectif de documenter l’impact de l’exposition de souris mâles adultes à de faibles doses de DEHP, seul ou dans un mélange contenant également d’autres phtalates présents dans l’environnement, sur l’intégrité de la barrière hémato-encéphalique et du parenchyme cérébral environnant. |
Effets de l’exposition, à l’âge adulte, à de faibles doses de DEHP, seul ou dans un mélange de phtalates, sur la perméabilité de l’endothélium des capillaires cérébraux chez la souris mâle
Nous avons exposé des souris mâles C57BL/6J adultes à une nourriture contaminée par les phtalates [
8
]. Ces souris ont été alimentées avec de la nourriture sans phtalates (groupe témoin), ou contenant le DEHP seul, à la dose journalière de 50 µg/kg de poids corporel, correspondant à la dose journalière tolérable (DJT)
1
, ou à la dose de 5 µg/kg/jour, une valeur située dans la gamme de l’exposition environnementale [
9
,
10
]. Les souris d’un quatrième groupe ont été exposées à un mélange de phtalates pertinent pour l’exposition environnementale et incluant le DEHP : DEHP (5 µg/kg/jour), DBP (0,5 µg/kg/jour), BBP (0,5 µg/kg/jour), DiBP (0,5 µg/kg/jour), et DEP (0,25 µg/kg/jour)
2
[
11
] (
→
).
(→) Voir la Nouvelle de N. Adam et S. Mhaouty-Kodja,
m/s
n° 11, novembre 2021, page 973
Après six semaines de traitement, les cerveaux de ces animaux ont été prélevés. Des analyses ont été réalisées dans les deux régions cérébrales sensibles aux androgènes précédemment citées : l’hypothalamus et l’hippocampe. Nos résultats ont montré un effet du DEHP, seul ou mélangé avec d’autres phtalates, sur la perméabilité de la barrière hémato-encéphalique, effet qui s’est traduit par une fuite du compartiment sanguin vers le parenchyme cérébral d’un traceur exogène (colorant Bleu Evans), et des immunoglobulines G (IgG) endogènes circulantes dans l’aire préoptique médiane de l’hypothalamus (
Figure 1B
) et les régions CA1 et CA3 de l’hippocampe [
8
]. Ce défaut d’imperméabilité de la barrière hémato-encéphalique pourrait résulter d’une altération de la diffusion paracellulaire ou transcellulaire des solutés. En revanche, aucune fuite n’a été détectée dans le territoire du gyrus denté de l’hippocampe, quelle que soit la dose d’exposition.
Nous avons montré que l’augmentation de la perméabilité de la barrière hémato-encéphalique de l’hypothalamus induite par l’exposition au DEHP seul à la dose journalière de 5 ou 50 μg/kg, ou au DEHP à la dose journalière de 5 μg/kg dans un mélange de phtalates, était associée à une forte diminution de la quantité de la protéine jonctionnelle
zonula occludens 1
(ZO-1) associée aux jonctions serrées, et pour l’exposition au DEHP seul à la dose journalière de 50 µg/kg ou au DEHP à la dose journalière de 5 µg/kg dans le mélange de phtalates, à une diminution significative de la quantité de la cavéoline-1 (Cav-1) (
Figure 1C
). Cette augmentation de la perméabilité de la barrière hémato-encéphalique de l’hypothalamus s’est parfois accompagnée d’une réaction gliale, marquée par une activation des astrocytes et de la microglie, et par une augmentation des quantités de molécules impliquées dans la réaction inflammatoire, comme l’isoforme inductible de l’oxyde nitrique synthase (iNOS) et comme la cyclo-oxygénase de type 2 (COX-2) (
Figure 1D
).
Dans l’hippocampe, la perméabilité accrue de la barrière hémato-encéphalique consécutive à une exposition au DEHP à la dose journalière de 50 µg/kg était associée à une augmentation de la quantité de ZO-1 et à une diminution de celle de Cav-1 dans les régions CA1 et CA3. Aucune activation astrocytaire n’a été détectée. En revanche, nous avons observé une activation microgliale dans les régions CA1 et CA3 à la suite d’une exposition au DEHP seul ou dans un mélange de phtalates, alors qu’aucun changement du marquage par un anticorps spécifique de la protéine COX-2 dans cette région n’a été constaté [
8
].
Ainsi, l’exposition des souris mâles adultes à de faibles doses de phtalates, proches de celles de l’exposition environnementale, provoque un dysfonctionnement de la barrière hémato-encéphalique dans l’hypothalamus et dans l’hippocampe, souvent associé à une réaction neuroinflammatoire, avec, cependant, des différences de sensibilité à l’exposition entre ces deux régions du cerveau, en particulier pour l’activation des astrocytes [
8
]. Cette étude révèle que l’exposition aux phtalates, des perturbateurs endocriniens à action anti-androgénique, a des effets indésirables sur les capillaires cérébraux dans des régions cérébrales sensibles aux androgènes (
Figure 2
). L’exposition aux perturbateurs endocriniens peut donc désormais être considérée comme un facteur de risque environnemental pour la fonction cérébro-vasculaire. En outre, nous montrons que ces effets indésirables de l’exposition au di(2-éthylhexyl)phtalate (DEHP) se produisent pour de faibles doses, équivalentes ou inférieures à la DJT (50 µg/kg/jour) actuellement établie par l’EFSA (
European Food Safety Authority
) [
5
], ce qui conduit à s’interroger sur la pertinence des méthodes classiquement utilisées pour déterminer la dose de phtalates pouvant être ingérée quotidiennement sans danger pour l’homme.
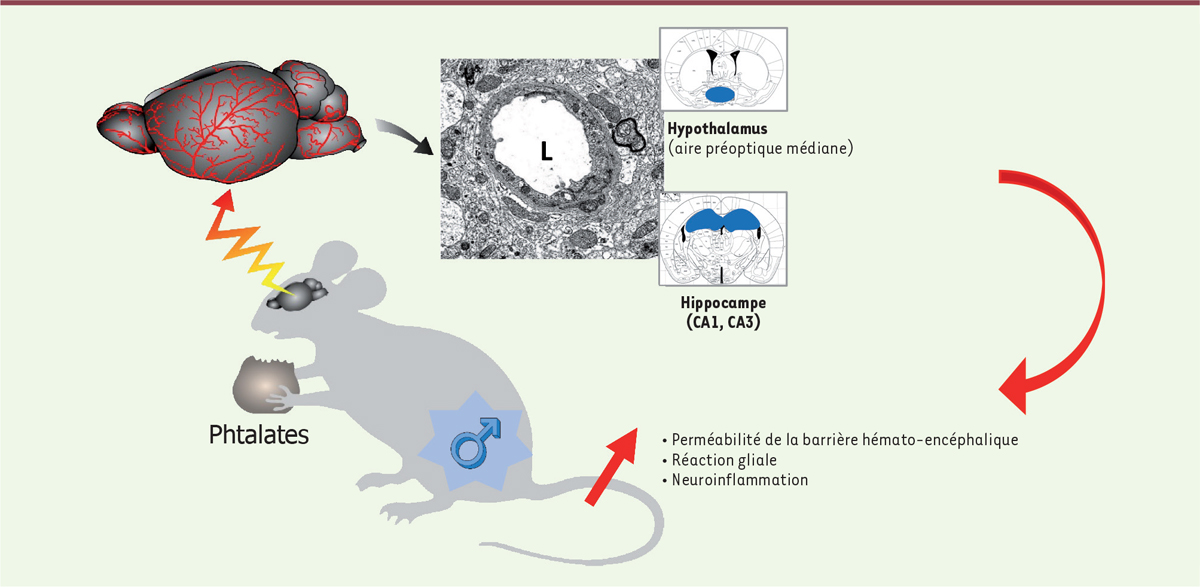
 | Figure 2.
L’exposition orale de souris mâles adultes à de faibles doses de phtalates a un impact sur les capillaires cérébraux dans des zones cérébrales sensibles aux androgènes, telles que l’hypothalamus et l’hippocampe.
L’altération de la barrière hémato-encéphalique s’accompagne d’une activation gliale et d’une réaction inflammatoire. L : lumière d’un capillaire cérébral chez la souris adulte, observé en microscopie électronique à transmission.
|
|
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Abbott
NJ
,
Patabendige
AAK
,
Dolman
DEM
,
et al.
Structure and function of the blood-brain barrier.
.
Neurobiol Dis.
2010;
;
37
:
:13.
–
25
.
2.
Ahmadpour
D
,
Grange-Messent
V
.
Involvement of testosterone signaling in the integrity of the neurovascular unit in the male: review of evidence, contradictions and hypothesis.
.
Neuroendocrinol.
2021;
;
111
:
:403.
–
20
.
3.
Atallah
A
,
Mhaouty-Kodja
S
,
Grange-Messent
V
.
Chronic depletion of gonadal testosterone leads to blood-brain barrier dysfunction and inflammation in male mice.
.
J Cereb Blood Flow Metab.
2017;
;
37
:
:3161.
–
3175
.
5.
EFSA panel on food contact materials, enzymes and processing aids (CEP).
,
Silano
V
,
Barat Baviera
JM
,
et al.
Update of the risk assessment of di-butylphthalate (DBP), butyl-benzylphthalate (BBP), bis(2-ethylhexyl) phthalate (DEHP), di-isononylphthalate (DINP) and di-isodecylphthalate (DIDP) for use in food contact materials.
.
EFSA J Eur Food Saf Auth.
2019;
;
17
:
:e05838.
.
6.
Gao
DW
,
Wen
ZD
.
Phthalate esters in the environment: a critical review of their occurrence, biodegradation, and removal during wastewater treatment processes.
.
Sci Total Environ.
2016;
;
541
:
:986.
–
1001
.
7.
Dombret
C
,
Capela
D
,
Poissenot
K
,
et al.
Neural mechanisms underlying the disruption of male courtship behavior by adult exposure to di(2-ethylhexyl) phthalate in mice.
.
Environ Health Perspect.
2017;
;
125
:
:097001.
.
8.
Ahmadpour
D
,
Mhaouty-Kodja
S
,
Grange-Messent
V
.
Disruption of the blood-brain barrier and its close environment following adult exposure to low doses of di(2-ethylhexyl) phthalate alone or in an environmental phthalate mixture in male mice.
.
Chemosphere.
2021;
;
282
:
:131013.
.
9.
Martine
B
,
Marie-Jeanne
T
,
Cendrine
D
,
et al.
Assessment of adult human exposure to phthalate esters in the urban centre of Paris (France).
.
Bull Environ Contam Toxicol.
2013;
;
90
:
:91.
–
96
.
10.
Dewalque
L
,
Charlier
C
,
Pirard
C
.
Estimated daily intake and cumulative risk assessment of phthalate diesters in a Belgian general population.
.
Toxicol Lett.
2014;
;
231
:
:161.
–
168
.
11.
Adam
N
,
Mhaouty-Kodja
S
.
Perturbation sexuelle par les phtalates : les souris femelles sont plus vulnérables que les souris mâles.
.
Med Sci (Paris).
2021;
;
37
:
:973.
–
6
.
|