| |
| Med Sci (Paris). 38(2): 133–135. doi: 10.1051/medsci/2021253.Rôle des macrophages dans le développement de l’arthrite juvénile LACC1 fait-il le lien ? Anne-Laure Mathieu,1,2 Ommar Omarjee,1 Thierry Walzer,1,2 and Alexandre Belot1,2* 1Centre international de recherche en infectiologie, U1111, CNRS UMR 5308, ENS, UCBL
,
21 avenue Tony Garnier
,
69007Lyon
,
France 2Centre de référence des rhumatismes et maladies autoimmunes systémiques de l’enfant (RAISE), Hôpital Femme Mère Enfant, Hospices civils de Lyon
,
54 boulevard Pinel
,
69500
,
Bron
,
France MeSH keywords: Arthrite juvénile, Humains, Protéines et peptides de signalisation intracellulaire, Macrophages, complications |
L’arthrite juvénile idiopathique est une maladie inflammatoire hétérogène de l’enfant caractérisée, notamment, par une atteinte articulaire. C’est le rhumatisme chronique infantile le plus fréquent, et ses causes sont encore mal connues. Sa prévalence est de 16 à 150 pour 100 000 enfants en Europe et en Amérique du Nord. En France, on estime à environ 5 000 le nombre d’enfants qui en sont atteints
1
. L’étude des rares cas familiaux de cette maladie représente une opportunité pour l’identification de nouveaux gènes impliqués, ce qui devrait permettre de progresser dans la physiopathologie et d’envisager des traitements plus ciblés.
|
LACC1 : un gène impliqué dans le développement de l’arthrite juvénile
Nous avons étudié quatre familles dans lesquelles plusieurs enfants ont développé une arthrite juvénile précoce (avant l’âge de cinq ans) et sévère. Par une technique de séquençage de l’ADN à haut débit, nous avons pu identifier des mutations bialléliques du gène codant la protéine LACC1 (
laccase domain-containing 1
) chez tous les enfants atteints [
1
]. Ces mutations conduisent toutes à une perte d’expression de la protéine. La fonction de LACC1, qui ne possède pas d’homologie de séquence peptidique avec d’autres protéines de mammifères, est encore assez mal connue. Dans des modèles murins, une perte d’expression de
Lacc1
est associée à une augmentation de l’inflammation. La protéine est également impliquée dans le contrôle des infections bactériennes de l’intestin [
2
,
3
]. Des travaux de recherche ont par ailleurs révélé qu’elle jouait un rôle dans la transmission du signal en aval de récepteurs impliqués dans l’immunité innée [
4
].
Nous avons montré que LACC1 est exprimée exclusivement dans les macrophages différenciés à partir de monocytes sanguins [
1
]. Cependant, nous n’avons pas pu mettre en évidence un rôle de la protéine dans l’activation de l’une des trois voies de signalisation classiquement impliquées dans le développement des maladies inflammatoires monogéniques : la voie de l’interféron de type I (IFN-I), la voie impliquant le facteur de transcription NFκB (
nuclear factor kappa-light-chain-enhancer of activated B cells
), et la voie de l’inflammasome [
5
].
|
Identification de partenaires de LACC1 impliqués dans l’autophagie
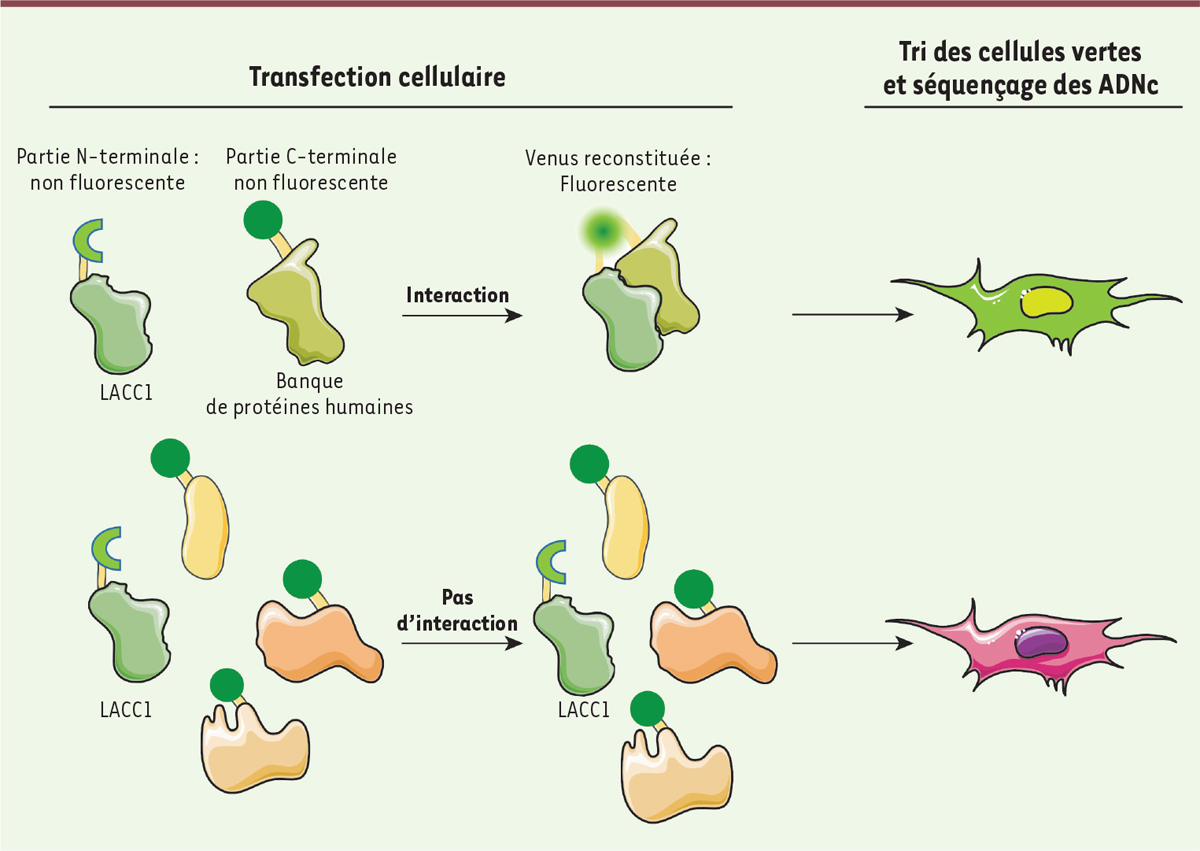
Nous avons donc adopté une approche non biaisée en réalisant un crible de complémentation de fluorescence afin d’identifier des partenaires de liaison de LACC1. Le principe de ce crible est de fusionner la protéine d’intérêt avec la moitié d’une protéine fluorescente (appelée Venus), et de fusionner les ADN complémentaires (ADNc) d’une banque d’ADNc humains à une séquence codant l’autre moitié de la protéine Venus [
6
]. Ces deux constructions sont ensuite co-exprimées dans des cellules de mammifère. Dans les cellules où LACC1 interagit avec la protéine synthétisée à partir de l’ADNc qu’elles ont incorporé, la protéine Venus est reconstituée et devient fonctionnelle. Elle émet alors un signal fluorescent permettant de trier les cellules d’intérêt, et ainsi d’identifier les partenaires de liaison de LACC1 par séquençage de l’ADNc qu’elles contiennent (
Figure 1
).
 | Figure 1.
Principe du crible par complémentation de fluorescence.
Les cellules sont co-transfectées avec un ADNc codant LACC1 et une banque d’ADNc humains, chacune de ces deux constructions étant fusionnée avec l’un ou l’autre fragment de la séquence codant la protéine fluorescente Venus. Dans le cas d’une interaction protéique entre LACC1 et son partenaire de liaison, les deux fragments de la protéine Venus s’assemblent, la rendant fluorescente, et les cellules fluorescentes peuvent être sélectionnées par tri cellulaire. L’ADNc codant le partenaire de liaison de LACC1 est ensuite séquencé afin d’identifier la protéine qu’il code.
|
Cette approche nous a permis d’identifier une trentaine de partenaires de liaison potentiels de LACC1, dont RACK1 (
receptor of activated protein C kinase 1
) et AMPK (
AMP-activated protein kinase
), tous deux impliqués dans le contrôle de l’autophagie [
7
,
8
]. L’interaction de ces deux protéines avec LACC1 a été confirmée par co-immunoprécipitation [
1
].
|
LACC1 induit le flux autophagique dans les macrophages
L’autophagie est un processus cellulaire de dégradation et de recyclage du contenu cytoplasmique et des membranes par les lysosomes. Elle joue un rôle essentiel dans la détoxification et le métabolisme cellulaire, et son altération peut contribuer à de nombreuses maladies [
9
]. Nous avons donc étudié l’autophagie dans des macrophages exprimant ou pas la protéine LACC1, et avons observé que la formation de vésicules d’autophagie (les autophagosomes) était très diminuée en absence de LACC1. Ce phénotype était comparable à celui que l’on observe en absence de ATG5 (
autophagy-related 5
), une protéine essentielle à la formation des autophagosomes, ce qui renforçait l’hypothèse d’un rôle de LACC1 dans le contrôle du flux autophagique. Au contraire, une surexpression de LACC1 dans des cellules HeLa
2,
conduit à une augmentation du nombre d’autophagosomes, donc du flux autophagique [
1
].
La culture des macrophages dans un milieu pauvre en nutriments induit l’autophagie, qui dépend de la phosphorylation de la protéine AMPK. Cette phosphorylation est identique en présence ou en l’absence de LACC1, suggérant que LACC1 intervient en aval de AMPK dans la voie de l’autophagie.
Enfin, comme l’autophagie intervient également dans l’élimination des corps apoptotiques et des microorganismes pathogènes [
10
], nous avons mesuré la phagocytose de corps apoptotiques ou de bactéries par des macrophages exprimant ou pas LACC1, et nous avons observé qu’elle était réduite en absence de LACC1 [
1
].
|
Rôle de LACC1 dans le métabolisme lipidique et la respiration mitochondriale
L’autophagie dépendante d’AMPK est essentielle à la production de gouttelettes lipidiques, source d’acides gras [
11
]. Or, une diminution de la réserve cellulaire en acides gras ainsi qu’une dérégulation du métabolisme cellulaire en absence de LACC1 avaient précédemment été rapportées [
12
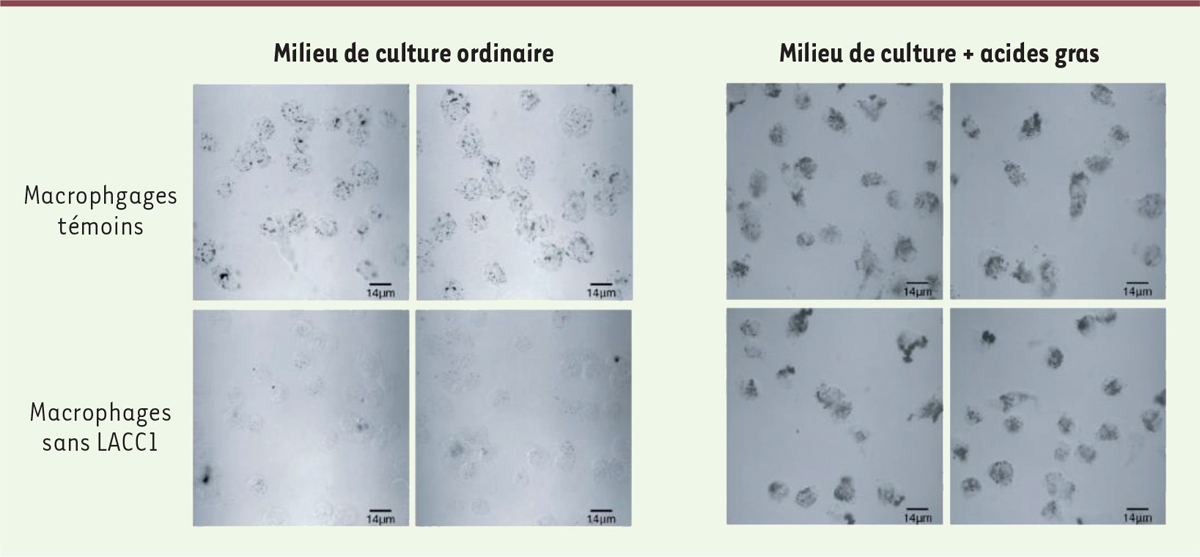
]. Nous avons donc testé l’effet de l’absence de LACC1 sur la production de ces gouttelettes lipidiques, et avons observé qu’elle était très diminuée dans les macrophages qui ne synthétisaient pas LACC1 (
Figure 2
).
 | Figure 2.
La protéine LACC1 favorise la production de gouttelettes lipidiques dans les macrophages.
La présence de gouttelettes lipidiques a été mise en évidence à l’aide d’un colorant spécifique dans des macrophages témoins (images du haut) ou dans des macrophages dépourvus de LACC1 (images du bas). Les macrophages ont été cultivés dans un milieu classique (images de gauche) ou dans un milieu supplémenté en acides gras (images de droite). En l’absence de LACC1, il n’y a pas de gouttelettes lipidiques dans le cytoplasme des macrophages, et ce défaut peut être corrigé par l’ajout exogène d’acides gras (palmitate).
|
La production d’acétyl-CoA à partir des acides gras alimente le cycle de Krebs, donc la respiration mitochondriale, productrice d’ATP. Dans les macrophages privés de LACC1, nous avons effectivement constaté, en mesurant leur consommation d’oxygène, une diminution de la respiration mitochondriale, qui peut être compensée par l’apport d’acides gras dans le milieu extracellulaire. |
Nous avons mis en évidence des mutations bialléliques dans le gène codant la protéine LACC1 chez plusieurs individus non apparentés atteints d’arthrite juvénile à début précoce. Cette protéine est exprimée exclusivement par les macrophages, et les mutations identifiées entraînent toutes une perte de son expression. Nous avons montré que LACC1 est impliquée dans le contrôle de l’autophagie à travers son interaction avec des acteurs clés de ce processus. En favorisant l’autophagie dans les macrophages, LACC1 pourrait permettre l’élimination de médiateurs lipidiques de l’inflammation présents dans les articulations. En effet, les gouttelettes lipidiques jouent un rôle protecteur pour la cellule en séquestrant les acides gras et en limitant l’accumulation de différents lipides cytotoxiques. Le recyclage des acides gras pourrait aussi favoriser les fonctions régulatrices des macrophages en contribuant à leur apport énergétique par la respiration mitochondriale. Le contrôle de l’autophagie étant fortement lié à la formation des lysosomes, LACC1 pourrait également intervenir dans d’autres fonctions cellulaires impliquant ces organelles, notamment la présentation des antigènes aux lymphocytes. Plus généralement, un défaut de trafic membranaire en l’absence de LACC1 pourrait expliquer le dysfonctionnement de l’élimination de corps apoptotiques ou de corps étrangers par phagocytose, et l’inflammation qui en résulte. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Omarjee
O
,
Mathieu
A-L
,
Quiniou
G
,
et al.
LACC1 deficiency links juvenile arthritis with autophagy and metabolism in macrophages.
.
J Exp Med.
2021;
;
218
:
:e20201006.
.
2.
Kang
JW
,
Yan
J
,
Ranjan
K
,
et al.
Myeloid cell expression of LACC1 is required for bacterial clearance and control of intestinal inflammation.
.
Gastroenterology.
2020;
;
159
:
:1051.
–
67
.
3.
Skon-Hegg
C
,
Zhang
J
,
Wu
X
,
et al.
LACC1 regulates TNF and IL-17 in mouse models of arthritis and inflammation.
.
J Immunol.
2019;
;
202
:
:183.
–
193
.
4.
Lahiri
A
,
Hedl
M
,
Yan
J
,
et al.
Human LACC1 increases innate receptor-induced responses and a LACC1 disease-risk variant modulates these outcomes.
.
Nat Commun.
2017;
;
8
:
:15614.
.
5.
Manthiram
K
,
Zhou
Q
,
Aksentijevich
I
,
et al.
The monogenic autoinflammatory diseases define new pathways in human innate immunity and inflammation.
.
Nat Immunol.
2017;
;
18
:
:832.
–
842
.
6.
Grinberg
AV
,
Hu
C-D
,
Kerppola
TK
.
Visualization of Myc/Max/Mad family dimers and the competition for dimerization in living cells.
.
Mol Cell Biol.
2004;
;
24
:
:4294.
–
4308
.
7.
Erbil
S
,
Oral
O
,
Mitou
G
,
et al.
RACK1 is an interaction partner of ATG5 and a novel regulator of autophagy.
.
J Biol Chem.
2016;
;
291
:
:16753.
–
16765
.
8.
Zhao
Y
,
Wang
Q
,
Qiu
G
,
et al.
RACK1 promotes autophagy by enhancing the Atg14L-beclin 1-Vps34-Vps15 complex formation upon phosphorylation by AMPK.
.
Cell Rep.
2015;
;
13
:
:1407.
–
1417
.
9.
Levine
B
,
Kroemer
G
.
Biological functions of autophagy genes: A disease perspective.
.
Cell.
2019;
;
176
:
:11.
–
42
.
10.
Bonilla
DL
,
Bhattacharya
A
,
Sha
Y
,
et al.
Autophagy regulates phagocytosis by modulating the expression of scavenger receptors.
.
Immunity.
2013;
;
39
:
:537.
–
547
.
11.
Nguyen
TB
,
Louie
SM
,
Daniele
JR
,
et al.
DGAT1-dependent lipid droplet biogenesis protects mitochondrial function during starvation-induced autophagy.
.
Dev Cell.
2017;
;
42
:
(9–21)
:e5.
.
12.
Cader
MZ
,
Boroviak
K
,
Zhang
Q
,
et al.
C13orf31 (FAMIN) is a central regulator of immunometabolic function.
.
Nat Immunol.
2016;
;
17
:
:1046.
–
1056
.
|