Dans le système nerveux, les neurones sont interconnectés par de longs prolongements arborisés : les axones. On estime que notre cerveau contient à lui seul plus de 160 000 km d’axones, sans compter les axones du système nerveux périphérique, qui peuvent individuellement atteindre une longueur d’un mètre chez l’homme [ 1 ]. La forme des neurones en général et la remarquable complexité de leur arborisation axonale sont rendues possibles par l’organisation particulière de leur squelette cellulaire (cytosquelette) [ 2 ]. Composé de microtubules, de filaments intermédiaires et de filaments d’actine, ce cytosquelette permet l’établissement, le maintien et le remodelage de l’organisation neuronale, organisant les connections synaptiques qui sous-tendent notamment les processus d’apprentissage et de mémorisation.
Depuis les années 1950, la microscopie électronique sur coupes fines a permis d’analyser l’organisation du cytosquelette neuronal, révélant à l’échelle nanométrique les réseaux de microtubules impliqués notamment dans le transport des protéines. Cependant, la préparation d’échantillons pour la microscopie électronique est complexe, et d’autres éléments du cytosquelette, comme le réseau d’actine, composé de filaments de 5 nm d’épaisseur, sont difficiles à observer sur des coupes fines de 60 nm d’épaisseur. L’essor de la microscopie optique en fluorescence a permis, dès les années 1980, de visualiser le maillage dense de l’actine dans des compartiments comme les épines dendritiques ou le cône de croissance de l’axone [ 3 ]. Cependant, la résolution de la microscopie optique est limitée à environ 200 nm, ce qui empêche de voir les détails de l’architecture du cytosquelette. Cette limite a été dépassée grâce à la microscopie de super-résolution, un ensemble de techniques optiques permettant d’atteindre une résolution jusqu’à dix fois supérieure, tout en conservant les avantages de la microscopie en fluorescence [ 4 ].
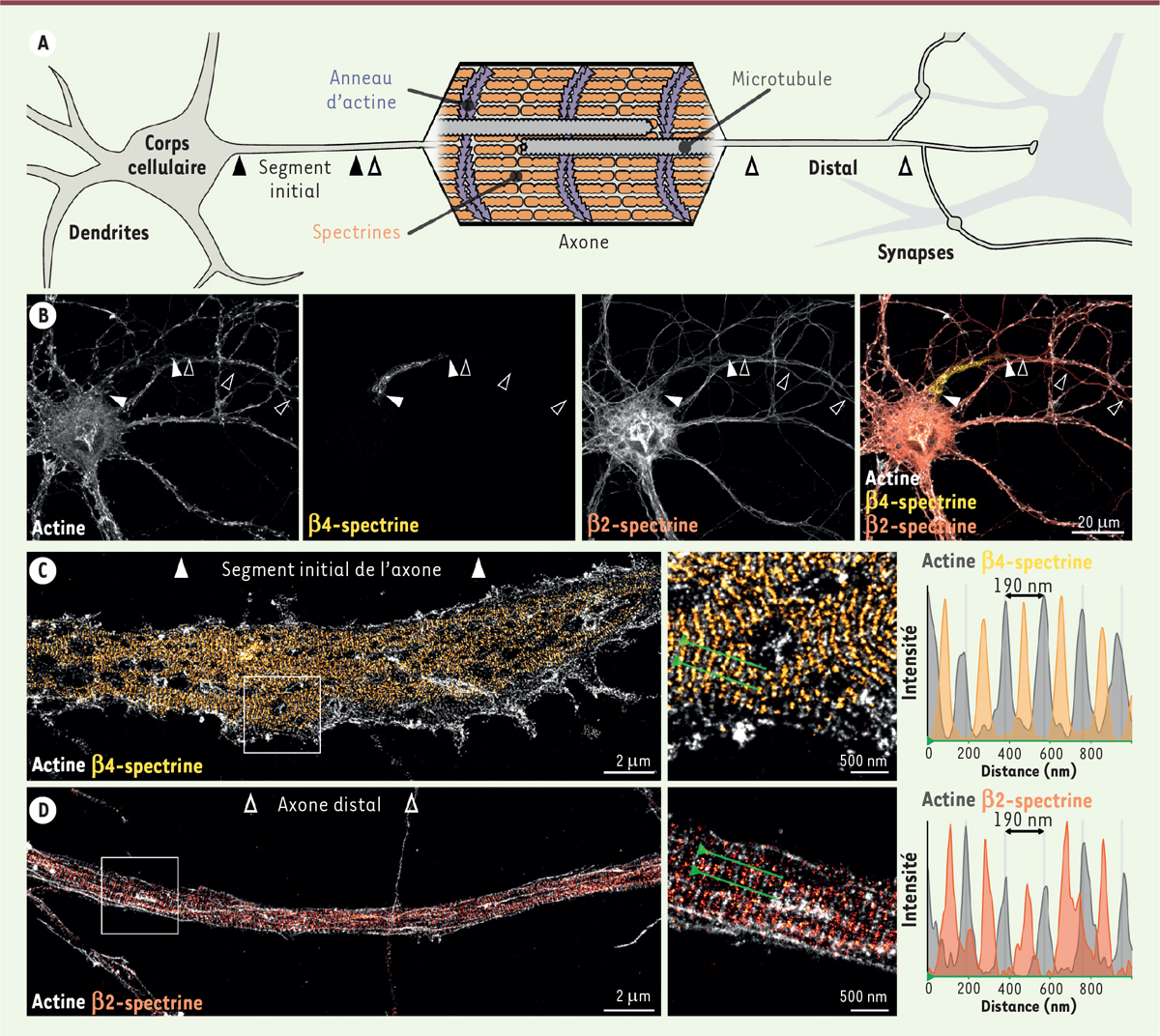
En 2013, la microscopie super-résolutive a ainsi permis une importante découverte concernant l’organisation du cytosquelette neuronal, en dévoilant un arrangement inhabituel de l’actine le long de l’axone [ 5 ]. Alors que la microscopie optique classique ne visualisait qu’un marquage faible et uniforme, la microscopie super-résolutive de type SMLM ( single molecule localization microscopy ), fondée sur la localisation successive de marqueurs fluorescents isolés [ 4 ], a révélé que l’actine forme, sous la membrane de l’axone, des anneaux circonférentiels régulièrement espacés de 190 nm (une valeur située juste en dessous de la limite de résolution de la microscopie optique classique), car ils sont connectés aux anneaux voisins par des tétramères de spectrine dont la longueur est précisément 190 nm ( Figure 1A ) [ 1 ]. Ces tétramères sont composés de sous-unités, α2 et β, avec une différence entre le segment initial de l’axone, où le tétramère de spectrine contient majoritairement la sous-unité β4, et le segment plus distal, où il contient la sous-unité β2 ( Figure 1B ). Lorsque l’on marque l’actine et le centre des tétramères de spectrine, la microscopie SMLM révèle l’alternance des bandes d’actine et de spectrine, avec une périodicité de 190 nm ( Figure 1C , 1D ).
| Figure 1.
L’échafaudage périodique d’actine et de spectrine le long de l’axone. A.
Schéma d’un neurone montrant le corps cellulaire et les dendrites (à gauche), et l’axone qui se prolonge jusqu’aux synapses avec une cellule cible (à droite). L’axone peut être subdivisé en un compartiment proximal (segment initial) et un compartiment distal. Un agrandissement révèle l’organisation interne de l’axone (au centre), et montre les microtubules (en gris), et les anneaux d’actine (en violet) espacés par des tétramères de spectrine (en orange).
B.
Image d’épifluorescence d’un neurone de rat en culture marqué pour l’actine (en gris), la spectrine β4 (en jaune sur la superposition) présente dans le segment initial de l’axone (flèches pleines), et la spectrine β2 (en orange sur la superposition) présente le long du segment distal (flèche contours). C. Image SMLM du segment initial d’un axone marqué pour l’actine (gris) et la spectrine β4 (jaune). Le profil d’intensité (à droite) correspond à la ligne verte sur l’image agrandie (au centre). D. Image SMLM du segment initial d’un axone marqué pour l’actine (gris) et la spectrine β2 (orange). Le profil d’intensité (à droite) correspond à la ligne verte sur l’image agrandie (au centre) (les images en B, C, et D sont adaptées de [
7
]).
|
Cette découverte a ensuite été confirmée par plusieurs équipes, en utilisant diverses méthodes de microscopie optique super-résolutive [ 6 ], dans de nombreux types de neurones issus d’organismes divers. Cependant, une interrogation et un certain scepticisme demeurait : pourquoi la microscopie électronique utilisée depuis des décennies n’avait-elle pas permis, malgré sa résolution nanométrique, d’identifier cette architecture remarquablement régulière de l’actine axonale ? La microscopie électronique en transmission « classique », qui analyse des coupes fines de tissus, est peu adaptée au faible contraste des filaments d’actine ainsi qu’à la géométrie cylindrique des axones. Pour révéler l’échafaudage périodique d’actine-spectrine en microscopie électronique, nous avons donc développé la technique d’ unroofed -PREM ( platinum replica electron microscopy ) sur des neurones en culture [ 7 ] : les cellules sont d’abord décapées par un bref traitement aux ultrasons ( unroofing ), exposant la face cytoplasmique de la membrane ventrale adhérente à la lamelle. Après fixation et traitements de l’échantillon permettant de préserver l’ultrastructure, une réplique de platine/carbone de ces membranes est réalisée, placée sur une grille, et observée par microscopie électronique en transmission. Cela permet d’examiner le cytosquelette sous-membranaire, grâce à une préservation tridimensionnelle des structures, avec une résolution et un contraste inégalés [ 8 ].
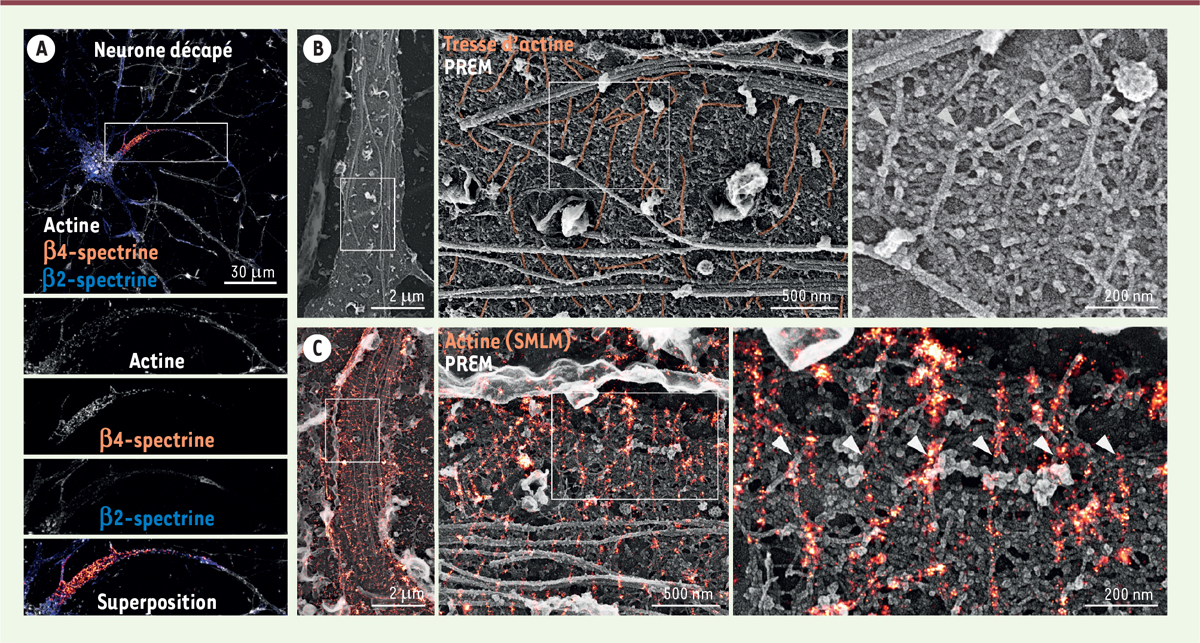
Nous avons tout d’abord adapté la technique de décapage aux neurones en culture, afin d’exposer la membrane du corps cellulaire, des dendrites et du segment proximal de l’axone ( Figure 2A ), et vérifié par microscopie super-résolutive après décapage, que celui-ci ne désorganisait pas l’échafaudage sous-membranaire d’actine et de spectrine. L’examen des neurones décapés par PREM montre la présence d’axones « ouverts », avec des faisceaux de microtubules longitudinaux ( Figure 2B ). À plus fort grossissement, on peut observer des assemblages de filaments d’actine alignés perpendiculairement aux microtubules juste sous la membrane, et régulièrement espacés de 190 nm au sein d’un maillage de protéines ( Figure 2B ). L’objectif a dès lors été de comprendre leur organisation ultrastructurale. Nous avons montré que ces assemblages forment des « tresses » d’actine, et que ces tresses correspondent aux bandes d’actine que l’on observe en microscopie optique super-résolutive. Pour cela, nous avons utilisé des immunomarquages révélés par des billes d’or, ainsi qu’un marquage des filaments d’actine par la myosine S1 qui les décore, confirmant ainsi que les tresses observées par PREM correspondent bien à des filaments d’actine, et que le maillage de protéines en forme de bâtonnets connectant les tresses d’actine est constitué de spectrines. Nous avons également étudié l’organisation de protéines partenaires de l’échafaudage d’actine et spectrine dans le segment initial de l’axone, notamment celle de la chaîne légère de la myosine, qui interagit avec les anneaux d’actine, et celle de l’ankyrine G, qui se lie aux spectrines et immobilise les canaux ioniques situés au début de l’axone et impliqués dans la production du potentiel d’action [ 9 ].
| Figure 2.
Visualisation des tresses d’actine, après décapage de l’axone, par PREM et par microscopie corrélative SMLM/PREM. A.
Neurone de rat en culture après décapage par des ultrasons, fixation chimique, et marquage de l’actine (en gris), de la spectrine β4 (en orange sur la superposition), et de la spectrine β2 (en bleu sur la superposition). Le marquage, effectué sans perméabilisation préalable, confirme que le décapage a rendu le corps cellulaire et la partie proximale de ses prolongements dendritiques et axonal accessibles aux anticorps.
B.
Images PREM d’un axone décapé, obtenues à des grossissements croissant de gauche à droite. Sur les deux images de droite, les microtubules apparaissent comme de larges filaments horizontaux, tandis que les tresses d’actine (en orange) sont verticales et espacées régulièrement d’environ 190 nm.
C.
Images corrélatives d’un axone, composées de l’image SMLM de l’actine (orange) et de l’image PREM (gris). Sur les deux images de droite, on peut voir la superposition des bandes verticales d’actine en SMLM et des tresses d’actine en PREM (figure adaptée de [
7
]).
|
Enfin, nous avons apporté la preuve que les tresses d’actine visualisées en PREM correspondaient aux bandes vues en microscopie super-résolutive, en développant une méthode corrélative pour observer successivement le même échantillon par les deux techniques. Après décapage par des ultrasons et marquage, l’actine est imagée par SMLM, puis une réplique de platine est préparée, sur laquelle le même axone est relocalisé et visualisé en microscopie électronique ; les deux images sont ensuite alignées à l’échelle nanométrique. Nous avons ainsi constaté que les tresses d’actine des images PREM s’alignent sur les bandes d’actine des images SMLM, apparaissant et disparaissant au sein du réseau de spectrines ( Figure 2C ). Cette combinaison de la microscopie super-résolutive et de la PREM permet, en plus d’une démonstration directe de l’assemblage en tresses des anneaux d’actine, d’allier la résolution ultrastructurale de la PREM et l’identification moléculaire de la microscopie en fluorescence : nous l’avons utilisée pour identifier les différents composants de l’échafaudage comme les spectrines, l’ankyrine G, ou la chaîne légère de la myosine.
C’est la première fois que l’échafaudage périodique d’actine et de spectrine axonal a pu être observé en microscopie électronique. La résolution moléculaire de la PREM a dévoilé que les anneaux d’actine sont composés de deux longs filaments tressés entre eux, une structure d’actine nouvelle et unique [ 7 ]. Ce résultat est par ailleurs surprenant car on pensait auparavant que les anneaux d’actine étaient composés de courts filaments d’actine « coiffés », sur le modèle de l’organisation des spectrines et de l’actine présentes sous la membrane des globules rouges [ 1 ]. Cette architecture en longs filaments tressés permet d’expliquer plusieurs propriétés des anneaux d’actine de l’axone, comme leur remarquable stabilité et leur rigidité.
Nos travaux fournissent ainsi un fondement structural à la compréhension de l’échafaudage périodique d’actine et de son enchevêtrement dans le réseau des spectrines le long des axones, et permet de formuler de nouvelles hypothèses sur les mécanismes de son assemblage et de son maintien. Elle permet également d’aborder avec un regard nouveau l’étude des différents rôles de cet échafaudage, comme support mécanique de l’axone, mais également comme acteur de la signalisation cellulaire [ 10 ] ou comme régulateur des échanges entre les compartiments intracellulaires et la membrane de l’axone.