| |
| Med Sci (Paris). 38(1): 45–51. doi: 10.1051/medsci/2021241.Maladie de Parkinson Le rôle de la synucléine Erwan Bezard1* and Benjamin Dehay1 1Univ. Bordeaux, CNRS, IMN (Institut des maladies neurodégénératives), UMR 5293
,
33000Bordeaux
,
France |
Vignette (© Erwan Bezard).
L’ensemble des maladies neurodégénératives (maladie d’Alzheimer, maladie de Parkinson, maladie de Huntington, sclérose latérale amyotrophique, ou maladies à prions) se caractérisent toutes par l’accumulation, dans le système nerveux central, de protéines anormalement repliées et, pour certaines d’entre elles, également dans les systèmes nerveux périphérique et entérique [
1
]. En raison de cette caractéristique qui leur est commune, ces maladies sont souvent désignées sous le nom de « protéinopathies ». Les agrégats protéiques que l’on décrit dans ces différentes maladies, peuvent être intracellulaires, touchant les neurones, comme les corps de Lewy dans la maladie de Parkinson ou les enchevêtrements neurofibrillaires dans la maladie d’Alzheimer, ou gliaux, comme les inclusions gliales cytoplasmiques dans l’atrophie multi-systématisée
1,
. Ils peuvent également être extracellulaires, comme les plaques séniles dans la maladie d’Alzheimer [
1
].
Plusieurs maladies neurodégénératives présentent des lésions neuropathologiques contenant des agrégats constitués de la forme insoluble de la protéine a-synucléine. Ces maladies peuvent être regroupées en deux catégories : celles dans lesquelles l’accumulation de synucléine agrégée semble être un facteur primaire, par exemple, la maladie de Parkinson, l’atrophie multisystématisée, la maladie à corps de Lewy diffus ; et celles qui présentent également une agrégation de synucléine, mais pour lesquelles nous savons qu’elles sont la conséquence d’autres mécanismes : par exemple, la maladie d’Alzheimer qui a pour cause notamment l’accumulation du peptide b-amyloïde et de la protéine Tau, ou les maladies lysosomales, qui induisent une incapacité du lysosome, un organelle impliqué dans le catabolisme, à traiter les débris cellulaires, d’où il résulte une accumulation de protéines anormales. Parmi les maladies pour lesquelles l’accumulation d’a-synucléine agrégée est un facteur primaire, deux groupes peuvent être distingués : les maladies principalement caractérisées par une atteinte neuronale, avec présence de corps de Lewy et les neurites de Lewy, qui impliquent un dysfonctionnement primaire et/ou secondaire des lysosomes et des changements de composition des lipides. La maladie de Parkinson et la maladie à corps de Lewy diffus appartiennent à ce groupe ; le deuxième groupe est caractérisé par des inclusions cytoplasmiques oligodendrogliales (ainsi que des inclusions neuronales) qui entraînent une dégradation de la myéline (les oligodendrocytes étant les cellules qui produisent les gaines de myéline). Ces deux types de synucléopathies primaires diffèrent par la nature biochimique des inclusions et par le schéma de la neurodégénérescence induite. Les pathologies neuronales, comme les pathologies oligodendrogliales, sont diverses, tant en termes de nature ou de forme, que de quantité de stigmates anatomiques qu’elles présentent. Derrière des vocables établis, corps de Lewy et inclusions cytoplasmiques oligodendrogliales, se cache en fait une myriade d’inclusions, intracellulaires comme extracellulaires, plus ou moins matures et plus ou moins toxiques, mais toutes sont caractérisées par la présence de l’a-synucléine, mal repliée et agrégée.
L’anomalie neuronale dite de Lewy est la plus étudiée dans le cas de la maladie de Parkinson. Bien qu’elle ait des origines diverses, la plupart des recherches se concentrent sur la caractérisation des corps de Lewy des noyaux inférieurs du tronc cérébral, qui sont bien structurés, avec un cœur entouré d’un halo. Les corps de Lewy corticaux sont moins structurés. Ils ne peuvent donc pas être considérés comme « classiques » et restent beaucoup moins étudiés. Cette hétérogénéité morphologique des deux types de corps de Lewy se distinguent par leur enrichissement en α-synucléine : 64 % des corps de Lewy dans la substance noire sont constitués d’α-synucléine ; ils ne représentent que 31 % des corps de Lewy corticaux [
2
]. Les inclusions gliales que l’on observe dans la maladie de Parkinson sont peu étudiées (sauf, bien sûr, par les anatomo-pathologistes).
|
Pourquoi et comment la synucléine s’agrège-t-elle ?
La pierre angulaire de la formation des corps de Lewy est constituée par la capacité de l’a-synucléine, une protéine dite amyloïde, à s’agréger [
3
]. La
Figure 1A
présente un résumé schématique de la voie d’agrégation de cette protéine. L’a-synucléine existe sous diverses formes conformationnelles. Elle est en effet présente sous au moins deux isoformes structurelles : un monomère, soluble, nativement déplié, et une forme riche en hélices a, liée à une membrane. Certains auteurs ont suggéré l’existence d’une autre organisation de la protéine, tétramérique et résistante à l’agrégation [
4
]. Les isoformes peuvent subir des changements structurels spectaculaires entraînant la formation d’assemblages riches en feuillets b, prémices des formes amyloïdes plus complexes de la protéine. D’après de nombreuses études réalisées
in vitro
, il est clair que le comportement de l’a-synucléine suit un équilibre dynamique dans lequel le monomère s’agrège, d’abord en plusieurs types de petites espèces oligomériques qui peuvent être stabilisées par des interactions entre feuillets b, puis en protofibrilles de plus grandes masses moléculaires, insolubles, qui peuvent se polymériser en fibrilles amyloïdogènes en réassemblant celles des corps de Lewy. Le mécanisme régissant le changement conformationnel fondamental du monomère normal d’a-synucléine en une forme pathologique, associée à la maladie, reste néanmoins inconnu.
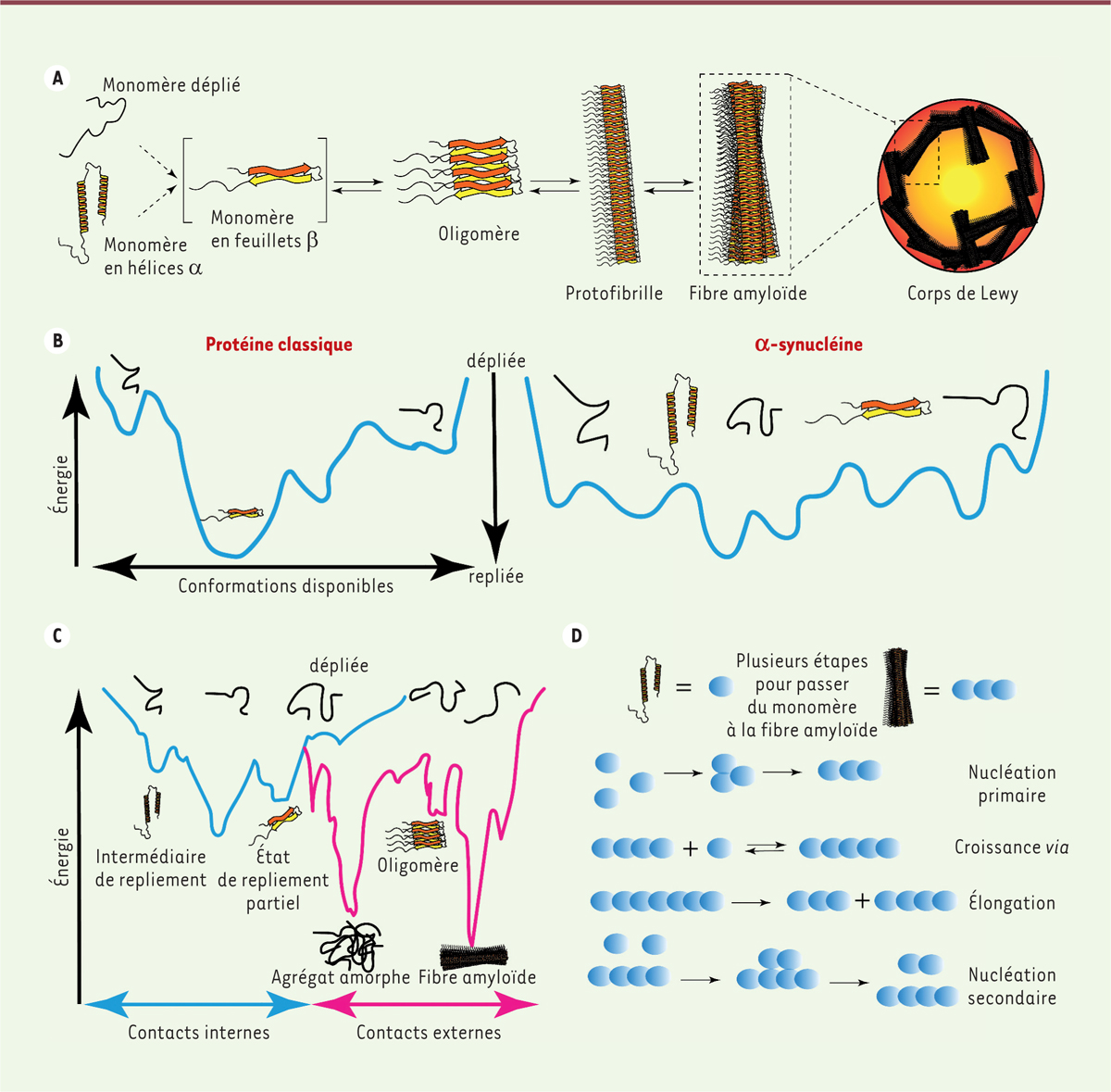
 | Figure 1.
Schéma récapitulant les différents aspects de l’agrégation de l’α-synucléine. A.
Frise schématique de la voie d’agrégation de l’α-synucléine. L’α-synucléine existe sous au moins deux isoformes structurelles : un monomère soluble nativement déplié et une forme liée à la membrane, riche en hélice α. Ces isoformes peuvent subir des changements structurels entraînant la formation d’assemblages riches en feuillets β, les oligomères, qui, eux-mêmes s’agrègent en protofibrilles insolubles de plus grande masse moléculaire, celles-ci se polymérisant en fibres amyloïdes que l’on trouve dans le corps de Lewy.
B.
Diagrammes établissant la relation entre énergie thermodynamique libre et état conformationnel : à gauche, pour une protéine classique, les états structurés, par exemple en feuillets β, possèdent une faible énergie libre, correspondant à la fosse la plus profonde ; à droite, pour l’α-synucléine, une protéine intrinsèquement désordonnée, c’est-à-dire qui, dans des conditions normales, « hésite » continuellement entre les différents états.
C.
Diagramme établissant la relation entre énergie thermodynamique libre et état conformationnel en fonction du type d’interactions moléculaires. La partie bleue de la courbe décrit les conséquences sur la conformation adoptée par l’α-synucléine de ses interactions internes (entre deux acides aminés). La partie magenta de la courbe décrit les conformations adoptées en réaction à un changement de conditions externes (pH, quantité, stress oxydant, etc.). Alors que les états partiellement repliés peuvent être inversés avec une dépense énergétique minimale (centre du diagramme), les fibrilles amyloïdes produisent une fosse très profonde qui nécessiterait une énorme dépense énergétique pour l’inverser (et pour revenir à l’état déplié).
D.
Schéma décrivant les étapes requises pour passer d’un monomère à une fibre amyloïde. Ces étapes comprennent la nucléation primaire, la croissance et la prolifération par allongement et, enfin, la nucléation secondaire.
|
Appliquée à l’a-synucléine, la notion de repliement, ou de conformation dite « pathologique », apparaît restrictive. L’a-synucléine est l’une des protéines les plus intrinsèquement désordonnées. Sa structure oscille en effet continuellement entre une variété de différentes conformations, peut-être un continuum, allant d’une protéine complètement dépliée à une protéine complètement repliée [
5
].
Cette transition de forme peut être illustrée par un diagramme d’énergie, qui représente la stabilité d’une forme en fonction de l’énergie nécessaire pour la maintenir (
Figure 1B
). Imaginons que l’on pousse une balle dans ce diagramme. Elle finira par se retrouver « enfermée » dans une fosse, la plus profonde, pour laquelle l’énergie libre sera la plus faible, un état de « repos ». C’est ce qui se produit pour une protéine « structurée » standard, qui prend la forme dans laquelle l’énergie pour l’y maintenir est la plus faible, la « fosse profonde » [
6
]. En conditions physiologiques, le paysage énergétique conformationnel qui caractérise l’a-synucléine ne comporte pas de véritable « fosse profonde », toutes les fosses énergétiques étant de profondeurs plus ou moins égales. La protéine « hésite » ainsi continuellement entre les différents états énergétiques (
Figure 1B
).
Certaines conditions externes peuvent cependant modifier ce paysage conformationnel, en créant une fosse d’énergie favorisant une conformation particulière. C’est, par exemple, ce qui se produit lorsque l’a-synucléine interagit avec les lipides membranaires dans les présynapses. Ces lipides stabilisent en effet la structuration de l’hélice a de la protéine. Ils augmentent ainsi la proportion de protéine qui prend cette forme particulière. C’est cette forme qui peuple la surface des vésicules de neurosécrétion et régule la cinétique de leur libération.
D’autres facteurs, externes, peuvent creuser des « fosses énergétiques ». Ils correspondent à une organisation de la protéine en feuillet b [
7
] (
Figure 1C
) : il peut s’agir du pH, d’une modification post-traductionnelle, de clivages ou de substitutions d’acides aminés de la protéine, dues, par exemple, à des mutations ponctuelles (huit sont connues à ce jour). Sous sa forme de feuillet b, l’a-synucléine peut s’auto-agréger en grandes piles amyloïdes. Celles-ci sont extrêmement stables et correspondent à une fosse d’énergie très profonde, rendant la protéine pathologique. À chaque état de repliement correspond ainsi une fosse d’énergie (
Figure 1C
) : plus la fosse est profonde, plus il sera difficile d’inverser la forme de la protéine. Alors que les états partiellement repliés peuvent être inversés avec une dépense énergétique minimale, les fibrilles amyloïdes produisent une fosse très profonde, qui nécessitera une dépense énergétique importante pour l’inverser (et donc revenir à l’état déplié de la protéine).
Les différents états de repliement de la protéine ont donc leur importance. Mais il n’en reste pas moins que l’agrégation des monomères, selon leur structure, nécessite une première étape particulière que l’on appelle nucléation (
Figure 1D
). La formation de la fibrille amyloïde est en effet un processus qui repose sur plusieurs étapes : des étapes de nucléation primaire, de croissance et de prolifération par allongement, et de nucléation secondaire [
8
].
La nucléation primaire est importante. Elle crée les premières fibrilles. La nucléation secondaire peut être plus problématique. Elle peut être à l’origine d’une amplification exponentielle du nombre de protofibrilles et/ou de fibrilles ! Une fois l’assemblage des monomères initié, la structure amyloïde agit comme un « trou noir ». Elle attire de plus en plus de monomères dans la superstructure ainsi constituée, rendant le système toujours plus stable en termes d’énergie. Dans cet état, le neurone assujetti à ce processus est en fait exploité. Il produira toujours plus d’a-synucléine afin de nourrir ce « monstre ».
Les conformations des feuillets b des monomères, qui constituent le point de départ du processus, peuvent être à l’origine de différentes structures amyloïdes, donc de différentes espèces d’agrégats d’a-synucléine [
9
]. Ces différentes amyloïdes d’a-synucléine se comportant chacune comme un « trou noir » peuvent ainsi induire des présentations pathologiques différentes. C’est ce mécanisme qui pourrait être à l’origine des différentes synucléinopathies, telles que la maladie de Parkinson, l’atrophie multisystématisée ou la démence à corps de Lewy, chacune reflétant la croissance et la propagation de l’espèce d’amyloïde qui serait spécifique de la maladie [
10
].
L’a-synucléine, sous sa forme agrégée, est décrite, de plus en plus, comme pouvant altérer quasiment tous les composants ou organelles de la cellule. Cette diversité d’atteintes permet de comprendre et d’expliquer les théories anciennes qui impliquaient différents organelles dans les mécanismes de neurodégénérescence dans la maladie de Parkinson [
11
]. Les dysfonctionnements de la mitochondrie, anciennement incriminés, restent ainsi valables pour expliquer la maladie, mais il faut maintenant intégrer le fait que l’a-synucléine agrégée, en se liant à la membrane de la mitochondrie, affecte son fonctionnement, provoquant les désordres qui avaient anciennement été observés.
|
Propagation de l’anomalie agrégative de l’a-synucléine dans le cerveau
En 2003, l’anatomo-pathologiste allemand Heiko Braak et ses collègues ont proposé, sur la base de l’étude de centaines de cerveaux (pour lesquels le diagnostic
ante mortem
n’était pourtant parfois pas clairement établi), le modèle dit de Braak de progression de la synucléinopathie neuronale [
12
]. Selon ce modèle, l’a-synucléine agrégée se déposerait dans des régions du cerveau et dans des types de neurones spécifiques, provoquant la maladie dite de Lewy, selon un schéma temporel et spatial stéréotypé, qui monte depuis le tronc cérébral inférieur par les régions sensibles du mésencéphale (par exemple, la fameuse substance noire) et du cerveau antérieur et, enfin, dans le cortex cérébral [
13
]. Ce schéma temporel suggérait une diffusion de l’information pathologique, envahissant progressivement l’ensemble du cerveau par des régions interconnectées (
Figure 2
).
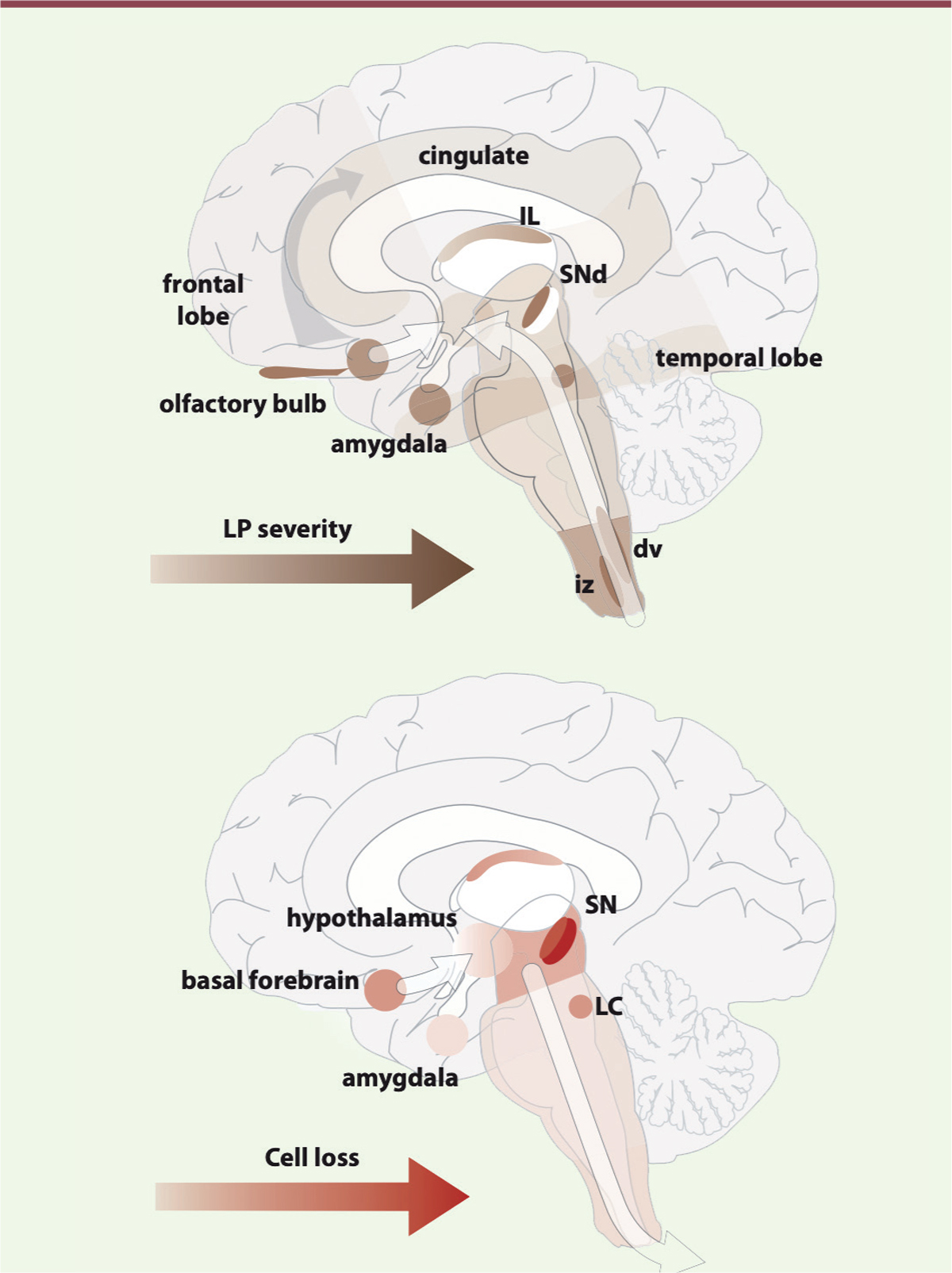
 | Figure 2.
Dissociation entre neurodégénérescence et pathologie dite « de Lewy ».
En haut : régions contenant la pathologie de Lewy et la gravité (LP severity, selon le code couleur) et la progression conceptuelle fondée sur des données post mortem transversales de patients à différents stades de la maladie de Parkinson. En bas : régions présentant une perte de cellules neuronales (Cell loss), ainsi que la gravité (selon le code couleur) et la progression conceptuelle fondées sur des données post mortem transversales de patients décédés à différents stades de la maladie de Parkinson. Bien qu’il y ait un certain chevauchement dans les régions identifiées comme présentant une pathologie de Lewy et une perte neuronale, la gravité et l’identité des régions touchées au cours de l’évolution de la maladie indiquent des schémas de progression diffé-rents (ces schémas sont indépendants des principales projections des régions touchées), ce qui suggère que la propagation des agrégats d’α-synucléine par les connexions neuronales n’est pas le seul mécanisme en jeu. IL : intralaminar thalamus ; SNd : région dorsale de la substance noire pars compacta ; dv : noyau moteur dorsal du nerf vague ; iz : zone réticulée intermédiaire (figure en anglais reproduite avec la permission de [
30
]).
|
En 2008, des chercheurs ont découvert que des patients parkinsoniens, qui avaient bénéficié des années auparavant (jusqu’à 15 ans) d’une greffe striatale de neurones mésencéphaliques embryonnaires, présentaient des corps de Lewy et une pathologie de Lewy dans leurs greffons au moment de leur décès [
14
,
15
]. La pathologie était complète et comprenait des corps de Lewy, des neurites de Lewy, exprimant l’a-synucléine, mais aussi des marqueurs classiques utilisés en anatomopathologie. Les jeunes neurones dopaminergiques (c’est-à-dire ceux issus de la greffe) présentaient donc une maladie dont on supposait qu’elle provenait de l’anomalie présente chez l’hôte, c’est-à-dire du patient. L’hypothèse de la propagation de l’hôte à la greffe, également connue sous le nom d’« hypothèse prion » dans la maladie de Parkinson, était ainsi née. Elle a très fortement conforté l’hypothèse de Braak.
L’hypothèse des mécanismes permettant la propagation s’est cependant rapidement heurtée à un problème, car celle-ci pouvait, en fait, s’expliquer par une diffusion soit passive, soit active. Une diffusion passive pourrait par exemple être expliquée si une zone spécifique du cerveau produisait l’agrégation de l’a-synucléine. Elle diffuserait ensuite tout autour du cerveau, la propagation observée étant la conséquence de la difficulté de diffusion des agrégats à travers l’espace extracellulaire ou le système glymphatique, de leur point d’origine vers les zones corticales les plus éloignées. La diffusion active suggérait au contraire que c’était l’information du mauvais repliement de l’a-synucléine, ou l’information d’agrégation, qui était transmise d’une zone du cerveau à une autre, l’agrégation se produisant dans chaque zone du cerveau atteint.
La possibilité que la propagation puisse, théoriquement, résulter d’au moins deux mécanismes, rend complexe sa compréhension. Dans le premier mécanisme, les agrégats, ou plus exactement les oligomères, pourraient être transférés d’une cellule à l’autre par un passage direct. Une autre hypothèse propose que ce ne seraient pas les oligomères (ou agrégats) de la synucléine qui passent d’une cellule à l’autre, mais un facteur intermédiaire, encore à identifier, qui serait produit à la suite d’une réponse au stress de la cellule cérébrale affectée. Parmi les cellules réceptrices, seules les cellules vulnérables réagiraient en provoquant l’agrégation de l’a-synucléine. Bien qu’il existe à ce jour davantage de preuves en faveur de la propagation directe, il ne faut pas ignorer le fait qu’un nombre limité de cellules cérébrales présentent
in fine
la pathologie de Lewy, ce qui supporte l’hypothèse d’une vulnérabilité cellulaire différentielle parmi les cellules cérébrales. Il est en fait très probable que les deux hypothèses s’appliquent et qu’elles soient synergiques : une propagation directe se produirait, mais seules les cellules vulnérables réagiraient, en favorisant la fibrillation de l’a-synucléine [
16
]. La vulnérabilité cellulaire pourrait être intrinsèque, telle que pour le très fragile neurone dopaminergique, ou résulter de facteurs extrinsèques comme l’induction d’une inflammation.
La diffusion active a été l’objet de nombreuses publications montrant son efficacité et tentant d’élucider son mécanisme. Néanmoins, aucun mécanisme n’apparaît exclusivement responsable, et plusieurs voies participent certainement à la propagation. Celle-ci peut en effet impliquer une endocytose, une pénétration directe, les exosomes, une transmission transynaptique ou des récepteurs membranaires [
17
].
Une avancée notable a été réalisée avec la démonstration expérimentale chez l’animal de l’existence d’une propagation de l’agrégation de l’a-synucléine par l’équipe américaine de Virginia Lee, pionnière du domaine. En 2012, son équipe avait en effet montré que l’inoculation de fibrilles synthétiques d’a-synucléine dans le cerveau de souris conduisait à la transmission, de cellule à cellule, de la pathologie agrégative dans des régions anatomiquement interconnectées [
18
]. L’accumulation de l’anomalie agrégative entraînait également une perte des neurones dopaminergiques dans la substance noire, la zone du cerveau dont la dégénérescence est à l’origine de l’apparition des symptômes de la maladie de Parkinson. Cette mise en évidence chez l’animal de l’existence d’une cascade neurodégénérative a ainsi permis d’établir un lien mécanistique entre la transmission de l’a-synucléine pathologique et certaines caractéristiques de la maladie de Parkinson.
Aussi enthousiasmante fût-elle, cette étude ne faisait pourtant pas de distinction entre propagation et diffusion. Quelques années plus tard, l’hypothèse de la diffusion d’un message agrégatif fut validée par Valérie Osterberg
et al.
[
19
]. Les auteurs utilisèrent la même forme synthétique de l’a-synucléine de souris, mais ils l’injectèrent à des souris transgéniques exprimant une protéine de fusion constituée de l’a-synucléine fusionnée à la GFP (
green fluorescent protein
) afin de visualiser son déplacement par imagerie
in vivo
, directement sur la surface du cortex, après avoir pratiqué une craniotomie pour exposer le cerveau à la lumière. Ils ont ainsi pu recueillir le signal émis par la GFP et suivre son évolution dans les cellules au cours du temps. Dans ces conditions, l’injection à distance de l’a-synucléine synthétique agrégée s’est accompagnée de l’apparition progressive d’agrégats, passant par les différentes étapes de maturation. Après quatre mois, les inclusions somatiques apparaissaient matures et denses. L’a-synucléine endogène répondait donc à l’administration exogène d’a-synucléine agrégée en s’agrégeant progressivement, résultant en la formation de neurites et d’inclusions somatiques contenant de l’a-synucléine. Il y avait donc eu une véritable transmission de l’information pathologique entre la synucléine injectée et la synucléine endogène.
L’observation de la propagation de la pathologie a été réalisée
in vitro
mais également
in vivo
dans des modèles murins (en grande majorité des souris) [
10
,
18
,
20
,
21
] et avec des primates non humains, pour quelques-uns [
22
-
25
]. Notons néanmoins que le taux d’a-synucléine endogène est d’une importance capitale pour interpréter les résultats de ces expériences. En effet, alors que les animaux de type « sauvage », qui présentent des niveaux d’a-synucléine endogène physiologiques, sont préférables pour simuler la situation observée en clinique, certaines études examinent la propagation de la protéine chez des animaux qui présentent des niveaux supra-physiologiques d’a-synucléine, soit parce qu’ils sont transgéniques, avec plusieurs copies des gènes dans la plupart des cellules (selon le promoteur utilisé), soit parce qu’une augmentation locale de l’expression d’a-synucléine a été induite en utilisant des vecteurs viraux. L’apparition d’événements d’agrégation, par ailleurs rares, est alors favorisée, modifiant la stœchiométrie de la réaction chimique, déplaçant la synucléine dépliée vers les fibrilles et inversement. Une autre distinction importante doit être faite selon les études. En effet, deux types d’approches peuvent être distingués. La première utilise des assemblages d’a-synucléine recombinante, générée à partir de la séquence d’une protéine provenant de différentes espèces animales (souris, rat, homme). Bien que synthétiques, ces protéines ont des origines souvent inconnues des auteurs. Pourtant cette disparité entre protéines est à prendre en considération pour comprendre la diversité pathologique de la maladie [
9
]. La stratégie qui utilise ces protéines recombinantes, apparemment simple, est extrêmement intéressante et a permis des progrès dans la compréhension des mécanismes impliqués dans la diffusion, mais la prudence s’impose car l’a-synucléine recombinante agrégée utilisée ne peut être considérée comme la substance toxique à l’origine des altérations observées dans le cerveau des patients. La deuxième catégorie de travaux (beaucoup moins nombreux) utilise des extraits de cerveaux provenant de patients. Il s’agit soit d’homogénats cérébraux, soit de fractionnements cellulaires où seule la fraction contenant les corps de Lewy est utilisée pour générer le processus pathologique. Dans ce cas, les chercheurs utilisent ce qu’ils considèrent comme la fraction toxique. Mais celle-ci est toujours associée à d’autres constituants, et les corps de Lewy sont injectés à des doses faibles.
Le consensus désormais admis pour la propagation du mécanisme de diffusion est que, lorsque l’a-synucléine agrégée est injectée dans le cerveau, qu’il s’agisse d’un agrégat de synthèse ou d’un extrait du cerveau isolé de patients atteints de la maladie de Parkinson, l’a-synucléine agrégée exogène est capturée par les cellules du cerveau par plusieurs mécanismes. Dès lors, il est possible de reproduire, en partie, la physiopathologie de la maladie, l’agrégation de l’a-synucléine étant un processus intracellulaire. L’a-synucléine exogène ainsi introduite dans la cellule transmet l’information de mauvais repliement et/ou d’agrégation à l’a-synucléine endogène par un mécanisme non identifié à ce jour. Ce processus se produit au sein d’un volume de tissu restreint qui correspond au volume injecté. Cependant, l’a-synucléine endogène, alors mal repliée, est également capable d’être libérée et donc transmise aux cellules voisines. Le cercle vicieux de propagation recommence alors, contaminant progressivement tout le cerveau. |
Une propagation de la pathologie plus complexe qu’imaginée
Pour heuristique qu’elle fut, il faut néanmoins considérer l’existence de faits non concordants avec l’hypothèse de Braak. En effet, dans l’article original publié en 2002 [
26
], seuls 30 cas sur les 413 présentant des neurites de Lewy dans le noyau moteur dorsal du nerf vague ont été utilisés pour fournir la base du schéma de stratification des auteurs, remettant en question le fait que le noyau moteur dorsal du nerf vague soit la structure anatomique où se trouvent les premiers signes de la pathologie de Lewy. Également, aucun corps de Lewy n’a été trouvé dans la substance noire des patients parkinsoniens dits idiopathiques, correspondant à 30 individus, avec la description de très peu de pathologies liées à une synucléinopathie, dans quatre cas, tous âgés de plus de 85 ans. La grande majorité des cas étudiés dans cette cohorte étaient des cas dits « incidents », c’est-à-dire qu’ils présentaient des corps de Lewy sans que les anatomo-pathologistes n’aient eu accès à des informations cliniques sur la présence ou non de symptômes, ce qui rend quelque peu difficile la définition de l’évolution anatomo-pathologique de la maladie dans ces cas, puisqu’il n’y en avait pas de maladie au sens sémiologique [
12
].
En 2008, une étude clinico-pathologique rétrospective, c’est-à-dire utilisant des cerveaux pour lesquels le statut clinique des donneurs était documenté, a montré que 18,3 % des cas de maladie de Parkinson ne suivaient pas le schéma de Braak. Dans 8,3 % des cas, le noyau moteur dorsal du nerf vague n’était pas impliqué, malgré la présence d’une synucléinopathie dans le tronc cérébral ou dans les régions corticales [
27
]. Depuis cette date, plusieurs travaux ont suggéré que le système de Braak ne permettait pas de classer près de 50 % des cas de maladie de Parkinson. En particulier, Julia Zaccai
et al.
ont montré que seuls 51 % des 208 cas d’autopsie qu’ils ont analysés suivaient le schéma de Braak [
28
]. Les travaux de Charles Adler et Thomas Beach, qui reposent sur l’analyse de centaines de cas autopsiés, proposent une progression temporelle et spatiale originale, différente de celle décrite par Braak [
29
]. En définitive, de nombreuses études fournissent des preuves importantes invalidant une progression caudo-rostrale uniforme et prévisible de l’anomalie de la synucléine dans le cerveau des personnes atteintes de la maladie de Parkinson.
Bien que validée
in vitro
,
in vivo
et en clinique, on peut se demander si l’hypothèse de Braak décrit avec précision le développement de la maladie de Parkinson chez tous les patients. Un élément important de cette réflexion est la faible corrélation que l’on observe entre la pathologie dite de Lewy et la perte neuronale, selon les données
post mortem
obtenues chez des patients à différents stades de la maladie de Parkinson [
30
]. Bien qu’il y ait un certain chevauchement des régions altérées entre pathologie de Lewy et perte neuronale (
Figure 2
), la gravité et les régions touchées au cours de l’évolution de la maladie supposent des processus de progression différents, indépendants des projections neuronales majeures des régions touchées. Ce fait suggère que la propagation de la pathologie de Lewy par les connexions neuronales est peu probable. On peut toutefois envisager que la perte de cellules puisse être un facteur de confusion. Il est bien établi que, à mesure que la maladie progresse, la perte neuronale est accrue. Une pathologie de Lewy est donc plus difficile à évaluer puisque intracellulaire.
|
Un mécanisme de diffusion de la maladie conceptuellement simple semble donc probable. L’hétérogénéité pathologique que l’on observe entre les différents cas de maladie de Parkinson suggère que l’hypothèse de Braak n’est pas la seule voie de propagation possible et que la pathologie peut même apparaître simultanément, et peut-être de manière stochastique, dans plusieurs régions du cerveau. Il n’en reste pas moins que la propagation de la synucléopathie existe, ou qu’elle est initiatrice, et qu’elle puisse être un marqueur important de la physiopathologie de la maladie de Parkinson. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Jellinger
KA
.
Recent advances in our understanding of neurodegeneration.
.
J Neural Transm (Vienna).
2009;
;
116
:
:1111.
–
1162
.
2.
Sakamoto
M
,
Uchihara
T
,
Hayashi
M
,
et al.
Heterogeneity of nigral and cortical Lewy bodies differentiated by amplified triple-labeling for alpha-synuclein, ubiquitin, and thiazin red.
.
Exp Neurol.
2002;
;
177
:
:88.
–
94
.
3.
Bourdenx
M
,
Koulakiotis
NS
,
Sanoudou
D
,
et al.
Protein aggregation and neurodegeneration in prototypical neurodegenerative diseases: Examples of amyloidopathies, tauopathies and synucleinopathies.
.
Prog Neurobiol.
2017;
;
155
:
:171.
–
193
.
4.
Bartels
T
,
Choi
JG
,
Selkoe
DJ
.
alpha-Synuclein occurs physiologically as a helically folded tetramer that resists aggregation.
.
Nature.
2011;
;
477
:
:107.
–
110
.
5.
Robustelli
P
,
Piana
S
,
Shaw
DE
.
Developing a molecular dynamics force field for both folded and disordered protein states.
.
Proc Natl Acad Sci U S A.
2018;
;
115
:
:E4758.
–
E4E66
.
6.
Schor
M
,
Mey
A
,
MacPhee
CE
.
Analytical methods for structural ensembles and dynamics of intrinsically disordered proteins.
.
Biophys Rev.
2016;
;
8
:
:429.
–
439
.
7.
Raskatov
JA
,
Teplow
DB
.
Using chirality to probe the conformational dynamics and assembly of intrinsically disordered amyloid proteins.
.
Sci Rep.
2017;
;
7
:
:12433.
.
8.
Buell
AK
,
Dobson
CM
,
Knowles
TP
.
The physical chemistry of the amyloid phenomenon: thermodynamics and kinetics of filamentous protein aggregation.
.
Essays Biochem.
2014;
;
56
:
:11.
–
39
.
9.
De Giorgi
F
,
Laferriere
F
,
Zinghirino
F
,
et al.
Novel self-replicating alpha-synuclein polymorphs that escape ThT monitoring can spontaneously emerge and acutely spread in neurons.
.
Sci Adv.
2020
;
:6.
.
10.
Peelaerts
W
,
Bousset
L
,
Van der Perren
A
,
et al.
alpha-Synuclein strains cause distinct synucleinopathies after local and systemic administration.
.
Nature.
2015;
;
522
:
:340.
–
344
.
11.
Dehay
B
,
Bourdenx
M
,
Gorry
P
,
et al.
Targeting alpha-synuclein for treatment of Parkinson’s disease: mechanistic and therapeutic considerations.
.
Lancet Neurol.
2015;
;
14
:
:855.
–
866
.
12.
Braak
H
,
Del Tredici
K
,
Rub
U
,
et al.
Staging of brain pathology related to sporadic Parkinson’s disease.
.
Neurobiol Aging.
2003;
;
24
:
:197.
–
211
.
13.
Goedert
M.
.
NEURODEGENERATION. Alzheimer’s and Parkinson’s diseases: The prion concept in relation to assembled Abeta, tau, and alpha-synuclein.
.
Science.
2015;
;
349
:
:1255555.
.
14.
Kordower
JH
,
Chu
Y
,
Hauser
RA
,
et al.
Lewy body-like pathology in long-term embryonic nigral transplants in Parkinson’s disease.
.
Nat Med.
2008;
;
14
:
:504.
–
506
.
15.
Li
JY
,
Englund
E
,
Holton
JL
,
et al.
Lewy bodies in grafted neurons in subjects with Parkinson’s disease suggest host-to-graft disease propagation.
.
Nat Med.
2008;
;
14
:
:501.
–
503
.
16.
Walsh
DM
,
Selkoe
DJ
.
A critical appraisal of the pathogenic protein spread hypothesis of neurodegeneration.
.
Nat Rev Neurosci.
2016;
;
17
:
:251.
–
260
.
17.
Lashuel
HA
,
Overk
CR
,
Oueslati
A
,
Masliah
E
.
The many faces of alpha-synuclein: from structure and toxicity to therapeutic target.
.
Nat Rev Neurosci.
2013;
;
14
:
:38.
–
48
.
18.
Luk
KC
,
Kehm
V
,
Carroll
J
,
et al.
Pathological alpha-synuclein transmission initiates Parkinson-like neurodegeneration in nontransgenic mice.
.
Science.
2012;
;
338
:
:949.
–
953
.
19.
Osterberg
VR
,
Spinelli
KJ
,
Weston
LJ
,
et al.
Progressive aggregation of alpha-synuclein and selective degeneration of lewy inclusion-bearing neurons in a mouse model of parkinsonism.
.
Cell Rep.
2015;
;
10
:
:1252.
–
1260
.
20.
Volpicelli-Daley
LA
,
Luk
KC
,
Patel
TP
,
et al.
Exogenous alpha-synuclein fibrils induce Lewy body pathology leading to synaptic dysfunction and neuron death.
.
Neuron.
2011;
;
72
:
:57.
–
71
.
21.
Mougenot
AL
,
Nicot
S
,
Bencsik
A
,
et al.
Prion-like acceleration of a synucleinopathy in a transgenic mouse model.
.
Neurobiol Aging.
2012;
;
33
:
:2225.
–
2228
.
22.
Arotcarena
ML
,
Dovero
S
,
Prigent
A
,
et al.
Bidirectional gut-to-brain and brain-to-gut propagation of synucleinopathy in non-human primates.
.
Brain.
2020;
;
143
:
:1462.
–
75
.
23.
Bourdenx
M
,
Nioche
A
,
Dovero
S
,
et al.
Identification of distinct pathological signatures induced by patient-derived alpha-synuclein structures in nonhuman primates.
.
Sci Adv.
2020;
;
6
:
:eaaz9165.
.
24.
Chu
Y
,
Muller
S
,
Tavares
A
,
et al.
Intrastriatal alpha-synuclein fibrils in monkeys: spreading, imaging and neuropathological changes.
.
Brain.
2019;
;
142
:
:3565.
–
3579
.
25.
Recasens
A
,
Dehay
B
,
Bove
J
,
et al.
Lewy body extracts from Parkinson disease brains trigger alpha-synuclein pathology and neurodegeneration in mice and monkeys.
.
Ann Neurol.
2014;
;
75
:
:351.
–
362
.
26.
Del Tredici
K
,
Rub
U
,
De Vos
RA
,
et al.
Where does parkinson disease pathology begin in the brain?
.
J Neuropathol Exp Neurol.
2002;
;
61
:
:413.
–
426
.
27.
Attems
J
,
Jellinger
KA
.
The dorsal motor nucleus of the vagus is not an obligatory trigger site of Parkinson’s disease.
.
Neuropathol Appl Neurobiol.
2008;
;
34
:
:466.
–
467
.
28.
Zaccai
J
,
Brayne
C
,
McKeith
I
,
et al.
Patterns and stages of alpha-synucleinopathy: Relevance in a population-based cohort.
.
Neurology.
2008;
;
70
:
:1042.
–
1048
.
29.
Adler
CH
,
Beach
TG
.
Neuropathological basis of nonmotor manifestations of Parkinson’s disease.
.
Mov Disord.
2016;
;
31
:
:1114.
–
1119
.
30.
Surmeier
DJ
,
Obeso
JA
,
Halliday
GM
.
Parkinson’s Disease Is Not Simply a Prion Disorder.
.
J Neurosci.
2017;
;
37
:
:9799.
–
9807
.
|