Les granulocytes basophiles sont des cellules sanguines peu nombreuses dont les granules fixent certains colorants basiques (comme le bleu de méthylène) et non pas acides (comme l’éosine). Ces propriétés ont permis à Paul Ehrlich de les identifier dans le sang humain en 1879 [ 1 ]. Des techniques de coloration similaires ont permis d’identifier des granulocytes basophiles circulants chez la plupart des vertébrés, et chez certains invertébrés, dont des arthropodes, des annélides, et des mollusques. Il semble ainsi qu’il s’agisse d’un type cellulaire ancestral, ayant émergé avant l’immunité adaptative conventionnelle et l’apparition des anticorps. Leur conservation au cours de l’évolution des espèces animales suggère que les granulocytes basophiles sont porteurs d’une fonction primordiale pour la survie. Cependant, la recherche sur ces cellules a été longtemps négligée du fait de leur rareté, puisqu’ils ne représentent qu’environ 0,5 % des leucocytes sanguins. On sait maintenant que les granulocytes basophiles ne sont pas seulement des cellules effectrices impliquées dans les allergies et les réponses antiparasitaires, mais qu’ils ont également des fonctions immunorégulatrices dans certaines maladies inflammatoires chroniques (atopie, auto-immunité) [ 2 ], ainsi qu’en conditions homéostatiques ou de résolution de l’inflammation [ 3 , 4 ]. Si les fonctions effectrices des granulocytes basophiles ont été attribuées à la libération de leur contenu granulaire préformé (histamine, protéases, etc.), leurs fonctions régulatrices ont été rattachées à leur capacité de synthétiser des cytokines de type 2, les interleukines (IL)-4 et IL-13 [ 2 ]. Ces cytokines favorisent des manifestations allergiques ou antiparasitaires, telles que l’hypersécrétion de mucus, la motilité intestinale, le prurit, la fibrose ou la bronchoconstriction. Elles sont également impliquées dans la résolution de l’inflammation et dans l’homéostasie tissulaire et métabolique [ 5 ]. L’IL-4 et l’IL-13 des mammifères sont issues de la duplication d’un gène ancestral, il4/il13 , qui aurait subi une forte divergence fonctionnelle. Ainsi, l’IL-4 a un effet « central » sur la maturation et la différenciation des lymphocytes T et B, alors que l’IL-13 est plus spécifiquement sécrétée dans les tissus au cours de l’inflammation de type 2 1, [ 5 ].
Les granulocytes basophiles sécrètent de grandes quantités de cytokines de type 2 après association des immunoglobulines E (IgE) à leur surface par un allergène ou un antigène parasitaire. Ils en sécrètent également après une activation par certaines molécules de l’immunité innée. Nous avons cherché à comprendre quels signaux innés étaient capables d’induire une activation des granulocytes basophiles, leur dégranulation ou leur production d’IL-4 ou d’IL-13, en utilisant un modèle murin permettant de visualiser la synthèse d’IL-4 et d’IL-13 par ces cellules [ 6 ]. Nous avons tout d’abord analysé ex vivo l’activation des granulocytes basophiles matures induite par 96 stimulus uniques sur des splénocytes totaux. Cela nous a permis de confirmer que certains signaux innés, dont l’IL-3 (une hématopoïétine), l’IL-18 et l’IL-33 (des alarmines), induisent la production d’IL-4 et d’IL-13 par ces granulocytes, ainsi que leur dégranulation. Une plus grande diversité de stimulus entraîne uniquement une production d’IL-4, dont des lymphopoïétines (IL-7, TSLP [ thymic stromal lymphopoietin ]), des eicosanoïdes (leucotriène B4, prostaglandine PGD2), ou d’autres médiateurs inflammatoires (fragment C5a du complément, adénosine). Un nombre restreint de stimulus innés homéostatiques (IL-10, TGF-β [ transforming growth factor beta ]) entraîne la production d’IL-13 sans induire de production d’IL-4. In vivo , nous n’avons jamais observé, lors d’une inflammation de la peau, de fortes productions d’IL-13 par les granulocytes basophiles, alors que ceux-ci produisaient de l’IL-4 durant plusieurs jours. Ainsi les granulocytes basophiles naïfs sécrètent plus fortement de l’IL-4 que de l’IL-13, et la production de ces deux interleukines fait intervenir des voies de signalisation distinctes.
L’IL-3 est connue pour activer, à des concentrations de l’ordre du pg/mL, la prolifération et la survie des granulocytes basophiles, ainsi que leur sécrétion de cytokines de type 2. Augmenter la dose d’IL-3 permet de saturer l’activation de ces cellules jusqu’à ce qu’environ 90 % produisent de l’IL-4, mais seulement 40 % produisent de l’IL-13. Les granulocytes basophiles matures répondent donc de manière hétérogène à un stimulus saturant. Ces résultats nous ont conduits à analyser l’hétérogénéité du phénotype de ces cellules de manière non biaisée en utilisant des méthodes de réduction de dimensionnalité 2 . Cette approche a révélé l’existence de six groupes de phénotypes distincts. Ainsi, après stimulation, certains granulocytes basophiles produisent de l’IL-4, d’autres de l’IL-13, d’autres encore les deux interleukines. Il en va de même pour d’autres marqueurs d’activation (CD200R ou orexin receptor 2 ) ou d’exocytose (CD63 ou lamp3, lysosome-associated membrane protein 3 ). Cette hétérogénéité suggère qu’il existe des granulocytes basophiles spécialisés dans différentes fonctions chez la souris, et vraisemblablement aussi dans l’espèce humaine [ 7 ]. Ainsi, la réactivité des granulocytes basophiles ne serait pas uniquement le résultat d’une imprégnation ou d’une réaction directe au milieu local, et pourrait être en partie prédéterminée pendant leur différenciation.
En faveur de cette hypothèse, il a été montré que la lymphopoïétine TSLP peut induire la différenciation de granulocytes basophiles à partir de la moelle osseuse au même titre que l’IL-3, ce qui altère leurs propriétés fonctionnelles : ces basophiles présentent un transcriptome associé avec le métabolisme lipidique et la communication intercellulaire, à une forte sécrétion de cytokines et de chimiokines, et à peu de dégranulation [ 8 ]. Or, on retrouve de fortes concentrations de TSLP dans certaines maladies atopiques ou infections parasitaires. In vivo , ces hématopoïétines pourraient agir de concert. Ainsi, une infection parasitaire murine par l’helminthe Heligmosomoides polygyrus entraîne une augmentation du nombre de granulocytes basophiles dans le sang dépendant de l’IL-3, mais également de TSLP. Les granulocytes basophiles de ces souris sécrètent plus d’IL-13 et dégranulent davantage, mais sécrètent moins d’IL-4 après activation par des alarmines, des cytokines, ou des eicosanoïdes. Ainsi, cette infection parasitaire induit à la fois une hypo-réactivité et une hyper-réactivité de ces cellules : elle altère profondément la réactivité des granulocytes basophiles matures circulants [ 6 ]. Les contributions respectives de l’IL-3 et de TSLP dans ce phénotype, lors de la différenciation hématopoïétique ou en tant que modulateurs de la fonction des cellules matures, restent à déterminer.
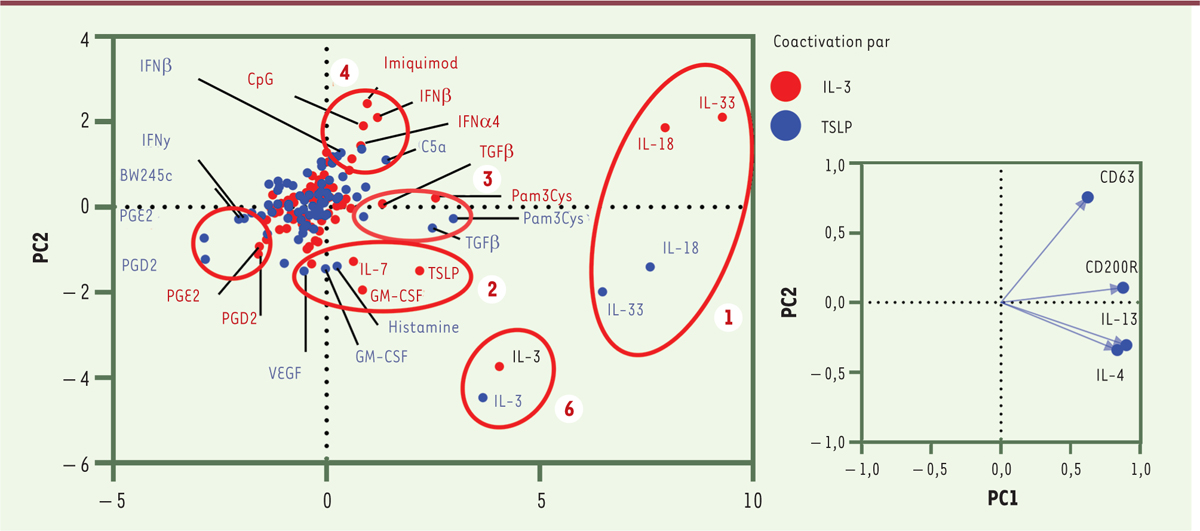
Nous avons tiré parti de l’augmentation du nombre de granulocytes basophiles dans le sang provoquée par ces infections parasitaires pour étudier in vitro la réactivité de ces cellules à 75 stimulus innés uniques, en présence d’IL-3 ou de TSLP en tant que facteurs de survie. Nous avons établi des profils de réactivité pour chaque stimulus et chaque facteur de survie selon le phénotype des cellules après stimulation, et groupé alors les profils similaires ( Figure 1 ) [ 6 ]. Ainsi, les granulocytes basophiles purifiés de souris infectées réagissent de manière similaire aux alarmines IL-18 et IL-33 (groupe 1), à certains facteurs de croissance (VEGF [ vascular endothelial growth factor ], GM-CSF [ granulocyte-macrophage colony-stimulating factor ], IL-7, TSLP) ou à l’histamine (groupe 2), au TGF-β et à un ligand des récepteurs TLR ( Toll-like receptor )1/2 (groupe 3), à des éléments de la réponse antivirale (IFN[interféron]-α4, IFN-β), aux oligonucléotides CpG (ligand du TLR9), à l’imiquimod (ligand du TLR7) ou à des fragments du complément (C5a) (groupe 4), ou encore aux eicosanoïdes (PGD2, PGE2), et à l’IFN-γ (groupe 5). L’IL-3 se démarque par un profil de réactivité des granulocytes basophiles qui lui est propre (groupe 6). Les ligands partageant tout ou partie de leurs récepteurs (IL-7 et TSLP, IFN-α4 et IFN-β) ou de leurs voies de signalisation (IL-18 et IL-33, PGD2 et PGE2) forment des « clusters » sur le profil de réactivité des granulocytes basophiles, ce qui valide cette analyse. Ainsi, ces cellules réagissent directement à des classes de stimulus innés inflammatoires très variées (alarmines, eicosanoïdes, éléments de la réponse antivirale), mais également à des stimulus homéostatiques associés au remodelage ou à la réparation tissulaire (VEGF, IL-7, TGF-β, IL-10). Cela renforce l’idée que la sécrétion d’IL-4 et d’IL-13 par le granulocyte basophile pourrait jouer un rôle important dans certains processus homéostatiques, une hypothèse étayée par plusieurs découvertes récentes : les granulocytes basophiles contrôlent le phénotype fonctionnel des macrophages alvéolaires pendant le développement pulmonaire [ 3 ], et ils favorisent la résolution de l’inflammation dans le foie et la peau [ 2 , 4 ], ainsi que la réparation du myocarde après un infarctus [ 9 ]. Toutes ces propriétés pro-homéostatiques ont été attribuées à leur sécrétion d’IL-4 ou d’IL-13.
| Figure 1.
Profil de réactivité des granulocytes basophiles.
Analyse des composants principaux (PC) régissant la variabilité du phénotype de granulocytes basophiles purifiés à partir des splénocytes de souris infectées par
H. polygyrus
, après activation
ex vivo
par 75 stimulus uniques. Les vecteurs représentent la contribution de chaque phénotype (IL-4, IL-13, CD200R, CD63) aux composants principaux PC1 et PC2. Les activations ont été réalisées en présence des facteurs de survie IL-3 ou TSLP. BW245c (agoniste de PTGDR1, un récepteur de la prostaglandine D2) ; CD
(cluster of differentiation
) ; CpG (dinucléotide agoniste de TLR-9) ; C5a (composant du complément) ; GM-CSF (
granulocyte-macrophage colony-stimulating factor
) ; IFN (interféron) ; IL (interleukine) ; Imiquimod (agoniste de TLR7) ; Pam3Cys (Pam3Cys-Ser-(Lys)4, agoniste de TLR1/2) ; PG (prostaglandine) ; TGF (
tumor growth factor
) ; TLR (
Toll-Like receptor
) ; TSLP (
thymic stromal lymphopoietin
) ; VEGF (
vascular endothelial growth factor
).
|
Les réponses de type 2 ont évolué non seulement pour contrôler les infections parasitaires, mais également pour contrôler la résolution de l’inflammation, la réparation tissulaire, et l’homéostasie métabolique [ 5 ]. Le contrôle de la sécrétion de cytokines de type 2 du basophile par des signaux innés semble ajuster finement certains processus homéostatiques primordiaux, tels que la réparation tissulaire ou la résolution de l’inflammation. L’exploration des mécanismes régulant la sécrétion des cytokines de type 2 par les granulocytes basophiles devrait permettre de mieux cerner leurs fonctions ancestrales, d’expliquer pourquoi les vertébrés conservent des granulocytes basophiles circulants, et d’ouvrir des perspectives thérapeutiques innovantes.