| |
| Med Sci (Paris). 37(8-9): 726–734. doi: 10.1051/medsci/2021108.Ferroptose et cancer Implications physiopathologiques et thérapeutiques Rudy Birsen,1* Eric Grignano,1 Nicolas Chapuis,1 and Didier Bouscary1 1Université de Paris, institut Cochin, CNRS UMR 8104, Inserm UMR 1016, Assistance publique-hôpitaux de Paris Centre, 27 rue du Faubourg Saint-Jacques, 75014Paris, France |
En 2014, E. Lachaier et al. avaient proposé dans médecine/sciences une Synthèse sur la ferroptose et le cancer [1] (→). (→) Voir la Synthèse de E. Lachaier et al., m/s n° 8-9, août-septembre 2014, page 779 Depuis, des recherches intenses ont précisé et complexifié les mécanismes mis en jeu dans ce processus, révélant de nouveaux acteurs essentiels. En parallèle, les études portant sur l’implication de cette voie de mort cellulaire en pathologie humaine se sont intensifiées. Dans cette revue, nous décrirons dans un premier temps les principaux acteurs cellulaires de la ferroptose, puis nous aborderons les données concernant ce processus, plus particulièrement dans les cellules cancéreuses. Tous les détails des voies cellulaires impliquées, telles que nous les comprenons actuellement, ne pouvant être décrits de manière exhaustive, notre présentation se limitera aux données que nous considérons les plus importantes pour la compréhension globale de ce processus, et à des exemples représentatifs dans le cancer. |
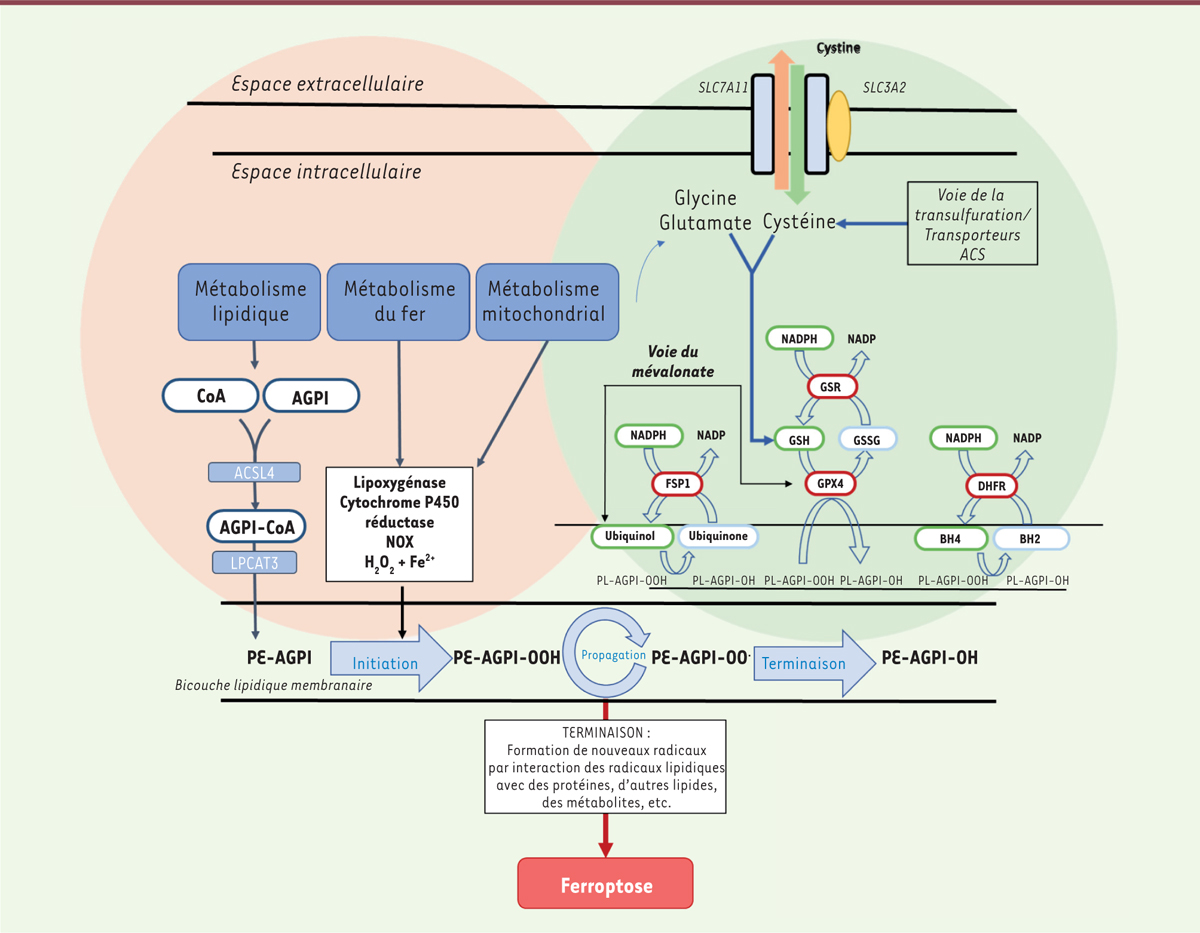
Les grands acteurs de la ferroptose ( Figure 1) La ferroptose résulte de l’accumulation incontrôlée de lipides peroxydés au niveau des membranes cellulaires [2]. La mort des cellules est provoquée par la formation de pores dans la membrane plasmique, entraînant un ballonnement puis la rupture de la membrane [3]. La vulnérabilité d’une cellule à l’induction de la ferroptose est déterminée par les facteurs conditionnant l’équilibre entre l’accumulation de lipides peroxydés et leur détoxification par un système antioxydant dédié.  | Figure 1. Résumé des voies intracellulaires impliquées dans la ferroptose. L’exécution de la ferroptose est déclenchée par une peroxydation excessive des acides gras polyinsaturés (AGPI) contenus dans les phopholipides membranaires (PL). Les molécules GSH et GPX4, BH4 et DHFR, ainsi que le CoQ10 et FSP1, contrôlent l’élimination des lipides peroxydés. Le système xc - permet l’entrée de cystine dans la cellule en échange de glutamate. Une fois dans la cellule, la cystine est rapidement réduite en cystéine, qui est l’acide aminé limitant pour la synthèse de GSH. L’inhibition de SLC7A11 (solute carrier family 7 member 11) entraîne une déplétion intracellulaire en cystéine, qui conduit à l’épuisement des stocks intracellulaires de GSH qui ne sont plus renouvelés. GPX4 est une sélénoprotéine qui utilise le GSH pour réduire les lipides peroxydés en leur alcool correspondant. L’inhibition de GPX4 entraîne une accumulation non contrôlée d’AGPI oxydés, conduisant à la mort cellulaire. ACSL4 : acyl-CoA synthetase long chain family member 4 ; AGPI : acides gras polyinsaturés ; ALOX : arachidonate lipoxygenase ; BH4 : tétrahydrobioptérine ; CoA : Coenzyme A ; DHFR : dihydrofolate réductase ; FSP1 : ferroptosis suppressor protein 1 ; GPX4 : glutathione peroxidase 4 ; LPCAT 3 : lysophosphatidylcholine acyltransferase 3 ; PL : phospholipide ; PE : phosphatidyléthanolamine. |
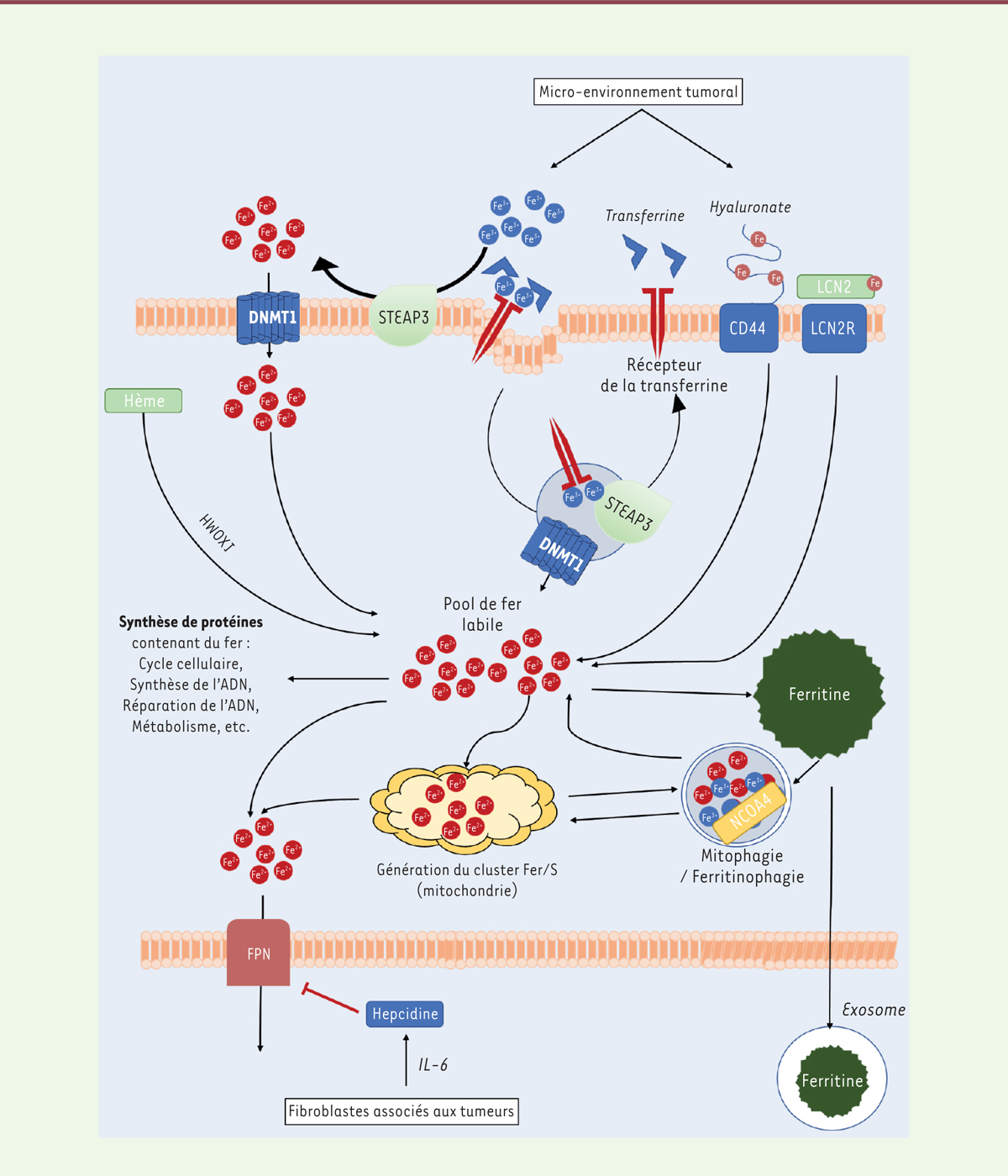
Les acides gras polyinsaturés Les acides gras polyinsaturés (AGPI) contenus dans les glycérophospholipides membranaires (en particulier les phosphatidyléthanolamines contenant de l’acide arachidonique ou de l’acide adrénique) sont les principales cibles de la peroxydation des lipides [ 4]. Plusieurs acteurs des voies de biosynthèse des lipides (AMPK [ AMP-activated protein kinase] [ 5], SCD1 [ stearoyl-CoA desaturase 1] [ 6]) et des glycérophospholipides ( lysophosholipide acyltransferase 3, acyl-CoA synthetase long chain family member 3 et 4 [ 7]), ainsi que de leur stockage (TPD52 [ tumor protein D52], et lipophagie [ 8]), modulent la sensibilité des cellules à la ferroptose en contrôlant la composition de leurs membranes en acides gras mono- et polyinsaturés. Le peroxysome s’est également imposé récemment comme un composant majeur de la susceptibilité cellulaire à la ferroptose, du fait de son rôle dans la formation des plasmalogènes, des éthers lipidiques ou étherlipides 1, dont certains contiennent des chaînes polyinsaturées pouvant être peroxydées [ 9]. La peroxydation lipidique L’étape d’initiation de la peroxydation des lipides résulte de l’élimination d’un atome d’hydrogène au niveau d’un AGPI membranaire (L), conduisant à la formation d’un lipide radical (L•) instable. Les acteurs impliqués dans cette étape demeurent controversés. On distingue généralement deux types de mécanismes : les mécanismes enzymatiques (avec notamment les lipoxygénases ou la cytochrome P450 réductase [POR] [ 10]) et les processus non enzymatiques (faisant intervenir le peroxyde d’hydrogène et le Fe 2+ libre de la cellule via la réaction de Fenton 2). La localisation intracellulaire de cette étape d’initiation reste à ce jour encore débattue. Quel que soit le mécanisme initiateur, les radicaux lipidiques (L•) formés sont capables de peroxyder les lipides adjacents par autoxydation (ou auto-oxydation). Ce processus de peroxydation en chaîne est appelé propagation. Le déclenchement des mécanismes antioxydants permet l’arrêt de cette réaction. En leur absence, les lipides peroxydés forment divers radicaux, qui réagissent avec d’autres lipides, des protéines et des métabolites. Ces derniers constituent les effecteurs terminaux de l’induction de la mort cellulaire par ferroptose. Le rôle du fer Le fer intervient à différents niveaux. Il s’agit d’abord d’un cofacteur essentiel aux lipoxygénases et à la POR. Il joue également un rôle central dans la réaction de Fenton comme catalyseur de la réaction d’oxydation du peroxyde d’hydrogène. Dans la cellule, c’est le pool de fer labile qui intervient dans ces processus. La Figure 2 résume les principaux déterminants de la formation et du maintien d’un pool de fer labile. 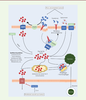 | Figure 2. Métabolisme du fer intracellulaire. Fe3+ se lie à la transferrine (Tf) pour former le complexe Fe3+-Tf, qui se lie au récepteur de la transferrine TfR1. L’ensemble est internalisé par endocytose. Dans l’endosome, l’acidification conduit à la libération du Fe3+ de la Tf, l’apo-Tf (la Tf dépourvue de fer) restant liée au TfR1. Le Fe3+ de l’endosome est réduit en Fe2+ par la ferriréductase STEAP3 (six-transmembrane epithelial antigen of the prostate 3) et transporté dans le cytoplasme par DMT1 (divalent metal transporter 1). Le complexe apoTf- TfR1 est recyclé à la membrane. Après son entrée dans le cytoplasme, le Fe2+ est conjugué avec des ligands du fer, formant le pool de fer labile cytosolique. Ce fer peut être stocké sous forme de ferritine, transféré à la mitochondrie, ou encore exporté de la cellule par la ferroportine 1. LCN2 : lipocaline 2 ; IL-6 : interleukine 6 ; FPN : ferroportine. |
Le système de détoxification des lipides peroxydés Le flux de production de lipides peroxydés est compensé par un système antioxydant afin d’empêcher leur accumulation qui est létale pour la cellule. La séléno-protéine GPX4 ( glucoperoxydase 4) est l’enzyme centrale de la détoxification des lipides peroxydés [ 11]. Pour fonctionner, GPX4 utilise le glutathion (GSH), dont la quantité est conditionnée par la disponibilité en cystéine intracellulaire. La majorité de cette cystéine résulte de l’échange entre la cystine (formée par deux monomères de cystéine) présente dans le milieu extracellulaire et le glutamate intracellulaire, par le système transporteur x c
- . Cet échangeur (ou contre-transporteur) est constitué de deux sous-unités reliées par un pont disulfure : SLC7A11 ( solute carrier family 7 member 11) et SLC3A2 ( solute carrier family 3 member 2). Les autres sources de cystéine sont limitées. Elles font intervenir la voie de la transulfuration et le transporteur alanine-cystéine-sérine. Deux voies de détoxification des lipides peroxydés indépendantes de GPX4 ont également été mises en évidence : les voies de biosynthèse et de réduction du coenzyme Q10 (CoQ 10)[ 12, 13]et de la tétrahydrobioptérine (BH4) [ 14]. L’ubiquinol, la forme réduite du CoQ 10, et la BH4 agissent au niveau des membranes comme des pièges à radicaux oxydants qui stoppent la peroxydation des lipides. L’une des principales sources intracellulaires de CoQ10 est la voie du mévalonate. La BH4 est, quant à elle, produite à partir du GTP (guanosine triphosphate) sous l’action de la GCH1 ( GTP cyclohydrolase 1). Deux réductases, FSP1 ( ferroptosis suppressor protein 1) et DHFR ( dihydrofolate reductase), permettent respectivement la reformation de l’ubiquinol (à partir d’ubiquinone) et de la BH4 (à partir de la BH2 [dihydrobioptérine]). Notons que le NADPH (nicotinamide adénine dinucléotide phosphate) est essentiel au bon fonctionnement des trois systèmes de détoxification des lipides. NRF2 NRF2 ( nuclear factor erythroid 2-related factor 2) est un facteur de transcription majeur modulant l’expression de gènes impliqués dans le système anti-oxydant. À l’état basal, c’est-à-dire en l’absence de stress oxydant, sa concentration dans la cellule est maintenue à un taux faible par son ubiquination et sa dégradation sous l’action d’un complexe E3-ubiquitine ligase. En cas de stress oxydant, l’inactivation du complexe E3-ubiquitine ligase favorise l’accumulation de NRF2 dans le cytoplasme et son activation par phosphorylation. NRF2 passe alors dans le noyau et déclenche la transcription de gènes impliqués dans le système anti-oxydant, en particulier les gènes responsables de la production de protéines participant à la détoxification des lipides [ 15]. Métabolisme et ferroptose Au-delà du métabolisme de la cystine, du fer et des lipides, plusieurs voies métaboliques participent au contrôle des voies de la ferroptose. Leurs implications sont complexes. Elles dépendent du type cellulaire, et ont parfois une action contradictoire. Ainsi, la glutaminolyse, à l’origine de la production de glutamate à partir de la glutamine, transformé ensuite en a-céto-glutarate dans la mitochondrie, est un élément déterminant de la susceptibilité cellulaire à la ferroptose induite par la déplétion en cystine. En effet, la mitochondrie, par le cycle de Krebs (qui est lui-même entretenu par la glutaminolyse) et la chaîne respiratoire, est la source de la formation des lipides peroxydés dans le contexte d’une déplétion en cystine [ 16]. Si, initialement, la ferroptose a été présentée comme un processus indépendant des autres voies de mort cellulaire régulées (apoptose, nécroptose, autophagie, etc.), la réalité est plus complexe. En effet, des voies autophagiques spécifiques, telles que la ferritinophagie (qui augmente le pool de fer labile [17]), la lipophagie (qui mobilise les AGPI contenus dans les gouttelettes lipidiques [8]) ou la « clockophagie » qui entraîne une dégradation sélective de l’ARNTL (aryl-hydrocarbon-receptor-nuclear-translocator-like), un facteur de transcription intervenant dans le cycle circadien [18], peuvent moduler la sensibilité cellulaire à la ferroptose. |
Ferroptose et cancer : implications physiopathologiques Le rôle de la ferroptose dans l’oncogenèse Une hypothèse du rôle de la ferroptose en physiologie conçoit ce mécanisme comme une protection antitumorale. En effet, l’effet suppresseur de tumeur de certains gènes pourrait reposer sur la capacité de leurs produits à sensibiliser les cellules à une induction de la ferroptose. L’impact de l’inactivation du gène supresseur de tumeur TP53 a ainsi été étudié. Au-delà de ses rôles traditionnels dans l’apoptose, la protéine p53 peut participer à l’induction de la ferroptose en réprimant l’expression de SLC7A11, l’un des partenaires du système transporteur x c
- [ 19]. La forme mutée de p53, qui s’accumule dans certains cancers, séquestre également NRF2, empêchant son activité transcriptionnelle [ 20]. La répression de l’expression de SLC7A11, qui inhibe la lipoxygénase 12 (ALOX12, arachidonate 12-lipoxygenase) par contact direct, favorise la libération de cette lipoxygénase, permettant la production de lipides peroxydés [ 21]. p53 cible également le gène SAT1 (spermidine/spermine N1-acetyltransferase 1), qui contrôle la transcription du gène codant l’ALOX15, qui participe à la peroxydation lipidique [ 22]. Le rôle de p53 reste néanmoins ambigu puisque cette protéine peut également protéger certaines cellules contre l’induction de la ferroptose. Dans une étude menée sur des cellules de lignées de cancer colique, il a en effet été montré que p53 maintenait DPP4 (dipeptidyl peptidase-4) dans le noyau des cellules, empêchant son accumulation au niveau de la membrane cellulaire et son interaction avec NOX1 (NADPH oxidase 1), une enzyme qui, lorsqu’elle est recrutée à la membrane, est capable de déclencher la peroxydation des lipides membranaires [23]. En aval de p53, l’activation de CDKN1A (cyclin-dependent kinase inhibitor 1) ralentit la perte de GSH (la forme réduite du glutathion) induite par l’inhibition pharmacologique du système xc
- par l’érastine3 [24]. D’autres gènes suppresseurs de tumeurs peuvent également contrôler les voies de la ferroptose. BAP1 (BRCA1 breast cancer 1-associated protein 1), un gène fréquemment inactivé dans les cancers du rein, les mélanomes et les cholangiocarcinomes, code une enzyme qui réduit l’ubiquitination de l’histone H2A. Mais, comme p53, BAP1 réprime aussi la transcription de SLC7A11, ce qui sensibilise les cellules à l’induction de la ferroptose. Ce processus pourrait d’ailleurs constituer l’un des mécanismes de protection antitumorale de BAP1 [25]. Contrairement au rôle anti-oncogène de la ferroptose suggéré par ces études, l’émergence des tumeurs et la progression tumorale pourraient être favorisées par la nécroinflammation du micro-environnement tumoral, secondaire à la mort cellulaire par ferroptose. La nécroinflammation se réfère au processus de mort cellulaire déclenché par la nécrose. Celle-ci conduit à la libération par la cellule de signaux de danger (ou DAMP, damage-associated molecular pattern) qui stimulent et amplifient la réaction inflammatoire et la réponse immunitaire. L’étude du rôle de ce processus dans la ferroptose ne fait que commencer, mais il a été montré, essentiellement dans le cerveau et dans le rein, que l’induction de ferroptose dans certaines conditions pathologiques non tumorales était à l’origine d’une réaction inflammatoire contribuant aux dommages tissulaires observés [26, 27]. Dans un modèle murin de cancer du pancréas, utilisant des souris dont le gène KRAS a été muté (KRASG12D)4, il a été ainsi observé que la mort des cellules tumorales par ferroptose libérait des exosomes (des vésicules provenant des cellules), contenant la protéine KRASG12D. Ces exosomes chargés de la protéine mutée induisent la polarisation des macrophages associés aux tumeurs vers le type M2, anti-inflammatoire et favorisant la progression tumorale [28]. De même, la délétion du gène GPX4 chez la souris, ou un régime riche en fer, sont à l’origine de la mort des cellules acinaires du pancréas par ferroptose. Celle-ci s’accompagne de la libération de nucléobases oxydées, comme la 8-hydroxy-20-déoxy-guanosine (8-oHdG), qui favorisent l’infiltration et la polarisation des macrophages, accélérant l’émergence (avec le recrutement de macrophages de type M1, inflammatoires) puis la progression (polarisation des macrophages en type M2) d’un cancer du pancréas ayant pour origine la mutation du gène KRAS [29]. Ferroptose et micro-environnement tumoral Les observations récentes d’une propagation en vagues du processus de ferroptose révèlent l’importance qu’il y a d’analyser la signification de ce mécanisme et son rôle biologique dans un contexte cellulaire complexe, pluricellulaire. Alors que les premières études s’étaient cantonnées à l’échelle cellulaire, l’impact que peuvent avoir les interactions entre les cellules qui composent un organe ou le micro-environnement tumoral, rend cette voie de mort dans le cancer beaucoup plus complexe à comprendre. Le rôle du contact intercellulaire Plusieurs études ont montré l’importance du contact intercellulaire dans l’inhibition du mécanisme de ferroptose. Dans un modèle de mésothéliome, il a ainsi été montré que les interactions entre cellules reposant sur les E-cadhérines, des protéines impliquées dans les jonctions d’adhérence intercellulaire, suppriment la ferroptose en activant la voie de signalisation impliquant NF2 ( neurofibromin 2) et Hippo/YAP ( Yes-associated protein). Ces interactions inhibent le facteur régulateur de YAP, qui peut promouvoir la ferroptose en induisant l’expression des gènes ACSL4 ( acyl-CoA synthetase long chain family member 4) et TFRC ( transferrin receptor) [ 30]. Les cellules de cancer rénal cultivées à de faibles densités activent TAZ ( tafazzin), un autre facteur régulateur de la voie Hippo, qui sensibilise les cellules à la ferroptose par l’activation de NOX4 ( NADPH oxidase 4) [ 31]. Ferroptose et immunité anti-cancéreuse Les lymphocytes T CD8 + peuvent être activés par une immunothérapie anticancéreuse ; ils sont alors capables d’induire une peroxydation des lipides dans les cellules tumorales [ 32]. Néanmoins, les mécanismes par lesquels ces cellules participent à la peroxydation des lipides restent à définir. L’interféron g, que ces lymphocytes sécrètent quand ils sont stimulés, diminuerait l’expression du système transporteur x c
- par les cellules ciblées : une partie de l’action antitumorale des lymphocytes T CD8 + serait due à ce mécanisme. Ferroptose et métastases Ubellacker et al. ont récemment élucidé un mécanisme physiopathologique au cours du mélanome : les cellules cancéreuses produisent des métastases qui se localisent d’abord dans les ganglions lymphatiques loco-régionaux avant de se disséminer dans l’organisme [ 33]. Dans les ganglions, les cellules cancéreuses présentent une diminution du pool de fer libre ainsi qu’une augmentation de GSH et du contenu membranaire en acide oléique (un acide gras monoinsaturé). Cette combinaison rend les cellules résistantes à l’induction de la ferroptose à laquelle elles pourraient être exposées dans la circulation sanguine. Elle augmente ainsi la capacité de ces cellules devenues résistantes à engendrer des métastases. |
Ferroptose et cancer : implications thérapeutiques Au-delà de ces considérations physiopathologiques, l’induction de la ferroptose apparaît comme une stratégie thérapeutique innovante pour le traitement des cancers. L’identification de marqueurs de vulnérabilité des cellules tumorales à ce processus, le développement de méthodes d’étude in vivo et la synthèse d’inducteurs de ferroptose utilisables chez l’homme sont ainsi l’objet d’intenses recherches. Vulnérabilité de la cellule tumorale à la ferroptose Altérations des voies oncogéniques La description initiale de la ferroptose reposait sur une analyse identifiant l’érastine et le RSL3 ( RAS-selective lethal 3), un inhibiteur de GPX4, comme des composés ciblant de manière élective des fibroblastes dérivés en lignées cancéreuses par mutation du gène RAS [ 2]. Cependant, les études réalisées sur diverses lignées cellulaires n’ont pas révélé de corrélation entre le statut mutationnel de RAS et la sensibilité à l’érastine. Il est donc apparu que des déterminants autres que ce simple statut mutationnel étaient impliqués [ 11]. Une étude portant sur le cancer du poumon présentant une mutation du gène EGFR ( epidermal growth factor receptor) a ainsi montré que la sensibilité à la déplétion en cystine était corrélée à l’activation de la voie des MAP kinases ( mitogen-activated protein kinases ou MAPK), en aval de RAS muté, mais aussi à la présence de plusieurs autres mutations activatrices [ 34]. D’autres voies oncogéniques modulent la sensibilité des cellules à la ferroptose. Ainsi, une des isoformes de p63 (un membre de la famille de p53) 5, DNp63, fréquemment amplifiée dans certains cancers, régule positivement le métabolisme du GSH [ 35]. L’accumulation de NRF2, par mutation activatrice de KEAP1 ( kelch-like ECH-associated protein 1), ou par activation transcriptionnelle due à diverses voies oncogéniques (RAS, c-myc, etc.), permet également la transcription de la plupart des acteurs du système de détoxification des lipides [ 15]. L’amplification du gène codant NFS1 ( cysteine desulfurase), une enzyme déterminante de la synthèse des centres fer-souffre, est fréquemment retrouvée dans les adénocarcinomes pulmonaires. Elle protège les cellules tumorales contre le stress oxydant qu’elles rencontrent dans des conditions riches en oxygène. Son inhibition déclenche la réponse de déprivation au fer (augmentant le pool de fer labile) et agit en synergie avec l’inhibition des voies de la cystine pour déclencher la ferroptose [ 36]. L’amplification du gène codant HIF-2a ( hypoxia-inducible factor 2a), facteur de forte dépendance oncogénique dans les cancers à cellules claires rénaux et ovariens, augmente la transcription de HILPDA ( hypoxia-inducible lipid droplet-associated protein). HILPDA modifie profondément le lipidome cellulaire en augmentant la quantité d’AGPI, rendant ces cellules hautement dépendantes de GPX4 pour leur survie [ 37]. À l’inverse, certaines cellules cancéreuses mettent en place des mécanismes limitant la quantité d’AGPI. La protéine SCD1 contrôle la désaturation des acides gras saturés, acides stéarique et palmitique, en acides oléique et palmitoléique. Son augmentation dans certains cancers favorise la présence d’acides gras mono-insaturés, moins susceptibles à l’induction de la ferroptose. Dans un modèle de cancer de l’ovaire, l’inhibition de SCD1 majore le contenu membranaire en AGPI et rend les cellules particulièrement sensibles à l’induction de la ferroptose [ 6]. La mutation inactivatrice du gène VHL ( von Hippel-Lindau), fréquemment retrouvée dans les cancers rénaux à cellules claires, conduit à la stabilisation des facteurs d’hypoxie HIF-1a et HIF-2a, modifiant le métabolisme oxydant de la cellule. Les cellules deviennent alors fortement dépendantes de la quantité de GSH intracellulaire. Les déterminants de cette dépendance accrue ne sont pas clairement établis, mais ils pourraient reposer sur une diminution du métabolisme des acides gras provoquée par l’inhibition de la b-oxydation et du métabolisme oxydant [ 38]. La perte de la protéine Rb ( retinoblastoma), un acteur majeur du contrôle de la prolifération et du cycle cellulaire, accroît la sensibilité à l’induction de ferroptose par le sorafénib, un inhibiteur de kinases, dans un modèle de cancer hépatocellulaire [ 39]. Ferroptose et cellules résistantes ou persistantes après traitements conventionnels Un des déterminants de la résistance des cellules tumorales aux traitements conventionnels est leur plasticité, notamment au travers d’un mécanisme appelé transition épithélio-mésenchymateuse. La caractérisation moléculaire de cellules et d’organoïdes dans l’état « mésenchymateux » a montré que leur métabolisme lipidique était augmenté par l’expression du facteur de transcription ZEB1 ( Zinc finger E-box-binding homeobox 1), qui entraîne une synthèse accrue d’AGPI et une forte dépendance à GPX4 pour leur survie [ 40]. Dans le cas du mélanome présentant une mutation du gène BRAF, certains des sous-clones cellulaires tumoraux sont capables de se dédifférencier. La conséquence en est un échappement au traitement par le vémurafénib, qui cible le mutant BRAF. Cependant, ces cellules de mélanomes dédifférenciées acquièrent une dépendance à GPX4 [ 41]. L’association entre le traitement ciblé et un inducteur de ferroptose peut ainsi diminuer de façon importante l’échappement thérapeutique de ces cellules. Dans le cancer de la prostate, la tolérance au traitement ciblant le récepteur des androgènes est à l’origine de modifications métaboliques profondes de la cellule tumorale, avec notamment un accroissement de la biomasse lipidique et du contenu membranaire en AGPI [ 42]. Ce processus a été également mis en évidence dans les cellules cancéreuses de différents types tumoraux exposées à des traitements cytotoxiques mais persistantes [ 43]. Dépendance des cellules tumorales au fer Le fer est essentiel à la prolifération cellulaire, au contrôle du cycle cellulaire, et au fonctionnement de la plupart des complexes de réparation et de réplication de l’ADN, autant de fonctions essentielles à la survie d’une cellule tumorale. Dans plusieurs modèles (de cancers du sein, de l’ovaire, de la prostate, ou de glioblastome), une augmentation de la dépendance au fer des cellules cancéreuses et des cellules souches cancéreuses a été observée [ 44]. Les voies métaboliques du fer, présentées dans la Figure 2, sont fréquemment modulées pour maintenir le fer dans la cellule tumorale. Par exemple, dans les cellules initiatrices du cancer de l’ovaire, l’efflux de fer par la ferroportine est diminué, tandis que son entrée par le récepteur de la transferrine (TfR codé par le gène TFRC) est augmentée [ 45]. L’import de fer par le TfR et son stockage sous forme de ferritine sont indispensables au fonctionnement et à la propagation des cellules souches du glioblastome [ 46] et du cancer du sein [ 47]. Compte tenu de l’augmentation de leurs réserves en fer, ces cellules sont donc plus susceptibles à une induction de ferroptose qui peut être déclenchée soit par l’augmentation du pool de fer libre, soit par l’utilisation de composés inducteurs de ferroptose. L’évaluation de la ferroptose in vivo
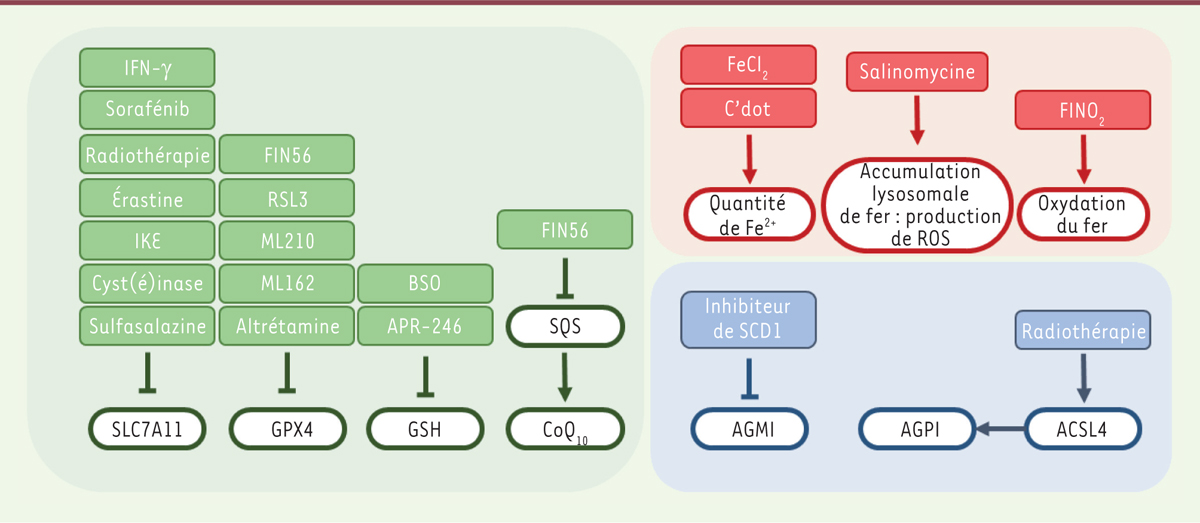
In vitro, l’étude de la ferroptose est fondée sur une association de caractéristiques fonctionnelles (inhibition de la mort cellulaire par les inhibiteurs de ferroptose, absence de protection par les inhibiteurs d’apoptose, absence de clivage des caspases) et d’imagerie (accumulation de lipides peroxydés observée en cytométrie de flux ou par immunofluorescence, modifications mitochondriales révélées en microscopie électronique) qui permettent d’affirmer avec une bonne fiabilité, une induction de la ferroptose. In vivo, l’étude de la ferroptose était limitée jusqu’alors par le manque de marqueurs validés et l’absence de caractérisation histopathologique. Des études récentes ont néanmoins révélé qu’il était possible d’utiliser plusieurs outils [ 32, 48, 49] : l’analyse des modifications transcriptionnelles (ciblées sur CHAC1 [ ChaC glutathione-specific gamma-glutamylcyclotransferase 1] ou sur PTGS2 [ prostaglandin-endoperoxide synthase 2], ou analyse d’enrichissement sur transcriptome) ; l’analyse des modifications morphologiques (mégamitochondries, accumulation de gouttelettes lipidiques) ; la cytométrie de flux (évaluation de l’accumulation de lipides peroxydés par le marquage par le C11-Bodipy ; mesure de l’expression du TFRC) ; les analyses immunohistochimiques et par immunofluorescence (accumulation de marqueurs de stress lipo-oxydant, tels que le malondialdéhyde [MDA], le 8-oHdG ou le 4-hydroxy-2-nonénal [4-HNE] ; absence de clivage des caspases ; accumulation de la cyclo-oxygénase 2 [COX2]). Les inducteurs de ferroptose (Figure 3) Plusieurs molécules sont aujourd’hui utilisées dans les études in vitro de la ferroptose. L’érastine est ainsi utilisée comme inhibiteur du système x c-. RSL3, ML162, ML210 sont des inhibiteurs covalents pharmacologiques de GPX4. De même, le FIN56 inhibe la squalène synthase (voie du mévalonate) et le FINO 2 promeut une oxydation directe du fer. 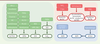 | Figure 3. Principaux inducteurs de la ferroptose et leurs cibles. Les inducteurs de la ferroptose sont représentés par couleurs et classés selon les cibles qu’ils inhibent ou activent. Les différentes couleurs correspondent aux grandes voies de la ferroptose ciblées. Vert : système antioxydant ; rouge : métabolisme du fer ; bleu : métabolisme lipidique. ACSL4 : acyl-CoA synthetase long chain family member 4 ; AGMI : acides gras mono-insaturés ; AGPI : acides gras poly-insaturés ; BSO : buthionine sulfoximine ; IFN-g : interféron gamma ; SQS : squalene synthase. |
Cependant, les propriétés pharmacocinétiques de ces composés limitent leur utilisation in vivo. Un analogue de l’érastine (IKE, imidazole ketone erastine) agissant à des concentrations de l’ordre du nanomolaire, métaboliquement plus stable que l’érastine, a permis le développement des premiers modèles d’étude de la ferroptose in vivo [48]. La cyst(é)inase, un composé en cours de développement clinique, qui dégrade la cystine contenue dans le milieu extracellulaire, est capable d’induire une régression tumorale dans un modèle murin de cancer du pancréas [49]. Plusieurs traitements actuellement utilisés chez l’homme pourraient avoir tout ou partie de leur efficacité liée à leur capacité d’induire la ferroptose. La sulfasalazine (un traitement historique de la polyarthrite rhumatoïde) inhibe le système xc
-. Le sorafénib, un inhibiteur multi-kinase, induit la ferroptose dans certaines cellules cancéreuses en agissant sur SLC7A11 [50]. L’APR-246 (présenté comme un réactivateur des formes mutantes de p53) est dégradé dans la cellule en un composé présentant des propriétés d’« accepteur de Michael »6 capable d’entraîner une déplétion en GSH et une ferroptose précoce [51]. La BSO (buthionine sulfoximine) inhibe la glutamate-cystéine ligase, indispensable à la synthèse du GSH. L’altrétamine, un traitement anticancéreux utilisé dans les cancers de l’ovaire et du poumon, serait capable de dégrader la GPX4 et d’induire de la ferroptose [52]. Les inhibiteurs de SCD1 augmentent le contenu membranaire en AGPI [6]. Les C’dots (carbon quantum dots), des nanoparticules en développement pour l’imagerie médicale, augmentent l’import de fer intracellulaire [53]. La salinomycine entraîne une séquestration et une accumulation du fer dans les lysosomes. La déplétion en fer cytoplasmique qui en résulte active une dégradation lysosomale de la ferritine, qui aggrave alors la surcharge en fer labile dans le lysosome, avec, pour conséquence, une accumulation de ROS perméabilisant la membrane des lysosomes et déclenchant une mort cellulaire par ferroptose [47]. Les radiations ionisantes entraînent une accumulation d’espèces réactives de l’oxygène, une diminution de SLC7A11 et une augmentation d’ACSL4 (acyl-CoA synthetase long chain family member 4) [54]. Enfin, l’induction de la ferroptose dans les cellules non tumorales pourrait constituer un mécanisme, encore peu exploré, expliquant les effets indésirables de certains traitements actuellement utilisés, à l’image de ce qui a été montré pour la doxorubicine, dont une partie de la toxicité sur les cardiomyocytes est imputable à une induction de ferroptose dépendante de la mitochondrie [55]. |
L’identification des nouveaux acteurs et des mécanismes mis en jeu dans le processus de ferroptose se poursuit. Le développement de nouveaux composés laisse envisager l’utilisation prochaine de thérapies dédiées, en particulier dans certains cancers résistant aux traitements actuels. Dans cette perspective, l’identification des facteurs de susceptibilité mutationnels, micro-environnementaux et tissulaires des cellules cancéreuses à cette voie de mort est essentielle. Compte tenu de la susceptibilité particulière de certains organes à l’induction de la ferroptose (rein et système nerveux central), la tolérance à ces futurs traitements sera un élément déterminant de leur faisabilité. Enfin, les études récentes visant à intégrer les mécanismes de la ferroptose au sein des interactions tissulaires ou de celles du micro-environnement tumoral approfondissent notre compréhension de ce processus et en complexifient notre perception, ouvrant de nouvelles perspectives sur sa place dans la physiopathologie du cancer. En raison du dynamisme de ce champ d’étude et des espoirs thérapeutiques qu’il suscite, les années à venir laissent présager de nouvelles découvertes passionnantes, qui répondront à certaines interrogations actuelles, mais qui poseront également de nouvelles questions. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
Footnotes |
1. LachaierE, LouandreC, EzzoukhryZ, et al. La ferroptose, une nouvelle forme de mort cellulaire applicable au traitement médical des cancers . Med Sci (Paris). 2014; ; 30 : :779.–783. 2. DixonSJ, LembergKM, LamprechtMR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death . Cell. 2012; ; 149 : :1060.–1072. 3. Riegman M, Sagie L, Galed C, et al. Ferroptosis occurs through an osmotic mechanism and propagates independently of cell rupture . Nat Cell Biol. 2020;; 22 : :1042.–8. 4. KaganVE, MaoG, QuF, et al. Oxi-dized arachidonic and adrenic PEs navigate cells to ferroptosis . Nat Chem Biol. 2017; ; 13 : :81.–90. 5. Lee H, Zandkarimi F, Zhang Y, et al. Energy-stress-mediated AMPK activation inhibits ferroptosis . Nat Cell Biol. 2020;; 22 : :225.–34. 6. TesfayL, PaulBT, KonstorumA, et al. Stearoyl-CoA desaturase 1 protects ovarian cancer cells from ferroptotic cell death . Cancer Res. 2019; ; 79 : :5355.–5366. 7. DollS, PronethB, TyurinaYY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition . Nat Chem Biol. 2017; ; 13 : :91.–98. 8. BaiY, MengL, HanL, et al. Lipid storage and lipophagy regulates ferroptosis . Biochem Biophys Res Commun. 2019; ; 508 : :997.–1003. 9. Zou Y, Henry WS, Ricq EL, et al. Plasticity of ether lipids promotes ferroptosis susceptibility and evasion . Nature. 2020;; 585 : :603.–8. 10. Zou Y, Li H, Graham ET, et al. Cytochrome P450 oxidoreductase contributes to phospholipid peroxidation in ferroptosis . Nat Chem Biol. 2020;; 16 : :302.–9. 11. YangWS, SriRamaratnamR, WelschME, et al. Regulation of ferroptotic cancer cell death by GPX4 . Cell. 2014; ; 156 : :317.–331. 12. BersukerK, HendricksJM, LiZ, et al. The CoQ oxidoreductase FSP1 acts parallel to GPX4 to inhibit ferroptosis . Nature. 2019; ; 575 : :688.–692. 13. DollS, FreitasFP, ShahR, et al. FSP1 is a glutathione-independent ferroptosis suppressor . Nature. 2019; ; 575 : :693.–698. 14. Soula M, Weber RA, Zilka O, et al. Metabolic determinants of cancer cell sensitivity to canonical ferroptosis inducers . Nat Chem Biol. 2020;; 16 : :1351.–60. 15. SunX, OuZ, ChenR, et al. Activation of the p62-Keap1-NRF2 pathway protects against ferroptosis in hepatocellular carcinoma cells . Hepatology. 2016; ; 63 : :173.–184. 16. GaoM, YiJ, ZhuJ, et al. Role of Mitochondria in Ferroptosis . Mol Cell. 2019; ; 73 : (354–363):e3.. 17. HouW, XieY, SongX, et al. Autophagy promotes ferroptosis by degradation of ferritin . Autophagy. 2016; ; 12 : :1425.–1428. 18. Yang M, Chen P, Liu J, et al. Clockophagy is a novel selective autophagy process favoring ferroptosis . Sci Adv. 2019;; 5 : :eaaw2238.. 19. JiangL, KonN, LiT, et al. Ferroptosis as a p53-mediated activity during tumour suppression . Nature. 2015; ; 520 : :57.–62. 20. LiuDS, DuongCP, HauptS, et al. Inhibiting the system xC-/glutathione axis selectively targets cancers with mutant-p53 accumulation . Nat Commun. 2017; ; 8 : :14844.. 21. ChuB, KonN, ChenD, et al. ALOX12 is required for p53-mediated tumour suppression through a distinct ferroptosis pathway . Nat Cell Biol. 2019; ; 21 : :579.–591. 22. OuY, WangSJ, LiD, et al. Activation of SAT1 engages polyamine metabolism with p53-mediated ferroptotic responses . Proc Natl Acad Sci USA. 2016; ; 113 : :E6806.–E6812. 23. XieY, ZhuS, SongX, et al. The tumor suppressor p53 limits ferroptosis by blocking DPP4 activity . Cell Rep. 2017; ; 20 : :1692.–1704. 24. TarangeloA, MagtanongL, Bieging-RolettKT, et al. p53 suppresses metabolic stress-induced ferroptosis in cancer cells . Cell Rep. 2018; ; 22 : :569.–575. 25. ZhangY, ShiJ, LiuX, et al. BAP1 links metabolic regulation of ferroptosis to tumour suppression . Nat Cell Biol. 2018; ; 20 : :1181.–1192. 26. Friedmann AngeliJP, SchneiderM, PronethB, et al. Inactivation of the ferroptosis regulator Gpx4 triggers acute renal failure in mice . Nat Cell Biol. 2014; ; 16 : :1180.–1191. 27. SeilerA, SchneiderM, FörsterH, et al. Glutathione peroxidase 4 senses and translates oxidative stress into 12/15-lipoxygenase dependent- and AIF-mediated cell death . Cell Metab. 2008; ; 8 : :237.–248. 28. Dai E, Han L, Liu J, et al. Autophagy-dependent ferroptosis drives tumor-associated macrophage polarization via release and uptake of oncogenic KRAS protein . Autophagy. 2020;; 16 : :2069.–83. 29. Dai E, Han L, Liu J, et al. Ferroptotic damage promotes pancreatic tumorigenesis through a TMEM173/STING-dependent DNA sensor pathway . Nat Commun. 2020;; 11 : :6339.. 30. WuJ, MinikesAM, GaoM, et al. Intercellular interaction dictates cancer cell ferroptosis via NF2-YAP signalling . Nature. 2019; ; 572 : :402.–406. 31. YangWH, DingCKC, SunT, et al. The hippo pathway effector taz regulates ferroptosis in renal cell carcinoma . Cell Rep. 2019; ; 28 : (2501–8):e4.. 32. WangW, GreenM, ChoiJE, et al. CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy . Nature. 2019; ; 569 : :270.–274. 33. Ubellacker JM, Tasdogan A, Ramesh V, et al. Lymph protects metastasizing melanoma cells from ferroptosis . Nature. 2020;; 585 : :113.–8. 34. PoursaitidisI, WangX, CrightonT, et al. Oncogene-selective sensitivity to synchronous cell death following modulation of the amino acid nutrient cystine . Cell Rep. 2017; ; 18 : :2547.–2556. 35. WangGX, TuHC, DongY, et al. ΔNp63 inhibits oxidative stress-induced cell death including ferroptosis and cooperates with the BCL-2 family to promote clonogenic survival . Cell Rep. 2017; ; 21 : :2926.–2939. 36. AlvarezSW, SviderskiyVO, TerziEM, et al. NFS1 undergoes positive selection in lung tumours and protects cells from ferroptosis . Nature. 2017; ; 551 : :639.–643. 37. ZouY, PalteMJ, DeikAA, et al. A GPX4-dependent cancer cell state underlies the clear-cell morphology and confers sensitivity to ferroptosis . Nat Commun. 2019; ; 10 : :1617.. 38. MiessH, DankworthB, GouwAM, et al. The glutathione redox system is essential to prevent ferroptosis caused by impaired lipid metabolism in clear cell renal cell carcinoma . Oncogene. 2018; ; 37 : :5435.–5450. 39. LouandreC, MarcqI, BouhlalH, et al. The retinoblastoma (Rb) protein regulates ferroptosis induced by sorafenib in human hepatocellular carcinoma cells . Cancer Lett. 2015; ; 356 : :971.–977. 40. ViswanathanVS, RyanMJ, DhruvHD, et al. Dependency of a therapy-resistant state of cancer cells on a lipid peroxidase pathway . Nature. 2017; ; 547 : :453.–457. 41. TsoiJ, RobertL, ParaisoK, et al. Multi-stage Differentiation defines melanoma subtypes with differential vulnerability to drug-induced iron-dependent oxidative stress . Cancer Cell. 2018; ; 33 : (890–904):e5.. 42. Tousignant KD, Rockstroh A, Poad BLJ, et al. Therapy-induced lipid uptake and remodeling underpin ferroptosis hypersensitivity in prostate cancer . Cancer Metab. 2020;; 8 : :11.. 43. HangauerMJ, ViswanathanVS, RyanMJ, et al. Drug-tolerant persister cancer cells are vulnerable to GPX4 inhibition . Nature. 2017; ; 551 : :247.–250. 44. Torti SV, Torti FM. Iron and cancer: 2020 vision . Cancer Res . 2020;; 80 : :5435.–48. 45. BasuliD, TesfayL, DengZ, et al. Iron addiction: a novel therapeutic target in ovarian cancer . Oncogene. 2017; ; 36 : :4089.–4099. 46. SchonbergDL, MillerTE, WuQ, et al. Preferential iron trafficking characterizes glioblastoma stem-like cells . Cancer Cell. 2015; ; 28 : :441.–455. 47. MaiTT, HamaïA, HienzschA, et al. Salinomycin kills cancer stem cells by sequestering iron in lysosomes . Nat Chem. 2017; ; 9 : :1025.–1033. 48. ZhangY, TanH, DanielsJD, et al. Imidazole ketone erastin induces ferroptosis and slows tumor growth in a mouse lymphoma model . Cell Chem Biol. 2019; ; 26 : (623–33):e9.. 49. Badgley MA, Kremer DM, Maurer HC, et al. Cysteine depletion induces pancreatic tumor ferroptosis in mice . Science. 2020;; 368 : :85.–9. 50. LachaierE, LouandreC, GodinC, et al. Sorafenib induces ferroptosis in human cancer cell lines originating from different solid tumors . Anticancer Res. 2014; ; 34 : :6417.–6422. 51. Birsen R, Larrue C, Decroocq J, et al. APR-246 induces early cell death by ferroptosis in acute myeloid leukemia . Haematologica. 2021; doi: 10.3324/haematol.2020.259531. 52. WooJH, ShimoniY, YangWS, et al. Elucidating compound mechanism of action by network perturbation analysis . Cell. 2015; ; 162 : :441.–451. 53. KimSE, ZhangL, MaK, et al. Ultrasmall nanoparticles induce ferroptosis in nutrient-deprived cancer cells and suppress tumour growth . Nat Nanotechnol. 2016; ; 11 : :977.–985. 54. LangX, GreenMD, WangW, et al. Radiotherapy and immunotherapy promote tumoral lipid oxidation and ferroptosis via synergistic repression of SLC7A11 . Cancer Discov. 2019; ; 9 : :1673.–1685. 55. Tadokoro T, Ikeda M, Ide T, et al. Mitochondria-dependent ferroptosis plays a pivotal role in doxorubicin cardiotoxicity . JCI Insight. 2020;; 5 : :e132747.. |