| |
| Med Sci (Paris). 37: 50–52. doi: 34878399.doi: 10.1051/medsci/2021196.Un cas de myasthénie congénitale des ceintures résolu grâce à une collaboration tripartite Sonia Nouioua,1 Edoardo Malfatti,2* Ravenscroft Gianina,3 Sihem Hellal,4 Tazir Meriem,5 and J. Andoni Urtizberea6 1Service de Neurologie, EHS El Maham Cherchell, Tipaza, Algérie. 2Centre de référence neuromusculaire, APHP, Hôpital Henri Mondor, Université Paris Est, U955 INSERM, IMRB, France 3Harry Perkins Institute of Medical Research, University of Western Australia, Nedlands, Australia 4Laboratoire Central, CHU Mustapha, Alger, Algérie 5Service de Neurologie, CHU Mustapha, Université Youcef Benkhedda, AlgerAlgérie 6Institut de Myologie, Paris, France MeSH keywords: Adulte, Anticholinestérasiques, Protéines du cytosquelette, Femelle, Humains, Protéines membranaires, Adulte d'âge moyen, Mutation, Myasthénie, Syndromes myasthéniques congénitaux, usage thérapeutique, diagnostic, traitement médicamenteux, génétique |
La nosographie des maladies neuromusculaires héréditaires est rendue complexe du fait d’une grande hétérogénéité et de nombreux recouvrements tant au niveau phénotypique que génotypique. Qui plus est, la distribution de ces pathologies est souvent inégale dans les différentes populations du globe. Cette classification évolue de manière permanente et est concomitante d’un développement sans précédent de thérapies innovantes ciblées et d’un repositionnement de certaines molécules. Les pays du Maghreb se caractérisent par un patrimoine génétique en grande partie commun mais aussi par une grande diversité socio-culturelle. Des mutations fondatrices propres à l’Afrique du Nord ont d’ailleurs été rapportées dans de nombreuses myopathies ou neuropathies autosomiques récessives. L’Algérie, à l’instar de beaucoup de pays émergents, rencontre énormément de difficultés pour confirmer en biologie moléculaire le diagnostic de nombreuses maladies neuromusculaires héréditaires, y compris les plus communes. Ceci est d’autant plus frustrant qu’un nombre grandissant de professionnels de santé algériens s’intéresse à ce groupe de maladies longtemps considérées, désormais à tort, comme incurables. C’est dans ce contexte que les collaborations entre équipes algériennes et françaises impliquées en myologie se sont renforcées ces dernières années, avec le soutien de l’AFM-Téléthon, de Filnemus (la filière française neuromusculaire) mais aussi de l’industrie pharmaceutique implantée en Algérie. Le concept de travail en réseau reste plus que d’actualité dans le domaine des maladies rares comme l’illustre l’observation familiale qui suit. Cette dernière est le résultat d’une fructueuse mise en relation d’experts entre trois pays : l’Algérie, la France et l’Australie. |
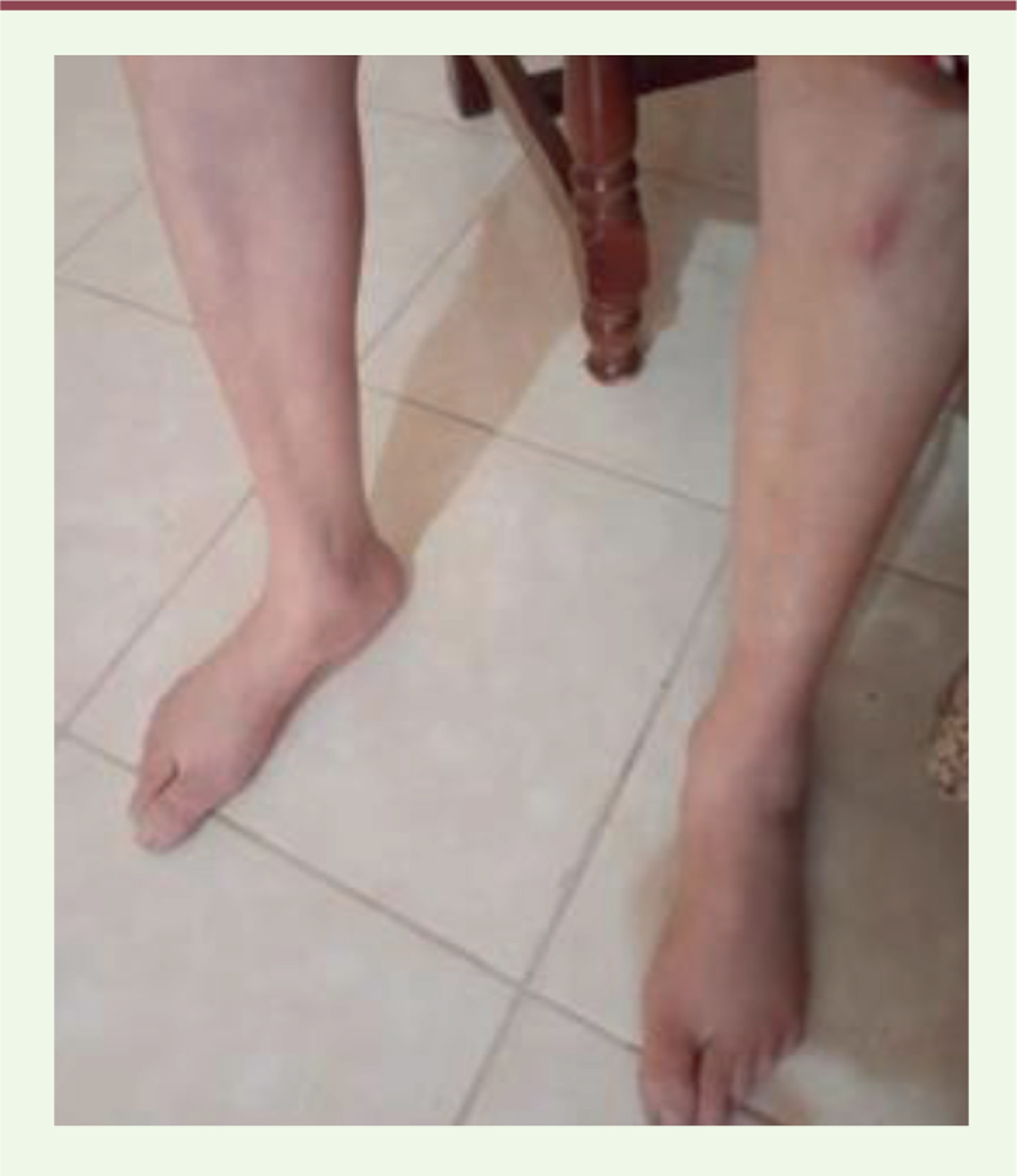
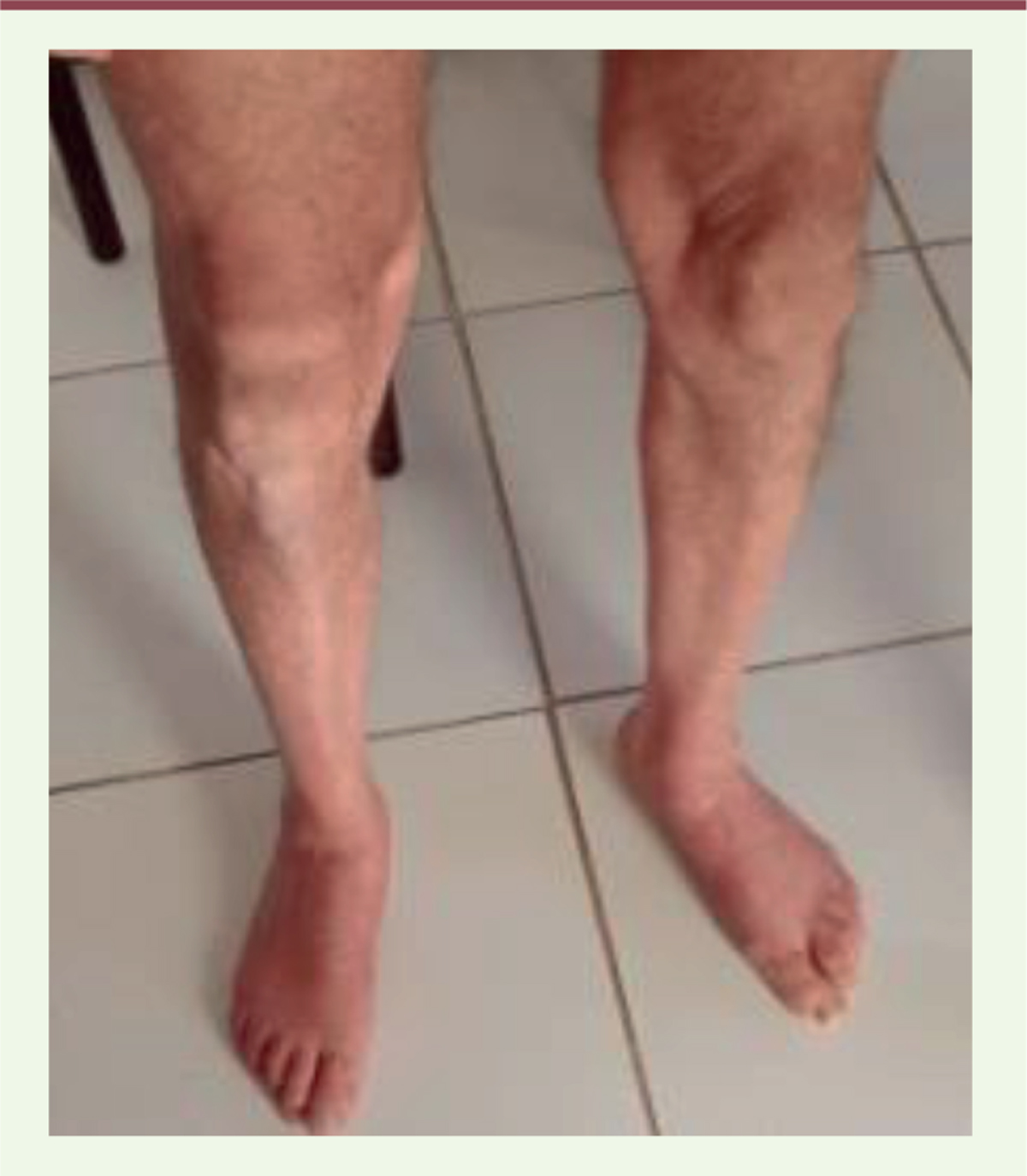
Cas 1 Le cas index, une femme âgée de 38 ans, vit à Paris et est originaire de Tizi Ouzou, dans l’Est algérien. La patiente est la septième enfant d’une fratrie de treize enfants issue de parents consanguins. Une sœur et deux frères sont également atteints. Depuis l’âge de 25 ans, la patiente rapporte une fatigabilité à l’effort, puis un déficit lentement progressif des muscles proximaux à l’origine de difficultés à la course, à la montée des escaliers et à la marche sur de longues distances. Dans le Centre de Référence neuromusculaire Nord-Est-Île-de-France dans lequel elle est initialement explorée, on suspecte une myopathie congénitale bénigne devant la faiblesse musculaire proximale, la présence d’une discrète dysmorphie faciale, et la normalité des CPK. L’électromyogramme (EMG) met toutefois en évidence un décrément net évoquant aussi un possible syndrome myasthénique congénital (SMC) post-synaptique. Une biopsie du muscle vaste latéral réalisée à l’âge de 35 ans avait montré une petitesse des fibres musculaires de type 1 et de nombreux noyaux internalisés. L’imagerie musculaire du corps entier a objectivé une infiltration fibro-adipeuse diffuse et symétrique prédominant sur les muscles distaux et paraspinaux, sans pattern spécifique. Les bilans cardiaque et respiratoire étaient strictement normaux. Une première étude sur le panel de gènes de SMC de l’époque (étude en NGS, laboratoire de génétique du Dr Damien Sternberg à la Salpêtrière) s’est avérée non concluante. Il est alors décidé d’élargir les recherches en envoyant l’ADN du cas index au laboratoire de génétique de Perth, en Australie occidentale avec lequel une collaboration scientifique était en cours. Parallèlement, il est décidé de contacter des homologues algériens en vue d’explorer les autres membres atteints de la famille et réaliser des prélèvements d’ADN en vue d’études génétiques complémentaires. Il a ainsi été possible, malgré le contexte pandémique de 2020, de réaliser une consultation aux domiciles respectifs des personnes atteintes, ces visites étant retransmises en direct grâce à l’application Whatsapp ®. Les prélèvements d’ADN ont suivi peu après et ont été envoyés en France où ils ont fait l’objet d’études complémentaires de ségrégation. Cas 2 La sœur ainée atteinte, 45 ans, est universitaire sans emploi et est mère de deux filles en bonne santé. Elle a présenté une hypotonie congénitale et la marche a été acquise tardivement à trois ans. Adolescente, elle s’est toujours plainte d’une lenteur et de difficultés à la course. La montée des escaliers est devenue laborieuse à partir de 20-25 ans. Elle ne pouvait plus se relever du sol vers l’âge de 30 ans. Des difficultés pour se retourner et se relever du lit sont apparues vers l’âge de 35 ans. La patiente rapporte par ailleurs une dyspnée occasionnelle lors de grands efforts. Elle reste fatigable, de manière chronique, mais sans véritable fluctuation. Elle ne sort pratiquement plus de chez elle. L’examen neurologique révèle une discrète raideur du cou et un déficit moteur symétrique et à prédominance proximale aux membres supérieurs. L’omoplate droite est décollée et les épaules sont tombantes. On note une amyotrophie proximale globale, avec abolition des réflexes ostéotendineux. Aux membres inférieurs, le déficit moteur est global, en moyenne autour de 3. Il existe un signe du tabouret et le relevé du sol est impossible. Il existe une amyotrophie jambière marquée avec rétractions des chevilles et pieds plats en valgus (
Figure 1
). La démarche est dandinante en hyperlordose, avec impossibilité de marcher sur les talons et sur la pointe des pieds, et tendance au steppage.
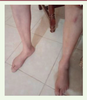 | Figure 1. Amyotrophie jambière chez la sœur atteinte. |
Cas 3 Le frère ainé, âgé de 58 ans, est le deuxième membre de la fratrie. Le début des troubles remonte à la deuxième décennie avec une fatigue ressentie au membre inférieur droit puis des difficultés à la montée des escaliers. L’évolution a été lentement progressive avec apparition de difficultés à porter des charges lourdes et à soulever les bras. Se relever du sol est quasi-impossible pour le patient. Il vaque néanmoins à toutes ses occupations quotidiennes. Son périmètre de marche est dans la norme. L’examen neurologique montre un déficit moteur des muscles prédominant en région proximale aux membres supérieurs et global (proximal et distal) aux membres inférieurs. On note une amyotrophie globale surtout au niveau des mollets d’allure pseudo-neuropathique et des pieds plats (
Figure 2
). La démarche est dandinante en hyperlordose avec des difficultés pour se mettre sur les talons et la pointe des pieds. 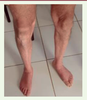 | Figure 2. Amyotrophie jambière chez un des frères atteints. |
|
Après avoir analysé les phénotypes des trois personnes atteintes, les cliniciens des deux côtés de la Méditerranée ont retenu l’hypothèse d’un tableau de déficit musculaire des ceintures, sans élévation des CPK, avec un début relativement précoce, une hérédité vraisemblablement autosomique récessive, un trouble de la jonction neuromusculaire (chez le cas index), et une fatigabilité marquée. C’est finalement l’étude conduite à Perth, en Australie, sur un panel beaucoup plus étendu de gènes neuromusculaires, qui a permis de sortir de l’impasse diagnostique dans laquelle se trouvait cette famille. Le laboratoire a en effet identifié une mutation homozygote non-sens, c.63dupC p.(Arg22Glnfs 88), dans le gène TOR1AIP1. La co-ségrégation du variant avec la maladie a été confirmée par la technique Sanger chez tous les patients atteints et un membre sain de la famille. Au vu de ces résultats, le cas index a été mise sous traitement anti-cholinestérasique (60 mg de pyridostigmine trois fois par jour) avec un bénéfice substantiel sur la fatigabilité et la durée de la station debout. |
Le gène TOR1AIP1 a été associé à plusieurs phénotypes neuromusculaires mais aussi cardiaques et multisystémiques, certains d’entre eux étant très invalidants [1-4]. Ce gène a été rapporté comme causal dans la dystrophie musculaire des ceintures de type 2Y (LGMD 2Y) de 2014 jusqu’en 2018 [1], date à laquelle la révision de la nomenclature internationale des LGMD est intervenue [5]. Ceci s’explique par la plus grande stringence de la nouvelle nomenclature des LGMD, notamment pour ce qui concerne le nombre de familles minimal nécessaire, le type de lésions histologiques et les taux des CPK. Cette co-existence de signes et symptômes évoquant à la fois un déficit des ceintures et une myasthénie congénitale n’est pas nouvelle. Popularisé notamment par E. Gardner-Medwin [6], le terme de limb-girdle myasthenia a longtemps fait florès bien que décrié par certains. Une telle association est particulièrement fréquente dans les SMC avec mutations dans les gènes DOK7, GFPT1 ou GMPBB [7], ce dernier étant considéré comme à l’origine d’une authentique LGMD (R19) même dans la nouvelle classification [5]. Le gène TOR1AIP1 (pour torsin A-interactingprotein 1) code LAP1, une protéine localisée dans la membrane nucléaire interne se liant aux lamines de type A et B. Cette protéine est impliquée dans la régulation de la torsine A ATPase (TOR1A; OMIM 605204) et existe sous trois isoformes : LAP1A, LAP1B et LAP1C. L’hétérogénéité phénotypique des TOR1AIP1(n)opathies pourrait être liée à la localisation des mutations qui touchent de façon variable les différentes isoformes. Une perte fonctionnelle affectant les deux isoformes de LAP1 provoque une envelopathie nucléaire de type multisystémique [3], tandis que les variants impactant uniquement LAP1B provoquent un phénotype exclusivement musculaire [1]. Pour autant, le rôle de LAP1 dans le dérèglement de la jonction neuromusculaire reste mal connu. Un modèle murin déficient en Lap1 a montré un élargissement et une fragmentation de la jonction neuromusculaire avec augmentation considérable des noyaux sous-synaptiques, le tout étant associé à un déficit musculaire avec fatigabilité et décrément à la stimulation nerveuse répétitive [8]. |
Cette observation illustre la nécessité de rechercher des mutations du gène TOR1AIP1 devant tout tableau associant des signes ou symptômes myasthéniques et un déficit des ceintures avec fatigabilité marquée. Il est impératif que ce gène, dont la découverte est relativement récente, soit dorénavant inclus dans les panels de gènes de SMC et mais aussi dans ceux des gènes de LGMD. La découverte d’un variant pathogène dans ce gène peut avoir des implications positives dans la prise en charge médicamenteuse du patient, comme illustré dans notre observation. De manière générale, ce travail est exemplaire de la nécessité de collaborations internationales très étendues lorsqu’il s’agit de réduire l’errance diagnostique chez certains malades. La myologie s’est depuis longtemps affranchie des frontières, fort heureusement. |
Une partie de ces données ont déjà été publiées dans l’article cité en référence [9]. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article. |
1. Kayman-Kurekci G, Talim B, Korkusuz P, et al. Mutation in TOR1AIP1 encoding LAP1B in a form of muscular dystrophy: a novel gene related to nuclear envelopathies . Neuromuscul Disord. 2014; ; 24 : :624.–633. 2. Ghaoui R, Benavides T, Lek M, et al. TOR1AIP1 as a cause of cardiac failure and recessive limb-girdle muscular dystrophy . Neuromuscul Disord. 2016;; 26x: :500.–3. 3. Fichtman B, Zagairy F, Biran N, et al. Combined loss of LAP1B and LAP1C results in an early onset multisystemic nuclear envelopathy . Nat Commun. 2019; ; 10 : :605.. 4. Feng X, Wu J, Xian W, et al. Muscular involvement and tendon contracture in limb-girdle muscular dystrophy 2Y: a mild adult phenotype and literature review . BMC Musculoskelet Disord. 2020;; 21: :588.. 5. Straub V, Murphy A, Udd B. LGMD workshop study group. 229th ENMC international workshop: limb girdle muscular dystrophies - Nomenclature and reformed classification Naarden, the Netherlands, 17–19 March 2017 . Neuromuscul Disord. 2018; ; 28 : :702.–710. 6. Gardner-Medwin D.. Clinical experience with the genetic myasthenias . In: Fejerman N, Chamoles NA, eds. New trends in pediatric neurology: proceedings of the 6th congress of the International Child Neurology Association . Amsterdam: : Excerpta Medica; , 1993: :117.–122. 7. Nicolau S, Kao JC, Liewluck T. Trouble at the junction: when myopathy and myasthenia overlap . Muscle Nerve. 2019; ; 60 : :648.–657. 8. Cossins J, Webster R, Maxwell S, et al. Congenital myasthenic syndrome due to a TOR1AIP1 mutation: a new disease pathway for impaired synaptic transmission . Brain Commun. 2020;; 2 : :fcaa174.. 9. Malfatti E, Catchpool T, Nouioua S et al. A TOR1AIP1 variant segregating with an early onset limb girdle myasthenia-Support for the role of LAP1 in NMJ function and disease . Neuropathol Appl Neurobiol. 2021; Jun 23.. doi: 10.1111/nan.12743. |