| |
| Med Sci (Paris). 37(12): 1158–1165. doi: 10.1051/medsci/2021208.Biomarqueurs vésiculaires Opportunités et défis dans les maladies cardiovasculaires et les cancers Amandine Bonifay,1,2 Sandra Ghayad,1 Romaric Lacroix,1,2* and Françoise Dignat-George1,2** 1Aix-Marseille Université, C2VN (Centre de recherche en cardiovasculaire et nutrition), Inserm 1263, INRAe 1260
,
13000Marseille
,
France 2Service d’hématologie et de biologie vasculaire, CHU La Conception, AP-HM
,
13005Marseille
,
France |
Vignette (© Guillaume van Niel, Aurélie di Cicco, Graça Raposo, Daniel Levy).
Les maladies cardiovasculaires et les cancers représentent les premières causes de mortalité et de morbidité dans le monde. L’utilisation de biomarqueurs robustes et validés est ainsi un enjeu majeur pour améliorer leur prise en charge. Dans ce cadre, les vésicules extracellulaires (VE) suscitent un intérêt grandissant. Considérées comme des vecteurs d’information biologiques impliqués dans la régulation des réponses de l’organisme, elles sont également reconnues comme des biomarqueurs prometteurs. Cet intérêt grandissant se mesure par le nombre exponentiel de publications documentant l’intérêt clinique des VE dans les maladies cardiovasculaires et le cancer, mais aussi par l’émergence de sociétés savantes comme l’ISEV (
International Society for Extracellular Vesicles
). Le passage des VE de la recherche fondamentale à la clinique nécessite d’intégrer les progrès des connaissances sur les molécules et organelles (qui constituent ainsi des cibles biologiques, terme utilisé dans la suite de cette revue) vectorisées par les VE et l’évolution des techniques permettant de quantifier ces cibles.
Après un rappel des caractéristiques des VE qui en font des biomarqueurs émergeants pour les biopsies liquides, cette revue développera, à partir d’exemples représentatifs choisis dans le domaine du cardiovasculaire et du cancer, comment les associations pertinentes « cible/méthodologie », permettent aujourd’hui de définir des biomarqueurs vésiculaires. Cette revue montrera également l’importance d’adapter les étapes pré-analytiques, analytiques et la standardisation à chaque couple cible/méthodologie, afin d’accélérer leur transfert vers la clinique et de les positionner comme des candidats potentiels pour une médecine personnalisée. |
Les vésicules extracellulaires, biomarqueurs émergeants pour les biopsies liquides Généralités sur les vésicules extracellulaires (VE)
Les VE constituent une population très hétérogène de structures membranaires submicroniques, libérées par les cellules de l’organisme. Un travail de nomenclature réalisé par la communauté internationale propose de classer les VE en fonction de leur taille, de leur densité, de leur composition et de leur biogenèse, en distinguant deux sous-types essentiels : les vésicules de petite taille, assimilées aux exosomes et les vésicules plus grandes, regroupant les microvésicules/microparticules et les corps apoptotiques [
1
]. Les notions concernant la biogenèse des VE, leur composition et leur rôle biologique sont développées dans d’autres articles de ce numéro thématique.
Une caractéristique commune à toutes les VE est qu’elles sont entourées d’une bicouche lipidique qui en fait de véritables vecteurs capables de transporter des protéines solubles ou membranaires, des lipides, des acides nucléiques, mais aussi des organelles provenant de leur cellule d’origine. Grâce à la puissance des analyses de cytomique, de protéomique, de lipidomique et de génomique, ces différents cargos vectorisés par les VE ont été répertoriés dans des bases de données, telles que
EVpedia
[
2
]. Libérées dans les milieux extracellulaires, les VE ont été identifiées dans de nombreux liquides biologiques de l’organisme, comme le plasma, l’urine, les liquides articulaires, les ascites ou encore le liquide pleural. Ainsi, la composition et l’accessibilité des VE dans ces différents liquides biologiques, les identifient comme des biomarqueurs prometteurs dans les biopsies liquides.
Les biopsies liquides
L’émergence du concept de biopsie liquide permet de lever certaines difficultés liées à l’exploration de tissus solides d’accès difficile, comme les vaisseaux, les tumeurs, le cerveau ou le placenta [
3
–
5
] (
→
).
(→) Voir les Nouvelles de F. Angelot
et al
.,
m/s
n° 1, janvier 2010, page 31, et J. Saint-Pol et F. Gosselet,
m/s
n° 4, avril 2018, page 303
Une biopsie liquide permet de recueillir des informations sur ces tissus grâce à un prélèvement de liquide biologique en contact avec ces derniers, donnant accès à différents types de biomarqueurs (cellules, protéines et acides nucléiques circulants). Comme illustré
Figure 1
, à travers un simple prélèvement de sang, il est possible d’accéder non seulement aux VE produites par les cellules hématopoïétiques, mais aussi à celles produites par les cellules endothéliales ou les tumeurs au contact des vaisseaux. À l’inverse des biopsies solides, les biopsies liquides s’appuient sur des procédures peu invasives, peu coûteuses, apportant des informations utiles pour améliorer le diagnostic, prévenir le risque et suivre l’efficacité de la réponse thérapeutique dans le cadre d’études longitudinales (
Figure 2
).
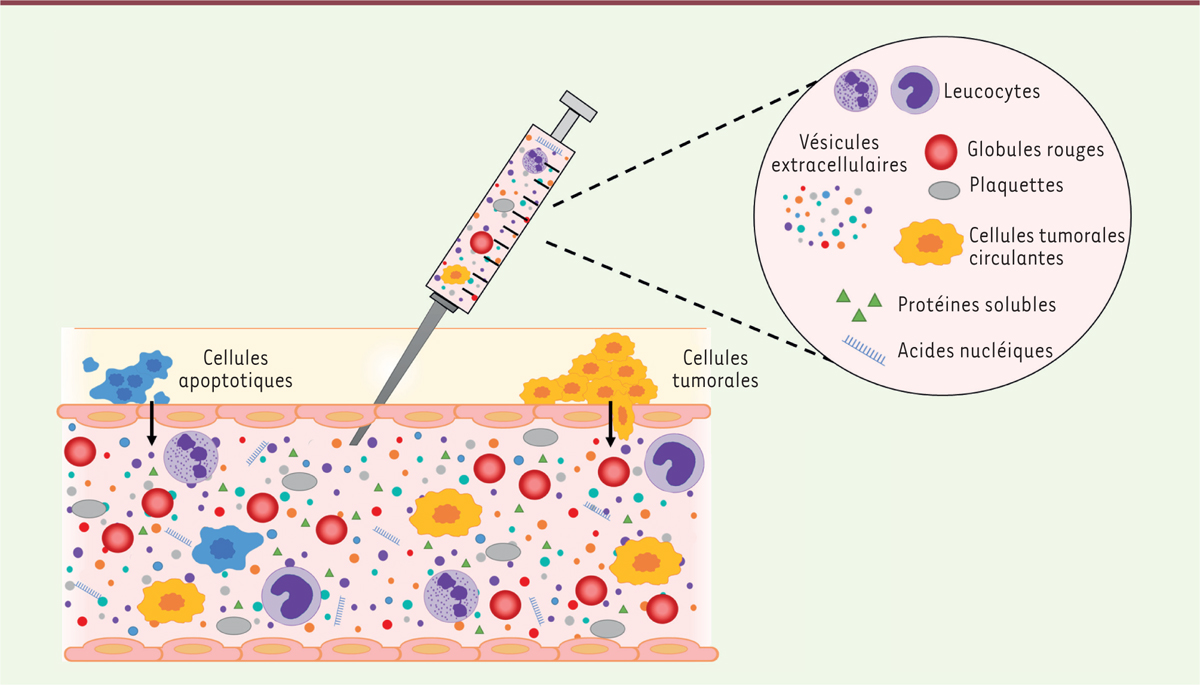
 | Figure 1.
Biomarqueurs potentiels accessibles par une biopsie liquide.
Une biopsie liquide permet d’accéder de façon simple à des biomarqueurs, tels que les vésicules extracellulaires, les cellules tumorales circulantes ou les acides nucléiques présents dans les liquides biologiques en contact avec des tissus non circulants, dans le but de limiter les actes invasifs. Dans le cas des vésicules extracellulaires, cette méthode permet d’avoir accès de façon non invasive à des tissus d’accès difficile : le vaisseau, la plaque d’athérosclérose, les masses tumorales ou des cellules engagées dans des processus d’apoptose et donc non détectables.
|
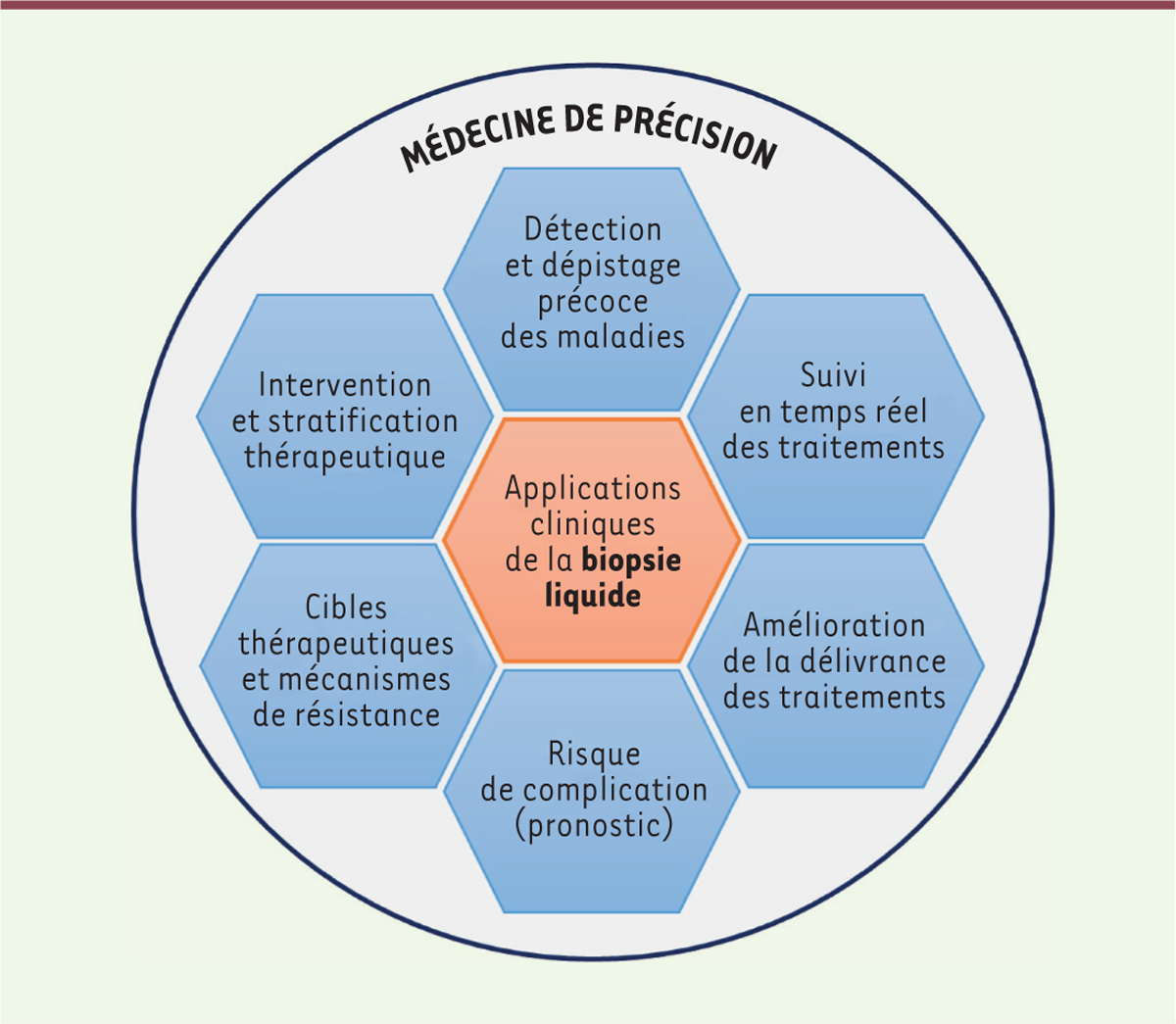
 | Figure 2.
Applications cliniques de la biopsie liquide, permettant sa participation à une médecine de précision.
|
Si les VE sont aujourd’hui identifiées comme des biomarqueurs d’intérêt dans ces biopsies liquides, il persiste encore des limitations qui reposent sur les défis techniques liés à l’isolement, la purification et la quantification des VE et de leur contenu, expliquant pourquoi peu d’identifications de cibles vésiculaires ont conduit à ce jour à des applications cliniques. Cela indique que la pertinence clinique des VE en tant que biomarqueur est indissociable de la notion de mesurabilité de la cible
1
biologique qu’elles vectorisent, grâce à une méthodologie robuste et standardisée, comme cela est rappelé dans la définition officielle d’un biomarqueur selon les NIH (
National Institutes of Health
) américains :
« une caractéristique mesurée de façon objective et évaluée comme un indicateur d’une réponse biologique normale ou pathologique ou d’une réponse pharmacologique à une intervention thérapeutique »
[
6
].
|
Définition de biomarqueurs vésiculaires par des associations cible/méthode
Dans cette première partie, nous avons choisi d’illustrer cette association cible/méthodologie (
Figure 3
), à partir d’exemples issus des domaines des maladies cardiovasculaires et du cancer, représentatifs de la pertinence clinique des VE (
Tableau I
).
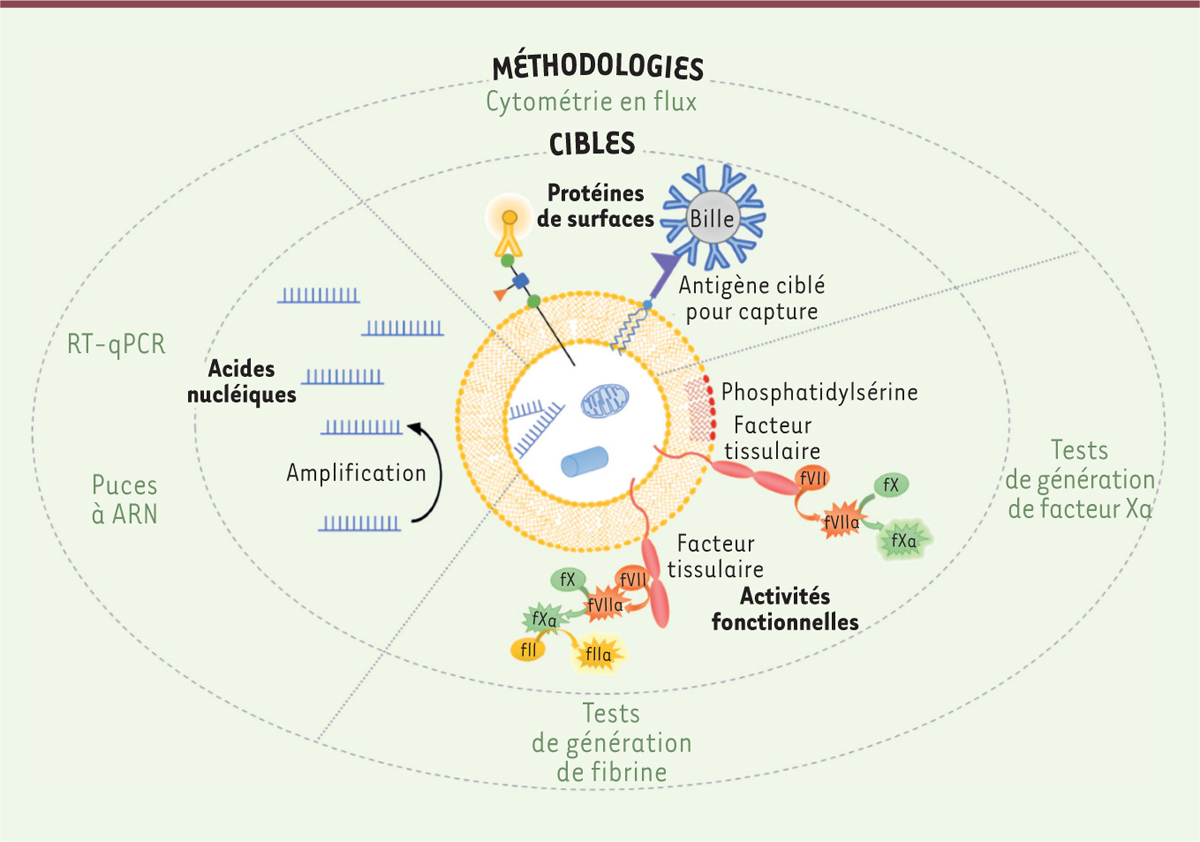
 | Figure 3.
Définition d’un biomarqueur vésiculaire par un couple cible vésiculaire/méthodologie.
L’association d’une cible portée par les vésicules extracellulaires (protéine de surface, activité fonctionnelle, acide nucléique) à une méthodologie forme un couple permettant de définir des biomarqueurs vésiculaires, pertinents dans le diagnostic, le pronostic ou la prise en charge thérapeutique des patients. ARN : acide ribonucléique ; f : facteur ; RT-qPCR : réaction en chaîne par polymérase quantitative par transcription inverse.
|
Tableau I.
| Domaines |
Maladies |
Cibles vésiculaires |
Méthodes |
Significations cliniques |
Références |
|
Protéines
|
|
Cardiovasculaire
|
Insuffisance rénale |
VE endothéliales : CD31/CD41 |
CMF |
Prédiction d’événements cardiovasculaires |
[
10
]
|
| Maladie coronarienne |
VE endothéliales : CD144 |
CMF |
Prédiction d’événements cardiovasculaires |
[
9
]
|
| Hypercholestérolémie familiale |
VE leucocytaires : CD45 |
CMF |
Prédiction d’événements cardiovasculaires et mortalité |
[
11
]
|
| Sténose carotidienne |
VE leucocytaires : CD11b et CD66b |
CMF |
Prédiction de l’instabilité de la plaque d’athérosclérose |
[
12
]
|
|
Cancer
|
Gliome |
EGFR |
CMF avec microbilles de latex |
Diagnostic et critère de gravité |
[
15
]
|
| Carcinome pulmonaire |
EpCAM |
CMF |
Diagnostic |
[
16
]
|
|
|
Fonctions
|
|
Cancer
|
Cancer du pancréas |
Activité fonctionnelle du facteur tissulaire |
Génération de fibrine |
Prédiction du risque de thrombose |
[
22
]
|
|
Cardiovasculaire
|
Thrombose associée à la Covid-19 |
Activité fonctionnelle du facteur tissulaire |
Génération du facteur Xa |
Prédiction du risque de thrombose et sévérité |
[
23
]
|
|
|
Acides nucléiques
|
|
Cardiovasculaire
|
Syndrome coronarien aigu |
miR-208a |
Puce à ARN et RT-qPCR |
Diagnostic et pronostic |
[
36
]
|
| Insuffisance cardiaque |
miR-92b-5p |
RT-qPCR |
Diagnostic |
[
34
]
|
| Atteinte coronarienne |
lncRNA CoroMarker |
Puce à ARN et RT-qPCR |
Diagnostic |
[
37
]
|
|
Cancer
|
Prostate |
ARNm : PCA3, ERG et SPDEF |
Test ExoDx Prostate (IntelliScore) (EPI) |
Diagnostic |
[
38
]
|
| Tumeurs solides et hématologiques |
miR-21 |
Puce à ARN et RT-qPCR |
Diagnostic et pronostic |
[
39
]
|
| Poumon |
miR-21 et miR-4257 |
Puce à ARN et RT-qPCR |
Prédictif |
[
40
]
|
Exemples d’association de cibles vésiculaires et de méthodes.
ARN : acide ribonucléique ; CMF : cytométrie en flux ; EGFR : récepteur du facteur de croissance épidermique ; EpCAM : molécule d’adhérence des cellules épithéliales ; RT-qPCR : réaction en chaîne par polymérase quantitative par transcription inverse ; VE : vésicules extracellulaires circulantes.
|
Cibles protéiques vésiculaires mesurées par des méthodes antigéniques
Lors de leur processus de formation, les vésicules extracellulaires (VE) incorporent une partie des protéines membranaires et cytoplasmiques exprimées par les cellules qui les produisent (dites « parentales »). La détermination de ces cibles protéiques permet d’identifier spécifiquement l’origine cellulaire des VE, d’évaluer les sous-populations de VE présentes dans les milieux biologiques, et d’obtenir des informations sur le niveau d’activation de la cellule parentale. Parmi un large panel de méthodologies existantes pour quantifier ces cibles, la cytométrie en flux (CMF) est la technique la plus utilisée (
Figure 3
). Fondée sur l’utilisation de sondes fluorescentes spécifiques, la CMF combine les avantages d’une analyse multiparamétrique et quantitative permettant de mesurer les sous-populations de VE avec un bon niveau de spécificité. De plus, il s’agit d’une technique accessible dans de nombreux laboratoires hospitaliers et de recherche. Ces dernières années, la CMF a bénéficié de progrès techniques considérables permettant d’améliorer les capacités de résolution en taille et en fluorescences des cytomètres [
7
]. La conséquence en a été une performance accrue pour identifier les VE les moins fréquentes dans la circulation (VE d’origine endothéliale, leucocytaire ou tumorale), mais les plus pertinentes au regard de l’intérêt des biopsies liquides dans certaines circonstances cliniques, comme illustré dans les exemples ci-dessous.
Dans différents contextes à risques cardiovasculaires, des niveaux élevés de VE endothéliales, identifiées par les protéines de surface, comme CD31, CD144 ou CD146, sont corrélés positivement à la dysfonction endothéliale et sont associés à différents facteurs de risques tels que l’obésité, le diabète ou l’hypertension [
8
]. Dans une cohorte de 378 patients coronariens, la numération par CMF des VE endothéliales exprimant CD144 est un facteur prédictif indépendant de futurs évènements cardiovasculaires dans les populations à haut risque [
9
]. Une autre étude prospective réalisée sur 81 patients dialysés chroniques, suivis durant six ans, a montré qu’une élévation des VE endothéliales CD31
+
/CD41
-
était prédictive de futurs évènements cardiovasculaires et était associée à un pronostic vital péjoratif [
10
]. Dans ces deux populations, illustrant la notion de biopsie liquide endothéliale, l’ajout de la numération des VE endothéliales au score de Framingham
2
, améliore la stratification du risque cardiovasculaire.
L’augmentation des VE d’origine leucocytaire est également un biomarqueur du risque cardiovasculaire. Dans une cohorte de 140 patients atteints d’hypercholestérolémie familiale, la mesure de sous-populations de VE leucocytaires, évaluées par CMF grâce à l’analyse de la présence de CD45, une protéine exprimée par les leucocytes, a pu être associée à la survenue d’événements cardiovasculaires et à la survie des patients [
11
]. Dans cette étude, l’association de la numération des VE leucocytaires au score de Framingham a permis d’augmenter de façon significative son pouvoir discriminant du risque vasculaire. De plus, l’augmentation des VE leucocytaires quantifiées par CMF dans le plasma grâce à l’analyse de la présence de CD11b et CD66b à leur surface est un biomarqueur indépendant de l’instabilité des plaques d’athérosclérose, illustrant l’intérêt du concept de biopsie liquide chez les patients asymptomatiques présentant une sténose carotidienne pour diagnostiquer le caractère instable de la plaque et orienter le choix thérapeutique [
12
].
Dans le domaine du cancer, les VE portent des signatures protéiques (récepteur du facteur de croissance épithélial [EGFR], molécule d’adhérence de l’épithélium [EpCAM], etc.) représentatives des cellules tumorales, permettant de les quantifier dans des biopsies liquides et de les positionner comme potentiels marqueurs diagnostiques, théranostiques ou pronostiques [
13
,
14
]. Par exemple, chez des patients atteints de gliome [
15
], la quantification du niveau d’expression de l’EGFR sur les VE tumorales, capturées sur microbilles et quantifiées par CMF, est corrélée à la malignité du gliome. Dans une cohorte de 71 patients présentant une pleurésie, la numération par CMF des VE tumorales exprimant EpCAM dans le liquide pleural illustre le fait que ce biomarqueur vésiculaire, accessible dans une biopsie liquide, permet d’améliorer la sensibilité du diagnostic des carcinomes en comparaison à l’utilisation de la cytologie seule [
16
].
Cibles enzymatiques vésiculaires mesurées par des méthodes fonctionnelles
Les activités biologiques générées par les enzymes actives ou leurs récepteurs exprimés à la membrane des VE sont une source complémentaire de biomarqueurs vésiculaires. En raison de la petite taille des VE, la plupart de ces molécules de surface ne sont pas détectables par les méthodes antigéniques (utilisant des anticorps pour les détecter) alors que leur activité reste accessible grâce à l’amplification du signal de détection par la réaction enzymatique qu’elles engendrent. C’est ainsi que la mise en évidence des propriétés procoagulantes de VE a été à l’origine de leur découverte en 1967 [
17
]. Ces propriétés sont dues à la présence, à la surface des VE, de phospholipides anioniques qui vont permettre l’assemblage des enzymes de la coagulation et du facteur tissulaire, principal activateur de la voie exogène de la coagulation. Cette activité procoagulante est quantifiée par des tests fonctionnels mesurant la capacité des VE à générer le facteur Xa ou la fibrine (
Figure 3
) [
18
]. Des développement récents ont permis d’améliorer non seulement la spécificité de ces méthodes, en utilisant des anticorps bloquant le facteur tissulaire [
19
], mais aussi leur sensibilité [
20
] et leur reproductibilité, notamment grâce à des tests de capture sur billes des VE permettant de s’affranchir des problèmes de reproductibilité liés aux centrifugations habituellement utilisées pour leur purification [
21
].
Les études les plus représentatives sont retrouvées dans les thromboses associées aux cancers [
18
]. Par exemple, dans une cohorte prospective de 648 patients atteints de cancers solides, l’activité procoagulante des VE, mesurée par un test de génération de fibrine dépendant du facteur tissulaire, s’est révélée significativement augmentée chez les patients subissant un évènement thrombo-embolique dans les six mois de suivi, avec une association à un risque de thrombose quatre fois plus élevée chez les patients atteints d’un cancer du pancréas [
22
]. Dans le cadre des complications thrombotiques associées à la Covid-19 (
coronavirus disease 2019
), une étude réalisée sur une cohorte de 111 patients a montré que l’augmentation de l’activité procoagulante des VE circulantes était associée à la sévérité de la maladie et prédisait de façon indépendante le risque thrombo-embolique [
23
]. Outre la prédiction du risque de thrombose associé aux formes sévères de Covid-19, cette activité procoagulante des VE pourrait représenter un biomarqueur vésiculaire permettant de personnaliser les traitements anticoagulants.
Acides nucléiques vésiculaires mesurés par des méthodes moléculaires
La découverte d’ARN dans les VE (VE-ARN) a été une étape clé dans la démonstration de leur rôle dans le transfert intercellulaire de messages génétiquement codés. En plus d’ARN messagers (ARNm), les VE contiennent des ARN non-codants, tels que les micro-ARN (miARN), les longs ARN non-codants (lncARN) et les ARN circulaires (circARN) [
24
,
25
] (
→
).
(→) Voir la Nouvelle de S. Manier
et al
.,
m/s
n° 11, novembre 2017, page 939
Leur quantification a fait l’objet de recommandations par l’ISEV [
26
,
27
] et des outils, comme l’application
miRDaR
[
28
], ont été développés pour sélectionner la méthode d’isolement optimale des VE-ARN en fonction du fluide biologique d’intérêt examiné [
29
]. À la suite de cette étape d’isolement des VE, un traitement par la RNase est utilisé pour discriminer entre les ARN présents dans les VE et protégés par la bicouche lipidique de ces dernières, et les ARN extracellulaires non associés aux VE [
30
]. Les méthodes de détection des VE-ARN les plus répandues sont la PCR (
polymerase chain reaction
) quantitative en temps réel (RT-qPCR), les puces à ARN (
microarray
), le séquençage de nouvelle génération et le système
nCounter
(
NanoString Technologies)
qui est la technique la plus récente et qui permet la détection d’une seule molécule sans amplification [
31
]. Ces différents VE-ARN sont actuellement de plus en plus évalués en tant que biomarqueurs dans une grande variété de maladies, notamment les maladies cardiovasculaires et les cancers [
32
,
33
].
Par exemple, dans les maladies cardiovasculaires, la spécificité cardiaque des VE-ARN semble être meilleure que les tests de diagnostic conventionnels reposant sur la troponine myocardique car les miARN sont détectés plus rapidement et sont plus sensibles et spécifiques dans le contexte de l’infarctus du myocarde [
34
,
35
]. Les VE-ARN d’origine cardiaque sont détectables dans l’urine, ce qui ouvre la voie à des applications de type biopsie liquide. Par exemple, l’expression significativement élevée du miR-208a, détecté par puce à miARN puis exploré par RT-qPCR dans les vésicules isolées de 50 patients atteints de syndrome coronarien aigu, est une piste très prometteuse pour le diagnostic de cette maladie [
36
]. Par ailleurs, différentes études ont mis en évidence le niveau sérique de miR-92b-5p vésiculaire comme biomarqueur potentiel du diagnostic de l’insuffisance cardiaque [
34
]. Dans une étude de cas-contrôle menée sur une cohorte de 221 patients atteints de coronaropathie, le taux de lncARN-VE CoroMarker, évalué par RT-qPCR, a été montré comme étant un biomarqueur vésiculaire stable, sensible et spécifique de la maladie des artères coronaires [
37
].
Dans les cancers, le test
ExoDx Prostate
(
IntelliScore
) est le premier test de biopsie liquide à base d’EV, développé par la société
Exosome Diagnostics
. Chez les patients atteints de cancer de la prostate, cette biopsie liquide urinaire quantifie par RT-qPCR, trois cibles de VE-ARN (
PCA3 [prostate cancer antigen 3]
,
ERG [erythroblast transformation-specific (ETS) family of transcription factors]
et
SPDEF [SAM pointed domain-containing Ets transcription factor]
), permettant de discriminer les cancers de haut grade, de bas grade et les tumeurs bénignes [
38
]. De même, des miARN appelés oncomiR, comme l’oncomiR-21, ont été identifiés comme des biomarqueurs vésiculaires prometteurs pour le diagnostic et le pronostic de tumeurs solides et hématologiques [
39
]. Dans une étude de 195 patients ayant subi une résection curative pour un cancer du poumon, l’expression par des vésicules plasmatiques de miR-21 et de miR-4257 est apparue comme étant un biomarqueur prédictif de récidive [
40
].
|
Les progrès exponentiels qui ont été réalisés pour identifier le contenu moléculaire et fonctionnel transporté par les VE dans les liquides biologiques donnent maintenant accès, par un prélèvement peu invasif, à des informations majeures sur les processus physiopathologiques représentatifs de maladies chez les patients étudiés. Parallèlement, les progrès techniques permettent désormais aux laboratoires de disposer d’un ensemble de méthodes adaptées à l’exploration du monde nanobiologique complexe des VE. L’interconnexion de ces évolutions ouvre un panel de plus en plus large de biomarqueurs vésiculaires potentiels. Cependant, la concrétisation de ce potentiel vers la pratique clinique nécessite une définition précise des conditions à mettre en œuvre pour intégrer les contraintes de terrain en termes de faisabilité, de robustesse et de performance méthodologique. Dans cette dernière partie, nous allons donc nous attacher à montrer l’importance d’adapter les étapes pré-analytiques, analytiques et de standardisation à chaque couple cible/méthode, afin d’accélérer le transfert de ces biomarqueurs vésiculaires vers leur utilisation en clinique.
L’étape pré-analytique est la source de variabilité la plus importante. Les principaux paramètres influençant la mesure des VE plasmatiques ont été identifiés, en particulier la nature de l’anticoagulant utilisé pour les prélèvements, le délai d’acheminement des échantillons, les conditions de leur transport et de leur stockage [
41
]. Des recommandations ont été émises par un panel d’experts internationaux, sous l’égide de l’ISEV et de l’ISTH (
International Society on Thrombosis and Haemostasis
) [
1
,
42
]. Ces recommandations doivent être adaptées à chaque couple cible/méthode. Par exemple, la quantification des sous-populations de VE par CMF impose des conditions rigoureuses en termes de délai et de conditions de transport pour la mesure de VE produites par les plaquettes, présentes en grandes quantités dans le sang périphérique. Concernant l’isolement des VE, différentes méthodes sont à ce jour disponibles, comme les centrifugations différentielles, les immuno-captures, les tamis moléculaires ou la chromatographie d’exclusion de taille [
43
]. Chacune de ces méthodes présente ses avantages et ses limites, et n’est pas toujours adaptée à la pratique clinique. Ainsi, il est possible de s’affranchir d’un isolement par ultracentrifugation, très contraignant et source de variabilité, en analysant directement les VE plasmatiques d’origine leucocytaire, par CMF ou en les capturant sur des billes magnétiques [
21
].
Concernant l’étape analytique, l’utilisation des VE en pratique clinique nécessite que la cible identifiée soit mesurable de manière robuste (sensible, spécifique et répétable) par des méthodes disponibles dans les laboratoires de diagnostic, et que le résultat de l’analyse puisse être rendu dans un délai compatible avec l’utilisation clinique du biomarqueur. Par exemple, pour un biomarqueur vésiculaire fonctionnel permettant de prédire le pronostic et la survenue de thrombose chez un patient hospitalisé, le résultat doit être accessible au clinicien en quelques heures pour permettre une adaptation du traitement anticoagulant. Ainsi, une automatisation des tests adaptée à chaque couple cible/méthode est un prérequis indispensable, impliquant le développement de partenariats entre chercheurs et médecins du monde académique et développeurs industriels afin de lever les derniers verrous techniques pour un développement conforme aux exigences des dispositifs médicaux de diagnostic
in vitro
, et,
in fine
, une utilisation en pratique clinique.
Concernant la standardisation de la mesure des biomarqueurs vésiculaires, des efforts importants ont déjà été réalisés au cours des 15 dernières années, en particulier pour la mesure des VE par CMF. Dans le cadre des sous-comités de standardisation de l’ISTH, plusieurs études multicentriques internationales, coordonnées par notre groupe et celui de Rienk Nieuwland [
44
] et poursuivies par un consortium issu de trois sociétés savantes (l’ISEV, l’ISTH, et l’ISAC [
International Society for Advancement of Cytometry
]) [
45
], ont permis de définir des protocoles standardisés et des outils de calibration permettant de réduire la variabilité inter-laboratoires. Ces protocoles sont aujourd’hui à disposition de la communauté scientifique. Une étape importante est maintenant de focaliser ces efforts de standardisation vers les couples cibles/méthodes dont l’intérêt clinique a été démontré. La mise à disposition de standards vésiculaires pour la CMF, pour les tests fonctionnels et pour la mesure des acides nucléiques, est indispensable pour permettre des études multicentriques sur de larges cohortes de patients. Ces efforts concernent aussi l’établissement de consensus sur la définition de cibles protéiques caractérisant les VE les moins fréquentes mais les plus pertinentes d’un point de vue clinique, comme les VE d’origine endothéliale, leucocytaire ou tumorale.
|
Il est maintenant clairement établi que les VE vectorisent des cibles moléculaires et fonctionnelles parmi lesquelles il est possible d’identifier des biomarqueurs vésiculaires d’intérêt, facilement accessibles dans différents milieux biologiques. Leur intérêt clinique a été démontré dans de nombreux contextes pathologiques associés aux maladies cardiovasculaires et aux cancers. La liste de ces cibles ne cesse de s’agrandir puisque, plus récemment, des mitochondries, des ribosomes, et des éléments du protéasome ont été identifiés dans certaines sous-populations de vésicules, leurs conférant de nouvelles propriétés dans les réponses inflammatoires et immunes [
46
].
Si les avancées techniques et les efforts de standardisation accomplis ces dernières années dans la mesure et la caractérisation de ces cibles vésiculaires sont encourageants, plusieurs enjeux restent encore à atteindre pour accélérer le transfert vers la clinique et les positionner comme de véritables biomarqueurs. Lorsque ces différents enjeux auront été relevés, il sera possible de valider la pertinence clinique des VE, grâce à des études multicentriques à large échelle, permettant d’implémenter les VE dans des scores les combinant aux données biologiques et cliniques. Ces études, intégrant les recommandations des sociétés savantes et les éléments normatifs des analyses de biologie médicale, permettent de positionner les VE comme de futurs candidats pour développer une médecine personnalisée dans les maladies cardiovasculaires et les cancers. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Ce travail a bénéficié d’une aide de l’État gérée par l’Agence Nationale de la Recherche au titre du programme d’Investissements d’avenir portant la référence ANR-18-RHUS-0015.
|
Footnotes |
1.
Théry
C
,
Witwer
KW
,
Aikawa
E
,
et al.
Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines.
.
J Extracell Vesicles.
2018;
;
7
:
:1535750.
.
2.
Kim
D-K
,
Lee
J
,
Simpson
RJ
,
et al.
EVpedia: A community web resource for prokaryotic and eukaryotic extracellular vesicles research.
.
Semin Cell Dev Biol.
2015;
;
40
:
:4.
–
7
.
3.
Pang
B
,
Zhu
Y
,
Ni
J
,
et al.
Extracellular vesicles: the next generation of biomarkers for liquid biopsy-based prostate cancer diagnosis.
.
Theranostics.
2020;
;
10
:
:2309.
–
26
.
4.
Angelot
F
,
Seillès
E
,
Saas
P
,
et al.
Les microparticules endothéliales — Un signal d’alarme pour le système immunitaire ?
Med Sci (Paris).
2010;
;
26
:
:31.
–
33
.
5.
Saint-Pol
J
,
Gosselet
F
.
Petits mais costauds — Les exosomes neuronaux contrôlent l’intégrité vasculaire cérébrale.
.
Med Sci (Paris).
2018;
;
34
:
:303.
–
306
.
6.
Strimbu
K
,
Tavel
JA
.
What are Biomarkers?
Curr Opin HIV AIDS.
2010;
;
5
:
:463.
–
466
.
7.
Welsh
JA
,
Holloway
JA
,
Wilkinson
JS
,
et al.
Extracellular Vesicle Flow Cytometry Analysis and Standardization.
.
Front Cell Dev Biol.
2017;
;
5
:
:78.
.
8.
Boulanger
CM
,
Dignat-George
F
.
Microparticles: an introduction.
.
Arterioscler Thromb Vasc Biol.
2011;
;
31
:
:2.
–
3
.
9.
Nozaki
T
,
Sugiyama
S
,
Koga
H
,
et al.
Significance of a multiple biomarkers strategy including endothelial dysfunction to improve risk stratification for cardiovascular events in patients at high risk for coronary heart disease.
.
J Am Coll Cardiol.
2009;
;
54
:
:601.
–
608
.
10.
Amabile
N
,
Guérin
AP
,
Tedgui
A
,
et al.
Predictive value of circulating endothelial microparticles for cardiovascular mortality in end-stage renal failure: a pilot study.
.
Nephrol Dial Transplant.
2012;
;
27
:
:1873.
–
1880
.
11.
Suades
R
,
Padró
T
,
Crespo
J
,
et al.
Liquid Biopsy of Extracellular Microvesicles Predicts Future Major Ischemic Events in Genetically Characterized Familial Hypercholesterolemia Patients.
.
Arterioscler Thromb Vasc Biol.
2019;
;
39
:
:1172.
–
1181
.
12.
Sarlon-Bartoli
G
,
Bennis
Y
,
Lacroix
R
,
et al.
Plasmatic level of leukocyte-derived microparticles is associated with unstable plaque in asymptomatic patients with high-grade carotid stenosis.
.
J Am Coll Cardiol.
2013;
;
62
:
:1436.
–
1441
.
13.
Lane
RE
,
Korbie
D
,
Hill
MM
,
et al.
Extracellular vesicles as circulating cancer biomarkers: opportunities and challenges.
.
Clin Transl Med.
2018;
;
7
:
:14.
.
14.
Zhou
E
,
Li
Y
,
Wu
F
,
et al.
Circulating extracellular vesicles are effective biomarkers for predicting response to cancer therapy.
.
EBioMedicine.
2021;
;
67
:
:103365.
.
15.
Wang
H
,
Jiang
D
,
Li
W
,
et al.
Evaluation of serum extracellular vesicles as noninvasive diagnostic markers of glioma.
.
Theranostics.
2019;
;
9
:
:5347.
–
5358
.
16.
Roca
E
,
Lacroix
R
,
Judicone
C
,
et al.
Detection of EpCAM-positive microparticles in pleural fluid: A new approach to mini-invasively identify patients with malignant pleural effusions.
.
Oncotarget.
2016;
;
7
:
:3357.
–
3366
.
17.
Wolf
P.
.
The nature and significance of platelet products in human plasma.
.
Br J Haematol.
1967;
;
13
:
:269.
–
288
.
18.
Lacroix
R
,
Vallier
L
,
Bonifay
A
,
et al.
Microvesicles and Cancer Associated Thrombosis.
.
Semin Thromb Hemost.
2019;
;
45
:
:593.
–
603
.
19.
Hisada
Y
,
Mackman
N
.
Measurement of tissue factor activity in extracellular vesicles from human plasma samples.
.
Res Pract Thromb Haemost.
2019;
;
3
:
:44.
–
48
.
20.
Vallier
L
,
Bouriche
T
,
Bonifay
A
,
et al.
Increasing the sensitivity of the human microvesicle tissue factor activity assay.
.
Thromb Res.
2019;
;
182
:
:64.
–
74
.
21.
Franco
C
,
Lacroix
R
,
Vallier
L
,
et al.
A new hybrid immunocapture bioassay with improved reproducibility to measure tissue factor-dependent procoagulant activity of microvesicles from body fluids.
.
Thromb Res.
2020;
;
196
:
:414.
–
24
.
22.
van Es
N
,
Hisada
Y
,
Di Nisio
M
,
et al.
Extracellular vesicles exposing tissue factor for the prediction of venous thromboembolism in patients with cancer: A prospective cohort study.
.
Thromb Res.
2018;
;
166
:
:54.
–
59
.
23.
Guervilly
C
,
Bonifay
A
,
Burtey
S
,
et al.
Dissemination of extreme levels of extracellular vesicles: tissue factor activity in patients with severe COVID-19.
.
Blood Adv.
2021;
;
5
:
:628.
–
34
.
24.
Abels
ER
,
Breakefield
XO
.
Introduction to Extracellular Vesicles: Biogenesis, RNA Cargo Selection, Content, Release, and Uptake.
.
Cell Mol Neurobiol.
2016;
;
36
:
:301.
–
312
.
25.
Manier
S
,
Leleu
X
,
Avet-Loiseau
H
.
Rôle pronostique des microARN des exosomes circulants dans le myélome multiple.
.
Med Sci (Paris).
2017;
;
33
:
:939.
–
941
.
26.
Laurent
LC
,
Abdel-Mageed
AB
,
Adelson
PD
,
et al.
Meeting report: discussions and preliminary findings on extracellular RNA measurement methods from laboratories in the NIH Extracellular RNA Communication Consortium.
.
J Extracell Vesicles.
2015;
;
4
:
:26533.
.
27.
Hill
AF
,
Pegtel
DM
,
Lambertz
U
,
et al.
ISEV position paper: extracellular vesicle RNA analysis and bioinformatics.
.
J Extracell Vesicles.
2013;
;
2
.
29.
Srinivasan
S
,
Yeri
A
,
Cheah
PS
,
et al.
Small RNA Sequencing across Diverse Biofluids Identifies Optimal Methods for exRNA Isolation.
.
Cell.
2019;
;
177
:
:446.
–
62.e16
.
30.
Hill
AF
,
Pegtel
DM
,
Lambertz
U
,
et al.
ISEV position paper: extracellular vesicle RNA analysis and bioinformatics.
.
J Extracell Vesicles.
2013;
;
2
.
31.
Kappel
A
,
Keller
A
.
miRNA assays in the clinical laboratory: workflow, detection technologies and automation aspects.
.
Clin Chem Lab Med.
2017;
;
55
:
:636.
–
647
.
32.
Zarà
M
,
Amadio
P
,
Campodonico
J
,
et al.
Exosomes in Cardiovascular Diseases.
.
Diagnostics (Basel).
2020;
;
10
:
:E943.
.
33.
Happel
C
,
Ganguly
A
,
Tagle
DA
.
Extracellular RNAs as potential biomarkers for cancer.
.
J Cancer Metastasis Treat.
2020;
;
6
:
:32.
.
34.
Zhou
R
,
Wang
L
,
Zhao
G
,
et al.
Circulating exosomal microRNAs as emerging non-invasive clinical biomarkers in heart failure: Mega bio-roles of a nano bio-particle.
.
IUBMB Life.
2020;
;
72
:
:2546.
–
62
.
35.
Bei
Y
,
Yu
P
,
Cretoiu
D
,
et al.
Exosomes-Based Biomarkers for the Prognosis of Cardiovascular Diseases.
.
Adv Exp Med Biol.
2017;
;
998
:
:71.
–
88
.
36.
Bi
S
,
C
W
,
Y
J
,
et al.
Correlation between serum exosome derived miR-208a and acute coronary syndrome.
.
Int J Clin Exp Med.
2015;
;
8
.
37.
Yang
Y
,
Cai
Y
,
Wu
G
,
et al.
Plasma long non-coding RNA, CoroMarker, a novel biomarker for diagnosis of coronary artery disease.
.
Clin Sci (Lond).
2015;
;
129
:
:675.
–
685
.
38.
Margolis
E
,
Brown
G
,
Partin
A
,
et al.
Predicting high-grade prostate cancer at initial biopsy: clinical performance of the ExoDx (EPI) Prostate Intelliscore test in three independent prospective studies.
.
Prostate Cancer Prostatic Dis.
2021
.
https://doi.org/10.1038/s41391-021-00456-8
.
39.
Singh
A
,
Singh
AK
,
Giri
R
,
et al.
The role of microRNA-21 in the onset and progression of cancer.
.
Future Med Chem.
2021;
;
13
:
:1885.
–
906
.
40.
Dejima
H
,
Iinuma
H
,
Kanaoka
R
,
et al.
Exosomal microRNA in plasma as a non-invasive biomarker for the recurrence of non-small cell lung cancer.
.
Oncol Lett.
2017;
;
13
:
:1256.
–
1263
.
41.
Lacroix
R
,
Judicone
C
,
Poncelet
P
,
et al.
Impact of pre-analytical parameters on the measurement of circulating microparticles: towards standardization of protocol.
.
J Thromb Haemost.
2012;
;
10
:
:437.
–
446
.
42.
Coumans
FAW
,
Brisson
AR
,
Buzas
EI
,
et al.
Methodological Guidelines to Study Extracellular Vesicles.
.
Circ Res.
2017;
;
120
:
:1632.
–
1648
.
43.
Brennan
K
,
Martin
K
,
FitzGerald
SP
,
et al.
A comparison of methods for the isolation and separation of extracellular vesicles from protein and lipid particles in human serum.
.
Sci Rep.
2020;
;
10
:
1039
.
44.
Cointe
S
,
Judicone
C
,
Robert
S
,
et al.
Standardization of microparticle enumeration across different flow cytometry platforms: results of a multicenter collaborative workshop.
.
J. Thromb. Haemost.
2017;
;
15
:
:187.
–
193
.
45.
Coumans
FAW
,
Brisson
AR
,
Buzas
EI
,
et al.
Methodological Guidelines to Study Extracellular Vesicles.
.
Circ Res.
2017;
;
120
:
:1632.
–
1648
.
46.
Marcoux
G
,
Laroche
A
,
Hasse
S
,
et al.
Platelet EVs contain an active proteasome involved in protein processingfor antigen presentation via MHC-I molecules.
.
Blood
2021;
Jul 22.
blood.2020009957.
|