| |
| Med Sci (Paris). 37(12): 1092–1100. doi: 10.1051/medsci/2021201.Les vésicules extracellulaires Définition, séparation, caractérisation Wilfrid Boireau1* and Céline Elie-Caille1** 1Institut FEMTO-ST, UMR 6174 CNRS-Université de Bourgogne Franche-Comté
,
25030Besançon
,
France MeSH keywords: Cellules eucaryotes, Vésicules extracellulaires, Cellules procaryotes |
Vignette (© Guillaume van Niel, Aurélie di Cicco, Graça Raposo, Daniel Levy).
Les vésicules extracellulaires (VE) définissent des particules naturellement produites par les cellules, qui sont délimitées par une bicouche lipidique et ne peuvent se répliquer, car ne contenant pas de noyau fonctionnel. Ces VE circulent et sont retrouvées dans les fluides biologiques : le sang, le liquide céphalo-rachidien, la salive, l’urine, etc. Du fait qu’un consensus n’a pas encore émergé pour définir les marqueurs spécifiques des sous-types de VE, les « exosomes » d’origine endosomale, et les « ectosomes » qui dérivent de la membrane plasmique (microparticules/microvésicules), assigner un type de VE à une voie de biogenèse particulière reste très difficile. Les sous-types de VE sont donc à considérer selon des critères physiques, tels que 1) la taille (
small EV
[sEV], de diamètre inférieur à 200 nm, et
medium/large EV
[m/lEV] dont le diamètre est supérieur à 200 nm), ou la densité (faible, médium ou haute) ; 2) la composition biochimique (expression de marqueurs : VE positives pour CD63 et CD81, ou VE réactives à l’annexine A5
1
) ; ou 3) l’origine cellulaire. Les deux types principaux de VE, exosomes et microvésicules, ne peuvent être totalement séparés et purifiés [
1
].
Parmi les différentes VE, les exosomes trouvent leur origine dans les endosomes des cellules. Les exosomes constituent les VE ayant la plus petite taille. Le compartiment endosomal, duquel ils dérivent, est impliqué dans l’endocytose, une voie qui permet aux cellules d’internaliser des éléments extracellulaires ou membranaires. Cette voie débute par un processus d’invagination de la membrane plasmique. Elle aboutit à la formation de vésicules appelées vésicules d’endocytose qui transitent au sein de la cellule puis fusionnent avec d’autres compartiments cellulaires, les endosomes précoces qui fusionnent ensuite avec les endosomes tardifs. Ces complexes vésiculaires ont alors deux devenirs possibles : soit retourner à la membrane, les molécules endocytées étant alors recyclées ; soit fusionner avec des lysosomes et, dans ce cas, les molécules endocytées seront dégradées. Entre le recrutement des endosomes précoces et celui des endosomes tardifs, la membrane endosomale est invaginée. Cela conduit à l’accumulation de nombreuses petites vésicules intraluminales : on parle de corps multivésiculaires (MVB, pour
multivesicular body
). Ces MVB ont une taille d’environ 500 nm. Ils sont remplis de vésicules intraluminales de tailles comprises entre 50 et 150 nm. Quand les endosomes sont redirigés vers la membrane de la cellule, les vésicules intraluminales sont libérées dans l’espace extracellulaire. On parle alors d’exosomes [
2
].
Regroupant les sEV et les m/lEV, les microvésicules (MV) sont des vésicules sécrétées par bourgeonnement de la membrane plasmique, quel que soit le type de la cellule qui les produit. Les MV les plus décrites sont celles provenant des plaquettes sanguines, de cellules tumorales ou de cellules endothéliales. Ces vésicules ont une taille qui varie de de 50 à 1 000 nm. Leur formation repose sur deux mécanismes : un remaniement des phospholipides membranaires et un réarrangement du cytosquelette de la cellule. Ces MV renferment ainsi une partie du cytoplasme de la cellule. Elles sont donc le reflet de l’état d’activation de leur cellule d’origine, ou de son apoptose ; on parle alors, dans ce dernier cas, de corps apoptotiques et de petites vésicules apoptotiques. |
Les techniques pré-analytiques de séparation, d’isolement et d’enrichissement Les vésicules extracellulaires sont présentes dans l’environnement des cellules et des tissus. Elles participent donc à la complexité des différents milieux biologiques, en particulier des biofluides. Ceux-ci contiennent en effet des complexes macromoléculaires, des agrégats ou des particules, dont les caractéristiques de taille ou de densité recouvrent celles des VE. Cette proximité de structure constitue un verrou à franchir pour séparer et isoler les VE. En raison de leur hétérogénéité de taille, de concentration, et selon leur mode de biogenèse et leur origine cellulaire, la séparation de ces vésicules extracellulaires selon leurs sous-types et les sous-populations de VE, représente un défi majeur. Dans cette revue, nous examinerons les techniques de référence utilisées afin d’isoler les VE au sein d’un échantillon complexe (un surnageant de culture, un biofluide, etc.), les performances et les limites de ces techniques. Nous présenterons également les approches émergentes, issues des travaux les plus récents, qui pourraient devenir à terme les nouvelles techniques de référence. Les techniques séparatives fondées sur la densité
La technique de centrifugation différentielle permet, étape par étape, de séparer les divers éléments constituant un échantillon selon l’accélération
2
(
g
) appliquée, des cellules ou des débris cellulaires jusqu’aux macromolécules, en passant par les vésicules extracellulaires. Pour sédimenter les VE de plus petites tailles, des valeurs de 100 000 à 200 000 x
g
sont nécessaires. Les protocoles de centrifugation différentielle incluent des étapes progressives de fractionnement des échantillons qui permettent de collecter des culots de matériel biologique tout en préservant les surnageants. Ainsi, à partir d’un milieu complexe, pourront être obtenus des culots à 2K, 10K et 100K correspondant, respectivement, à des centrifugations à 2 000 x
g
, 10 000 x
g
et 100 000 x
g
[
3
]. Ce processus global requiert un équipement coûteux et nécessite de longues heures pour le mettre en œuvre dans sa totalité. Il permet,
in fine
, d’obtenir des fractions enrichies de VE, mais celles-ci ne sont pas pures.
Afin de contourner les limitations majeures de l’ultracentrifugation, des stratégies de précipitation des VE, par réduction de leur solubilité sous l’action de polymères hygroscopiques, ont été développées. Elles permettent d’augmenter les rendements d’enrichissement tout en limitant l’utilisation des ultracentrifugeuses [
4
]. Le potentiel de ces techniques, disponibles sous la forme de kits commerciaux, est à relativiser, car la baisse de solubilité induite conduit à la co-précipitation de nombreuses autres entités biologiques, ce qui altère les taux de pureté. Les temps d’incubation restent également très élevés (jusqu’à plusieurs heures selon les kits).
En dépit des différentes limitations évoquées, l’ultracentrifugation et la centrifugation différentielle, de par leur importance comme technique standard en biochimie des protéines, sont encore les techniques les plus communément utilisées pour l’isolement des VE, mais des approches alternatives sont apparues depuis une décennie. Les techniques séparatives fondées sur la taille La chromatographie d’exclusion La chromatographie d’exclusion par la taille (SEC en anglais) est une technique classique de fractionnement d’entités biologiques qui repose sur une séparation selon la taille de l’objet et/ou son volume hydrodynamique. Une phase chromatographique solide, appelée phase stationnaire, de porosité contrôlée, permet de faire varier le trajet d’entités biologiques sous écoulement fluidique. Au grès de l’écoulement au sein d’une colonne chromatographique, un fractionnement s’opère permettant de séparer spatialement et avec une bonne résolution des entités coexistant initialement dans le même échantillon. Le potentiel de la technique est renforcé par l’aspect accordable de la porosité qui offre ainsi un large panel de phases solides pour l’application visée. La séparation des VE des contaminants protéiques est obtenue avec des seuils de séparation inférieurs à 50 nm (les éléments de diamètre inférieur à 50 nm étant retardés dans la phase stationnaire, les VE sont recueillies plus rapidement dans la phase liquide). Cette technique, aux contraintes morpho-mécaniques faibles par rapport à l’ultracentrifugation, offre l’avantage de préserver la structure des VE. Une chromatographie d’exclusion différentielle, qui repose sur une succession d’étapes de fractionnement de porosité modulaire, peut être envisagée afin d’isoler des sous-populations séparées en fonction de leur taille au sein d’un même échantillon. La limite de cette méthode réside cependant dans la dilution graduelle de l’échantillon à chaque étape. De plus, la chromatographie d’exclusion ne permet pas de séparer les VE de contaminants biologiques ayant une taille équivalente. Cette technique souffre également d’une faible résolution séparative des sous-types de VE et est très dépendante de l’utilisateur. Les techniques de filtration Différentes techniques de filtration sont développées pour isoler et concentrer les VE, en particulier l’ultrafiltration par centrifugation (UF) et la filtration par flux tangentiel (TFF). La nano-porosité des membranes utilisées permet d’éliminer les contaminants des VE grâce à un seuil de coupure fonction de leur masse moléculaire (en kDa). La technique de TFF présente l’avantage de limiter le colmatage des nano-pores des membranes. L’UF séquentielle, qui consiste en une succession d’étapes de filtration avec réduction progressive du seuil de coupure, peut permettre l’isolement et l’enrichissement de VE à partir de fluides biologiques complexes. Le fractionnement par voie fluidique
Le fractionnement par couplage flux-force (ou
flow field-flow fractionation
, FFF) s’appuie sur la conjonction de deux phénomènes induits simultanément et orthogonalement au sein d’une microstructure : un écoulement laminaire établi au sein d’une chambre (ou canal) microfluidique, et un flux exerçant une force latérale de nature hydrodynamique traversant un mur poreux. La séparation des entités biologiques au sein de la chambre fluidique ou du microcanal s’opère de façon différentielle en fonction de leurs coefficients de diffusion. Les VE de dimension importante subissent les forces de frictions exercées à proximité de la paroi poreuse (appelée en ce cas mur d’accumulation) et les VE les plus petites, pour lesquelles le mouvement brownien est le moins contrarié, se retrouvent distribuées dans le volume du canal, avec une vitesse de déplacement plus grande. Cette technique s’avère être d’une grande modularité, offrant des possibilités accrues de paramétrage de tri. Elle peut être couplée en ligne à des techniques optiques de caractérisation des nanoparticules en solution.
Les techniques séparatives fondées sur les charges La chromatographie par échange d’ions est la principale technique qui utilise l’état de charge à la surface des VE, apporté par les composants membranaires (les lipides) qui sont chargés négativement. Différents supports anioniques (des billes, des gels, des résines) sont utilisés comme phases solides (ou stationnaires) retenant les vésicules chargées. Après incubation, ou passage à travers une colonne, les VE interagissent avec ces phases solides et s’y lient. Après des étapes de lavage, les VE liées sont éluées par l’action de solutions aqueuses capables de rompre les interactions ioniques établies entre les VE et la phase solide. Si cette technique présente l’avantage de ne pas engendrer de contraintes physiques sur les VE en comparaison avec la filtration ou l’ultracentrifugation, il faut s’assurer que les conditions d’élution (pouvant s’apparenter à un stress chimique) n’impactent pas l’intégrité des structures des VE ni leurs fonctions biochimiques. Enfin une telle approche propose des opportunités de changement d’échelle dans une perspective de bio-production. Elle s’avère en revanche peu sélective des VE dans un milieu biologique très complexe contenant des éléments également chargés, en particulier le sang ou le plasma. Elle est également peu discriminante des diverses sous-populations de VE.
Des avancées récentes ouvrent une voie originale de miniaturisation des techniques de piégeage et de traitement
in situ,
en particulier les techniques d’électrophorèse appliquées aux VE après leur lyse, afin d’étudier le cargo (macro)moléculaire qu’elles contiennent [
5
].
Les techniques séparatives fondées sur l’affinité
Les techniques décrites précédemment ne proposent pas de stratégies d’isolement en fonction du mode de biogenèse des VE ou de leur origine cellulaire. Il s’agit en effet de méthodes utilisant les caractéristiques physico-chimiques des VE, quelle que soit leur nature. C’est la raison pour laquelle les techniques séparatives fondées sur le principe de la reconnaissance spécifique entre un ligand (naturel ou synthétique) et sa cible biologique, ici une entité macro-biomoléculaire exprimée à la surface des VE, sont parmi les plus utilisées. L’immunoaffinité est largement employée. Elle utilise des anticorps spécifiques qui ciblent avec une très forte sélectivité les protéines membranaires présentes sur les VE. Les principales cibles appartiennent à la superfamille des tétraspanines
3
, en particulier CD9, CD63 et CD81, qui sont enrichies dans les sVE (exosomes et petites microvésicules) [
6
,
7
]. L’origine cellulaire des VE peut également être révélée par la présence dans leur membrane de nombreuses protéines issues de la cellule qui les a produites, comme la glycoprotéine EpCAM (
epithelial cell adhesion molecule
) ou des protéines de choc thermique HSP (
heat shock proteins
), ce qui ouvre des perspectives de validation de sous-populations de VE potentiellement indicatrices de maladies [
8
].
Dans cette approche, les ligands sélectionnés sont immobilisés sur une phase solide (principalement des billes, des microsphères et autres supports solides), puis incubés en présence de l’échantillon. Les VE interagissant avec ces ligands sont immobilisées, séparées et isolées des autres constituants. L’étape clé conditionnant les phases analytiques concerne la libération des VE immobilisées, opérée par l’utilisation de tampons d’élution ou par compétition (avec l’antigène libre en solution), qui n’offrent pas encore, à ce jour, toutes les garanties sur l’intégrité structurelle et fonctionnelle des VE. Certaines études s’accommodent du support immuno-chromatographique pour analyser le cargo macro-moléculaire qu’elles contiennent, d’autres couplent le dispositif d’immunoaffinité avec un module de bio-détection intégré [
9
].
Ces techniques conjuguant rapidité, simplicité et spécificité, offrent des perspectives prometteuses pour des applications cliniques fondées sur l’utilisation de sous-populations de VE [
10
]. Les principaux inconvénients résident dans leur coût et la difficulté à utiliser l’éluat pour des études fonctionnelles. L’utilisation de récepteurs synthétiques, tels que les aptamères
4
, pourrait permettre de surmonter ces limites.
De très nombreuses techniques séparatives sont donc disponibles pour purifier les VE, chacune d’entre elles présentant des avantages et des inconvénients qu’il est important d’évaluer comparativement [
11
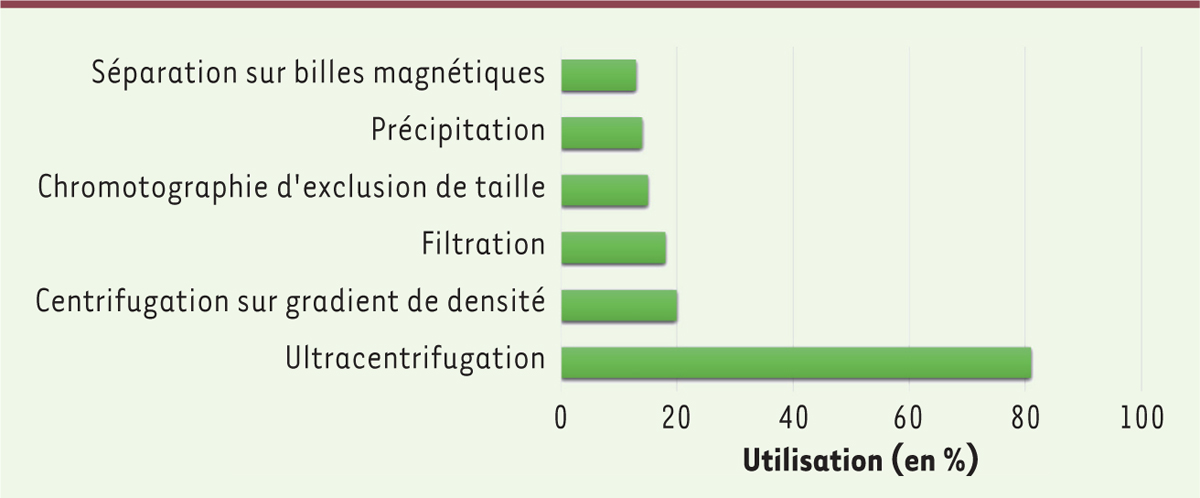
]. Une enquête internationale, réalisée auprès de la communauté scientifique travaillant sur les VE, a établi la liste des techniques les plus utilisées
(
Figure 1
)
et a permis de mettre en évidence l’utilisation majoritaire de l’ultracentrifugation dans les laboratoires [
12
]. À ce jour, il n’existe pas de consensus sur les protocoles d’isolement des VE tant les techniques sont nombreuses et les ressources biologiques variées. Gardiner
et al.
montre en effet que 59 % des équipes utilisent des approches combinées, dont les protocoles peuvent associer jusqu’à six techniques différentes, pour parvenir, à partir des biofluides les plus complexes à un isolement adapté à leurs investigations. L’objectif d’une standardisation des méthodes pré-analytiques est donc pertinent, en vue de l’utilisation des VE en clinique et, en particulier, pour le diagnostic et le suivi thérapeutique de patients. Cela constitue un défi majeur dans le cadre des études fonctionnelles où la moindre altération de la structure et/ou de la composition des VE peut rendre caduque toute étude.
 | Figure 1.
Les différentes techniques d’isolement des vésicules extracellulaires (VE).
L’utilisation des techniques par les laboratoires est indiquée en % (adapté de [
12
]).
|
|
Les méthodes de caractérisation des VE L’engouement de la recherche pour les VE, combiné aux défis qu’elle pose, a entraîné le développement et la mise en œuvre d’une grande variété d’approches et de techniques pour quantifier ou caractériser ces vésicules. Aucune de ces techniques, à elle seule, ne donne cependant l’ensemble des informations permettant de caractériser les VE et leurs sous-populations.
L’hétérogénéité inhérente aux VE, qui se traduit par la diversité de leurs propriétés biochimiques et physiques, empêche l’obtention d’analyses globales fiables et reproductibles à partir d’un mélange (
bulk
). Les méthodes de détection et de caractérisation des VE sont donc nécessaires individuellement et généralement utilisées systématiquement en complément des autres méthodes, plus rapides, mais non ciblées.
Les VE peuvent être caractérisées en fonction de critères métrologiques et physico-chimiques : leur taille (distribution de tailles et diamètre moyen), leur concentration, leur charge, leur morphologie et leur structure. Des techniques biochimiques et spectroscopiques permettent en outre de définir, de façon qualitative et potentiellement quantitative, leur composition et d’identifier les molécules qu’elles contiennent.
Les méthodes récentes permettant cette identification qui sont les plus utilisées sont l’
immunoblotting
spécifique de protéines, qui permet de confirmer l’origine des VE, la microscopie électronique à transmission (TEM), pour confirmer leur structure, et l’analyse de suivi des nanoparticules (NTA), pour quantifier leur nombre et leur distribution de taille dans un volume d’échantillon [
13
]. La cytométrie en flux a également été, durant plusieurs années, la méthode de référence pour caractériser les vésicules, bénéficiant alors de sa notoriété et de son efficacité dans la qualification des sous-types cellulaires. La cytométrie « directe », sans calibration dédiée ni utilisation de billes, reste néanmoins limitée aux grandes vésicules, de taille supérieure à 200 nm.
Le fort potentiel des VE en recherche (bio)médicale et les limites des outils analytiques existants ont donc incité la communauté scientifique à développer de nouvelles méthodes pour la caractérisation, la discrimination et la quantification des VE. Contenu moléculaire et phénotypage
L’un des moyens les plus simples de caractériser les échantillons biologiques est de déterminer leur composition protéique. Pour les VE, la teneur totale en protéines peut facilement être évaluée à l’aide de dosages colorimétriques (acide bicinchoninique [BCA]
5,
ou Bradford
6
) après purification et extraction. Bien que fréquemment utilisés, ces dosages nécessitent de disposer d’échantillons de VE hautement purifiés, puisque les éventuels contaminants protéiques compromettent évidemment la précision de la mesure. Les méthodes biochimiques les plus couramment utilisées sont des analyses protéiques conventionnelles fondées sur la reconnaissance par des anticorps spécifiques (
immunoblotting assay
) ou des analyses qui reposent sur la capture de VE spécifiques par immuno-affinité (
immunosorbent assay
).
L’
immunoblotting
nécessite la lyse préalable des VE purifiées afin de libérer les protéines qu’elles contiennent. L’extrait obtenu sera ensuite analysé soit après dépôt en spot sur une membrane (
dot-blot assay
), soit après séparation des protéines contenues dans l’extrait par électrophorèse sur gel de polyacrylamide (SDS-PAGE) suivi de leur transfert sur une membrane (
western-blot assay
). Dans les deux cas, les protéines seront ensuite détectées par des anticorps (couplés à une enzyme ou à un fluorochrome) spécifiques de la ou des protéine(s) d’intérêt. L’
immunoblotting
est principalement utilisé pour démontrer la présence de protéines connues pour être associées aux VE (CD9, CD63, Alix [
ALG-2-interacting protein X
], Tsg101 [
tumor susceptibility gene 101
]). Pour les VE isolées à partir de biofluides (urine, plasma, etc.), l’ISEV (
International Society for Extracellular Vesicles
) [
1
] recommande néanmoins une quantification supplémentaire des contaminants protéiques couramment co-isolés avec les VE (apolipoprotéines, albumine, etc.) afin d’évaluer leur pureté. Il est à noter que la cytométrie en flux conventionnelle utilise très souvent des billes couvertes d’anticorps pour piéger et ainsi détecter les VE, uniquement
via
leurs protéines membranaires exposées en surface.
Même si les techniques d’
immunoblotting
et d’analyse par cytométrie en flux utilisant des billes sont des méthodes rapides et simples, elles ne sont que semi-quantitatives et présentent les limites d’un essai «
en bulk
» (c’est-à-dire sur un mélange de vésicules) : en effet, elles ne fournissent pas d’informations sur la teneur en protéines à l’échelle des VE individuelles et ne discriminent donc pas les sous-populations de VE présentes au sein de l’échantillon.
L
’immunosorbent assay
. Ce type d’essais, dérivés des tests classiques immuno-enzymatiques (ELISA,
enzyme-linked immunosorbent assay
), utilisent des anticorps spécifiques des protéines membranaires des VE. Les vésicules sont généralement capturées sur une surface recouverte d’anticorps ou de mélanges d’anticorps, ciblant ainsi plusieurs sous-populations de VE : la technique @MACSPlex Exosome kit, développée par
Miltenyi
[
14
] propose un kit composé de 37 anticorps différents pour la capture des VE dont les anticorps anti-CD9, anti-CD63 et anti-CD81. Les protéines membranaires d’intérêt présentes à la surface des VE capturées, sont ensuite détectées à l’aide d’anticorps marqués (soit directement, soit indirectement, avec une enzyme) idéalement spécifiques d’un épitope différent de celui reconnu par l’anticorps de capture. L’utilisation d’anticorps de capture et de détection implique que seul un sous-ensemble spécifique de VE, exprimant à leur surface les protéines ciblées, est quantifié et caractérisé [
1
,
3
].
Les analyses
multiomiques
. De nombreuses études cherchant à caractériser les fonctions des VE ou se focalisant sur leur identification comme biomarqueurs, portent sur le profil macromoléculaire à haute résolution de leur contenu (protéines, ARN, lipides), en utilisant des approches de protéomique, de lipidomique, de transcriptomique et de métabolomique. Ces différentes approches de -omiques sont fondamentales pour comprendre la composition, la biogenèse et la fonction des VE. La combinaison de multiples mesures de -omiques permet ainsi d’obtenir une vision beaucoup plus approfondie de la composition et de la fonctionnalité des VE.
Pour identifier ces constituants, par rapport à la technique de LC-MS/MS conventionnelle (chromatographie liquide couplée à de la spectrométrie de masse en tandem), les plates-formes analytiques multidimensionnelles, telles que la spectrométrie de mobilité ionique (
ion mobility spectrometry
, IMS)-MS/MS, qui combine chromatographie liquide, spectrométrie de mobilité ionique et spectrométrie de masse en tandem, offrent des améliorations considérables en termes de résolution, de gamme dynamique (ce qui étend le spectre d’analyse), de nombre d’analytes détectés, et de qualité des spectres de masse obtenus [
15
,
16
].
Métrologie et concentration Les méthodes les plus courantes pour la détermination de la taille des VE et leur concentration dans un échantillon utilisent des techniques de lectures optiques ou électriques indirectes.
La
nanoparticles tracking analysis
. La taille d’une particule détermine la vitesse à laquelle elle diffuse en solution (celle-ci reposant sur le mouvement brownien). Cette relation entre vitesse et taille permet d’estimer le coefficient de diffusion et la taille des VE, observées individuellement, en analysant leurs trajectoires. Cette approche est connue sous le nom de « suivi des particules uniques » (ou SPT) et constitue la base d’une méthode d’analyse très utilisée et appelée
nanoparticle tracking analysis
(ou NTA).
Cette méthode est fondée sur l’enregistrement par vidéo des mouvements browniens des particules en solution dans un canal ou une chambre microfluidique. Les particules sont révélées par la lumière diffusée (Sc-NTA) ou par la fluorescence émise (Fl-NTA). En analysant un grand nombre de particules, il est possible d’en estimer la concentration et la distribution métrologique, même dans des échantillons polydispersés. Malgré certaines limitations dues notamment à un temps d’acquisition court et à une mesure réduite à un plan focal, la méthode NTA offre une évaluation rapide de la distribution en taille et de la concentration des VE [
17
].
La technique
tunable resistive pulse sensing
(tRPS) détecte et qualifie des nanoparticules individuelles par mesure du changement de courant électrique lors de leur passage à travers un nanopore. L’intensité de la baisse du courant électrique (événement de blocage) peut être reliée au volume de la particule [
18
]. En l’absence d’étapes pré-analytiques, cette méthode est relativement difficile à appliquer pour l’analyse des VE en milieux biologiques complexes en raison de la présence d’autres éléments dans le milieu qui peuvent entraîner une obstruction du pore, ou contribuer également au signal enregistré. En plus de mesurer la taille et la concentration des VE, la tRPS peut être utilisée pour des mesures précises de la charge de surface (potentiel zêta) des VE, par la détermination du temps passé par chaque vésicule dans le nanopore en fonction de la pression et de la tension appliquées. Cette fonctionnalité est notamment utilisée dans la conception et l’utilisation des VE pour des applications thérapeutiques potentielles, la charge de surface des VE jouant un rôle important dans leurs propriétés pharmacocinétiques [
19
].
La sensibilité et la précision de la tRPS en font une technique d’intérêt pour étudier les solutions de VE purifiées ou enrichies, mais des efforts restent nécessaires pour standardiser les protocoles d’analyse par cette approche. Morphologie et structure L’imagerie haute résolution, par microscopie électronique en transmission (TEM et cryoTEM) ou microscopie de force atomique (AFM), permet de déterminer la morphologie et la métrologie des VE avec une résolution nanométrique.
Cependant, la principale limitation de l’utilisation de la microscopie électronique pour des objets biologiques, tels que les VE, réside dans la nécessité d’un vide pour réaliser l’exploration, ce qui impose la fixation et le séchage de l’échantillon. Une telle préparation rend difficile la transposition des structures que l’on observe aux morphologies réelles des objets. Afin d’éviter cette déshydratation de l’échantillon, la technique de cryoTEM est la plus employée pour la caractérisation des VE [
20
]. Cette technique repose sur l’imagerie d’un échantillon vitrifié, produit par une congélation flash (à une température inférieure à – 100 °C), d’un film ultrafin d’échantillon de VE. Elle permet une imagerie haute résolution des objets biologiques dans leur état natif. Elle est très utilisée pour déterminer l’ultrastructure des VE. L’immunomarquage des vésicules par des nanoparticules d’or biofonctionnalisées permet en outre d’identifier les sous-populations spécifiques de VE et de les discriminer des autres particules présentes dans un échantillon biologique complexe.
Le faible nombre de VE analysées par la microscopie électronique rend cependant souvent impossible une caractérisation qui soit représentative d’un échantillon complexe et hétérogène. Pour révéler cette hétérogénéité de taille, l’initiative
minimal information for studies of extracellular vesicles
de l’ISEV [
1
] suggère d’analyser un nombre suffisant d’images de grand champ, accompagnées d’images de surface plus réduite, révélant avec une grande résolution les VE individuelles.
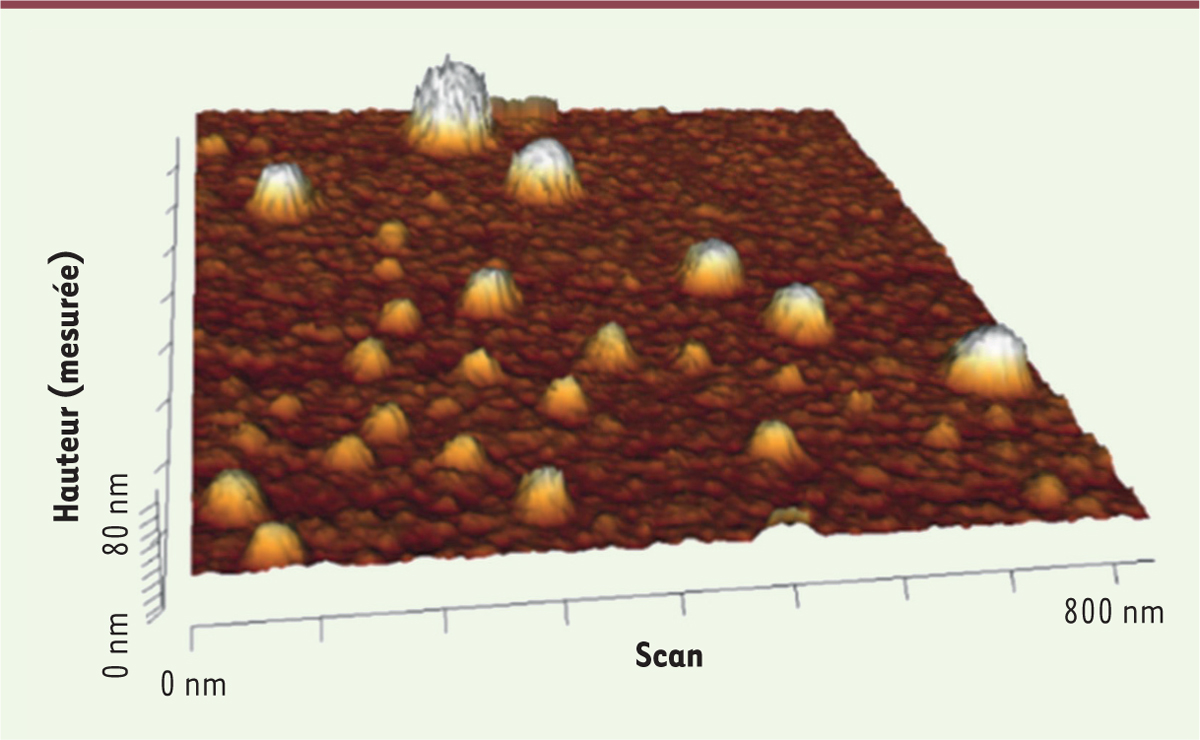
La microscopie de force atomique (AFM) se présente comme une alternative aux approches optiques et aux techniques de diffraction électronique pour l’étude des VE. Cette technique utilise une pointe souple et fine qui scanne l’échantillon déposé sur un support, ligne par ligne, en ajustant la distance entre la pointe et les éléments présents, grâce à une boucle de rétrocontrôle. Elle permet de caractériser la topographie de l’échantillon et de relever des informations morphomécaniques
(
Figure 2
)
. Les VE peuvent être examinées après avoir été déposées sur un substrat atomiquement plat, ou après avoir été capturées sur un substrat spécifiquement fonctionnalisé par des anticorps, des peptides ou des aptamères, pour caractériser les diverses sous-populations [
21
,
22
]. Par sa capacité à quantifier et à sonder simultanément la structure, la biomécanique et le contenu biomoléculaire des VE au sein d’échantillons biologiques complexes, sans besoin de prétraitement, de marquage, ni de déshydratation, l’AFM est désormais de plus en plus employée afin de caractériser les VE de façon fine et multiparamétrique, dans des conditions physiologiques de température et de milieu [
23
].
 | Figure 2.
Image de microscopie à force atomique de VE plaquettaires immunocapturées sur une puce recouverte d’un anticorps anti-CD41.
Chaque objet piégé sur le support fonctionnalisé par l’anticorps apparaît en 3 dimensions, le scan consistant en un profil topographique de l’immunopuce (Elie-Caille
et al.
, résultats non publiés).
|
Approches combinées et émergentes La plupart des développements se concentrent sur la combinaison des principes de l’immuno-marquage et de l’immuno-capture, avec des méthodes physiques avancées de détection des VE. Certaines de ces approches s’intéressent à l’identification de VE individuelle afin d’obtenir le maximum de données fiables à l’échelle du nano-objet. D’autres consistent plutôt à proposer des méthodes globales qui soient abordables et fiables pour une utilisation en clinique. Méthodes optiques
Les marqueurs lipidiques ou protéiques fluorescents, associées aux améliorations des configurations optiques et des sources lumineuses, permettent désormais, en systèmes microfluidiques, de tracer des VE et de les phénotyper, au moins partiellement, en utilisant notamment des approches de
fluorescence-based single particle tracking
(SPT), ou de
fluorescence correlation spectroscopy
(FCS).
Plusieurs techniques émergentes utilisent également la résonance plasmonique de surface (SPR). Cette technique permet de détecter avec une haute sensibilité, sans nécessité de marquage et possiblement en milieu biologique, des VE et leurs sous-populations,
via
leur interaction avec la surface métallique du dispositif biofonctionnalisée avec des ligands moléculaires. La SPR a été utilisée pour quantifier les VE dérivées de tumeurs grâce à leur reconnaissance par des ligands spécifiques de protéines qu’elles expriment. La méthode permet également de détecter des nano-objets uniques, lorsqu’elle utilise des substrats nano-structurés qui génèrent des plasmons de surface localisés (
local SPR
).
La spectroscopie Raman exaltée par la surface (SERS), dérivée de la spectroscopie Raman, apparaît comme une méthode de choix pour l’analyse biochimique de biomarqueurs faiblement exprimés par les VE. Plusieurs immuno-essais par SERS de type sandwich (un anticorps servant de capteur et un autre révélant la molécule ou l’élément fixé) ont été rapportés. Ils consistent à concentrer les VE par immuno-capture sur des billes magnétiques, puis à les détecter à l’aide de nano-sondes SERS immuno-marquées. Cette stratégie a permis de développer des tests multiplexés avec une sensibilité de quelques dizaines de VE par µl. L’imagerie SERS couplée à des méthodes de tri (par diélectrophorèse, par exemple) rend possible une analyse haut débit de la composition des VE [
24
].
La détection optique et le comptage numérique des VE individuelles sont quant à eux fondés sur l’imagerie interférométrique des VE capturées sur un substrat de silicium biofonctionnalisé. Cette technique permet d’estimer la taille de la VE grâce au contraste que l’on observe. Cette plate-forme, appelée
single particle interferometric reflectance imaging sensor
(SP-IRIS), a ainsi permis, en utilisant les marqueurs abondants CD9, CD63 et CD81, de multiplexer l’analyse et de détecter notamment la présence de VE exprimant un marqueur neuronal, CD171, dans le liquide céphalorachidien chez l’homme [
25
].
Méthodes électrochimiques
Le principal avantage des méthodes électrochimiques par rapport aux approches immunologiques, repose sur leurs limites de détection qui sont très basses. Elles permettent ainsi l’utilisation de petits volumes d’échantillons et de détecter de faibles concentrations de VE dans des échantillons fortement dilués. Cette capacité de détection réduit l’impact des contaminants (complexes protéiques, lipoprotéines) au cours de l’analyse des échantillons complexes, comme le plasma. Cette biodétection par des biocapteurs électrochimiques peut être facilement intégrée au sein de systèmes miniaturisés, ce qui pourrait favoriser leur utilisation en diagnostic clinique. Des méthodes innovantes de capture et de révélation ont également été développées pour améliorer la sensibilité de détection, jusqu’à des centaines de VE par millilitre. Des VE de cellules de cancer du sein, retrouvées à une concentration de 100 particules/ml ont été ainsi détectées par interaction avec des électrodes biofonctionnalisées avec un anticorps anti-CD81, par
differential pulse voltametry
(DPV) et par
electrochemical impedance spectroscopy
(EIS). Des méthodes électrochimiques, appelées
electric field-induced release and measurement
(EFIRM) permettent également, après piégeage des VE sur billes fonctionnalisées, de détecter et d’analyser, après la lyse de leur membrane, leur contenu intravésiculaire [
26
].
Méthodes sur papier
Plusieurs équipes explorent les possibilités de la détection des VE sur papier. Ces procédures sont simples, rapides, peu coûteuses et largement disponibles, ce qui en fait des candidates idéales pour les applications dans le domaine clinique. Oliveira-Rodriguez
et al.
ont ainsi développé un immuno-dosage à flux latéral rapide dans lequel une membrane de nitrocellulose contenant une bande « essai » d’anticorps anti-CD9 et anti-CD81 pour la capture des VE est brièvement incubée dans une solution contenant un mélange de VE et de nanoparticules (NP) d’or conjuguées à un anticorps anti-CD63. Les complexes formés entre les NP et les VE se lient à la bande anti-CD9/anti-CD81, alors que les NP d’or restées libres continuent de migrer par capillarité. La forte concentration de NP liées aux VE et immobilisées sur la bande « essai » entraînent l’apparition d’une bande colorée facilement détectable à l’œil. Cette approche présente une sensibilité modérée avec une limite de détection de 10
9
VE/ml [
27
].
|
L’hétérogénéité de taille, de composition et d’origine cellulaire des vésicules extracellulaires (VE), combinée à la difficulté de les distinguer d’autres éléments pouvant interférer avec leur détection, tels que les lipoprotéines ou les virus, rendent difficiles, encore aujourd’hui, la normalisation des approches biochimiques et physiques pour leur caractérisation. Les biofluides complexes accumulent également des VE de diverses origines cellulaires ou tissulaires. Malgré la grande variété de méthodes développées et mises en œuvre, chacune de ces techniques a son potentiel propre et des performances différentes en termes de gamme dynamique, de précision, de débit et d’application pour l’analyse de paramètres spécifiques des VE [
28
]. Des approches innovantes ultrasensibles et intégrant de multiples étapes (séparation, sélection, signature spectrale et analyse du contenu vésiculaire après lyse) appliquées sur des petits volumes sur puce (
lab-on-chip
) ouvrent de nouvelles perspectives dans le domaine des biopsies liquides, du
biomonitoring
et de la médecine de précision.
L’engouement de ce domaine de recherche auprès d’une communauté scientifique grandissante, qui se traduit par une expansion considérable des travaux de recherche et leur concrétisation industrielle depuis une décennie ne doit pas occulter la nécessité de mettre en place une méthodologie d’étude adaptée à ces nanovésicules. L’investigation à cette échelle nanométrique nécessitera la mise en place d’outils de standardisation issus des sciences dures qui devront pénétrer la biologie et la médecine. C’est à ce prix que ce domaine tendra vers une fiabilité améliorée des analyses et une reproductibilité dans l’investigation des biofluides. |
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Théry
C
,
Witwer
KW
,
Aikawa
E
,
et al.
Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines.
.
J Extracell Vesicles.
2018;
23;
7
(
(1)
) :
:1535750.
.
2.
Stoorvogel
W
,
Kleijmeer
MJ
,
Geuze
HJ
,
Raposo
G
.
The biogenesis and functions of exosomes.
.
Traffic.
2002;
;
3
:
(5)
:321.
–
330
.
3.
Kowal
J
,
Arras
G
,
Marina ColomboKowal
M
et al.
Proteomic comparison defines novel markers to characterize heterogeneous populations of extracellular vesicle subtypes.
.
Proc Natl Acad Sci U S A.
2016;
;
113
:
(8)
:E968.
–
E977
.
4.
García-Romero
N
,
Madurga
R
,
Rackov
G
et al.
Polyethylene glycol improves current methods for circulating extracellular vesicle-derived DNA isolation.
.
J Transl Med.
2019;
;
17
:
:75.
.
5.
Chen
J
,
Xu
Y
,
Wang
X
et al.
Rapid and efficient isolation and detection of extracellular vesicles from plasma for lung cancer diagnosis.
.
Lab Chip.
2019;
;
19
:
(3)
:432.
–
443
.
6.
Andreu
Z
,
Yáñez-Mó
M
.
Tetraspanins in extracellular vesicle formation and function.
.
Front Immunol.
2014;
;
5
:
:442.
.
7.
Mathieu
M
,
Névo
N
,
Mabel Jouve
M
,
et al.
Specificities of exosome versus small ectosome secretion revealed by live intracellular tracking of CD63 and CD9.
.
Nat Commun.
2021;
;
12
(
(1)
) :
:4389.
.
8.
Cordonnier
M
,
Chanteloup
G
,
Isambert
N
et al.
Exosomes in cancer theranostic : Diamonds in the rough.
.
Cell Adh Migr.
2017;
;
11
:
(2)
:151.
–
163
.
9.
Zhao
W
,
Zhang
L
,
Ye
Y
,
et al.
Microsphere mediated exosome isolation and ultra-sensitive detection on a dielectrophoresis integrated microfluidic device.
.
Analyst.
2021;
;
146
(
(19)
) :
:5962.
–
72
.
10.
Liangsupree
T
,
Multia
E
,
Riekkola
ML
.
Modern isolation and separation techniques for extracellular vesicles.
.
J Chromatogr A.
2021;
;
1636
:
:461773.
.
11.
Serrano-Pertierra
E
,
Oliveira-Rodríguez
M
,
Rivas
M
et al.
Characterization of Plasma-Derived Extracellular Vesicles Isolated by Different Methods: A Comparison Study.
.
Bioengineering (Basel).
2019;
;
6
:
(1)
:8.
.
12.
Gardiner
C
,
Di Vizio
D
,
Sahoo
S
et al.
Techniques used for the isolation and characterization of extracellular vesicles: results of a worldwide survey.
.
J Extracell Vesicles.
2016;
;
5
:
:32945.
.
13.
Hartjes
TA
,
Mytnyk
S
,
Jenster
GW
et al.
Extracellular Vesicle Quantification and Characterization: Common Methods and Emerging Approaches.
.
Bioengineering (Basel).
2019;
;
6
(
(1)
):
:7.
.
14.
Koliha
N
,
Wiencek
Y
,
Heider
U
et al.
A novel multiplex bead-based platform highlights the diversity of extracellular vesicles.
.
J Extracell Vesicles.
2016;
;
5
:
:29975.
.
15.
Baker
ES
,
Livesay
EA
,
Orton
DJ
et al.
An LC-IMS-MS platform providing increased dynamic range for high-throughput proteomic studies.
.
J Proteome Res.
2010;
;
9
(
(2)
):
:997.
–
1006
.
16.
Rainville
PD
,
Wilson
ID
,
Nicholson
JK
et al.
Ion mobility spectrometry combined with ultra performance liquid chromatography/mass spectrometry for metabolic phenotyping of urine: Effects of column length, gradient duration and ion mobility spectrometry on metabolite detection.
.
Anal Chim Acta.
2017;
;
982
:
:1.
–
8
.
17.
Dragovic
RA
,
Gardiner
C
,
Brooks
AS
et al.
Sizing and phenotyping of cellular vesicles using Nanoparticle Tracking Analysis.
.
Nanomedicine.
2011;
;
7
(
(6)
):
:780.
–
788
.
18.
Weatherall
E
,
Willmott
GR
.
Applications of tunable resistive pulse sensing.
.
Analyst.
2015;
;
140
(
(10)
):
:3318.
–
3334
.
19.
Charoenviriyakul
C
,
Takahashi
Y
,
Morishita
M
et al.
Role of Extracellular Vesicle Surface Proteins in the Pharmacokinetics of Extracellular Vesicles.
.
Mol Pharm.
2018;
;
15
(
(3)
):
:1073.
–
1080
.
20.
Brisson
AR
,
Tan
S
,
Linares
R
et al.
Extracellular vesicles from activated platelets: a semiquantitative cryo-electron microscopy and immuno-gold labeling study.
.
Platelets.
2017;
;
28
(
(3)
):
:263.
–
271
.
21.
Hardij
J
,
Cecchet
F
,
Berquand
A
et al.
Characterisation of tissue factor-bearing extracellular vesicles with AFM : comparison of air-tapping-mode AFM and liquid Peak Force AFM.
.
J Extracell Vesicles.
2013;
;
2
:
:21045.
.
22.
Jørgensen
M
,
Bæk
R
,
Pedersen
S
et al.
Extracellular Vesicle (EV) Array: microarray capturing of exosomes and other extracellular vesicles for multiplexed phenotyping.
.
J Extracell Vesicles.
2013;
;
2
:
:20920.
.
23.
Malenica
M
,
Vukomanovi´c
M
,
Kurtjak
M
,
et al.
Perspectives of Microscopy Methods for Morphology Characterisation of Extracellular Vesicles from Human Biofluids.
.
Biomedicines.
2021;
;
9
(
(6)
) :
:603.
.
24.
Ertsgaard
CT
,
Wittenberg
NJ
,
Klemme
DJ
et al.
Integrated Nanogap Platform for Sub-Volt Dielectrophoretic Trapping and Real-Time Raman Imaging of Biological Nanoparticles.
.
Nano Lett.
2018;
;
18
:
:5946.
–
5953
.
25.
Daaboul
GG
,
Gagni
P
,
Benussi
L
et al.
Digital Detection of Exosomes by Interferometric Imaging.
.
Sci Rep.
2016;
;
6
:
:37246.
.
26.
Tu
M
,
Wei
F
,
Yang
J
,
Wong
D
.
Detection of exosomal biomarker by electric field-induced release and measurement (EFIRM).
.
J Vis Exp.
2015;
;
95
:
:52439.
.
27.
Oliveira-Rodríguez
M
,
López-Cobo
S
,
Reyburn
HT
et al.
Development of a rapid lateral flow immunoassay test for detection of exosomes previously enriched from cell culture medium and body fluids.
.
J Extracell Vesicles.
2016;
;
5
:
:31803.
.
28.
Maas
SL
,
de Vrij
J
,
van der Vlist
EJ
,
et al.
Possibilities and limitations of current technologies for quantification of biological extracellular vesicles and synthetic mimics.
.
J Control Release.
:201.
.
|