| |
| Med Sci (Paris). 37(11): 1073–1076. doi: 10.1051/medsci/2021168.Un nouveau modèle pour caractériser l’infection par le SARS-CoV-2 et cribler rapidement des molécules thérapeutiques L’épithélium respiratoire humain Wassim Ouchetto,1a Coline Moulin,1b and Pierre-Gabriel Roche1c 1École normale supérieure de Lyon, Département de biologie, Master biologie
,
Lyon
,
France MeSH keywords: Bronches, COVID-19, Cellules épithéliales, Humains, Nez, Muqueuse respiratoire, SARS-CoV-2 , virologie, diagnostic, thérapie |
Le SARS-CoV-2 (
severe acute respiratory syndrome-coronavirus-2)
est un virus de la famille des
Coronaviridae
et du genre Betacoronavirus, tout comme le SARS-CoV-1 et le MERS-CoV (
middle east respiratory syndrome
-
coronavirus
) qui ont tous deux provoqué des épidémies au cours des deux dernières décennies [
1
]. C’est en décembre 2019 que le SARS-CoV-2 fait son apparition dans la ville de Wuhan en République populaire de Chine, puis se propage rapidement sur l’ensemble du globe. Jusqu’à aujourd'hui, en 2021, le virus continue de bouleverser la vie de milliards de personnes, alors même que des vaccins sont commercialisés de façon massive.
Le SARS-CoV-2 est un virus enveloppé, dont le génome à ARN positif simple brin de 29,9 kb est protégé par une nucléocapside hélicoïdale [
2
]. L’entrée virale implique la glycoprotéine d’enveloppe Spike, exprimée par le virus, et la protéase à sérine TMPRSS2 (
transmembrane serine protease 2
), exprimée par les cellules épithéliales. TMPRSS2 permet le clivage de Spike fixée à son récepteur cellulaire, l’ACE2 (
angiotensin converting enzyme 2
), ce qui conduit alors à la pénétration du virus dans la cellule cible. Cette protéine est exprimée par les cellules de nombreux tissus et organes, tels que les épithéliums nasaux et bronchiques, mais aussi les cellules du système digestif ou les cellules cardiaques [
2
]. En raison de ce large spectre de tissus cibles potentiels, l’infection par le SARS-CoV-2 est associée à une grande diversité de symptômes. Alors que sa transmission implique surtout les voies respiratoires, ce virus provoque ainsi non seulement des symptômes de type grippaux (toux, fièvre, difficultés respiratoires, etc.), mais aussi des diarrhées, des éruptions cutanées, des douleurs à la poitrine ou une perte de l’odorat et du goût. Ce virus est particulièrement infectieux, avec un nombre de reproduction de base (R0) correspondant au nombre moyen de personnes infectées par un malade, estimé entre 2,43 et 3,10 [
3
].
En juillet 2020, date de parution de l’article de Pizzorno
et al.
, le SARS-CoV-2 était encore mal connu, et la priorité était de caractériser précisément son mode d’action afin de pouvoir développer efficacement de nouvelles thérapies. C’est au cours de cette période d’incertitude que Pizzorno
et al.
ont développé le modèle HAE (
human airway epitheliu
m), un modèle qui permet une meilleure caractérisation de l’infection de l’épithélium nasal et bronchique par le SARS-CoV-2, mais aussi le criblage de molécules thérapeutiques [
4
]. En effet, jusqu’alors, la majorité des expériences étaient limitées à des tests
in vitro
réalisés sur des cellules Vero E6
1
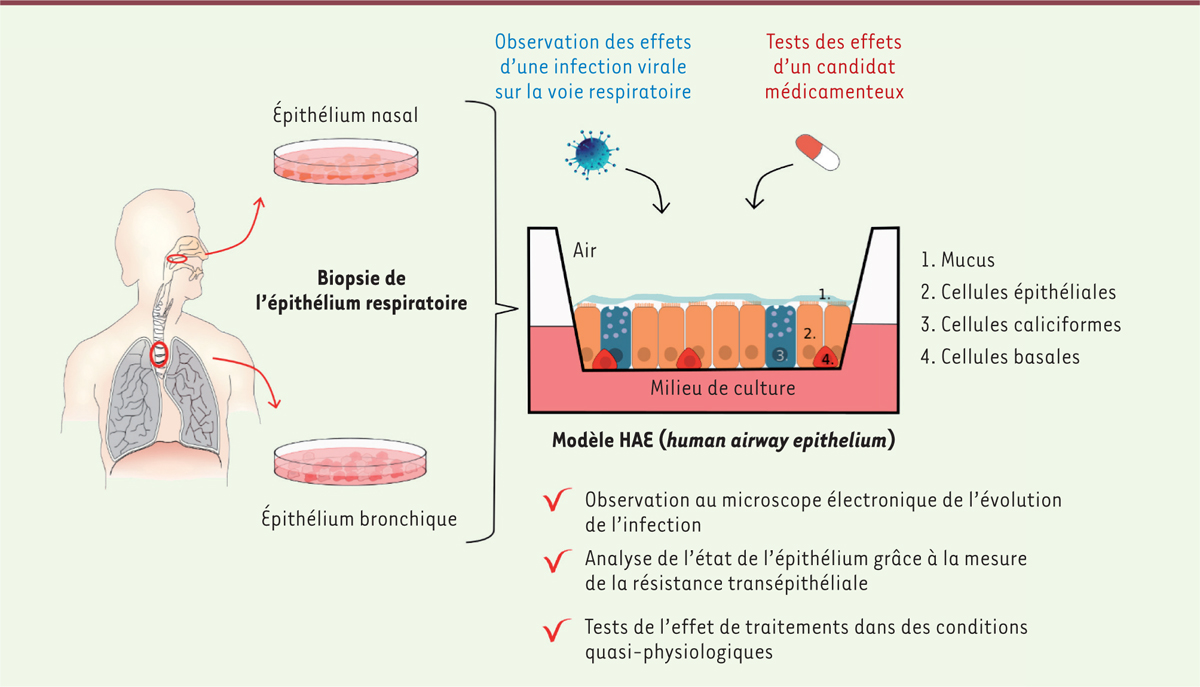
. Le modèle HAE a été réalisé à partir de biopsies de tissus nasaux ou bronchiques provenant de donneurs sains et cultivées en interface air-liquide (
Figure 1
). Ce modèle repose sur l’utilisation de trois types de cellules présents dans les épithéliums respiratoires humain nasaux ou bronchiques : les cellules ciliées, principales cellules de l’épithélium respiratoire ; les cellules caliciformes, spécialisées dans la synthèse de mucus ; et les cellules basales, progénitrices des cellules épithéliales. Ce modèle reproduit ainsi fidèlement la structure de l’épithélium respiratoire humain. Il ne contient cependant ni les neurones olfactifs, ni les cellules immunitaires. Il permet néanmoins d’étudier la cinétique d’infection par le SARS-Cov-2, et, aussi, l’efficacité de potentielles molécules antivirales, avec un aperçu des processus qui se produisent dans le tractus respiratoire supérieur (le nez), mais aussi dans le tractus inférieur (les bronches). Pizzorno
et al.
utilisent ce modèle en analysant, successivement, l’infection par le SARS-CoV-2 des cellules de l’épithélium, puis les effets de deux traitements potentiels : le diltiazem et le remdésivir.
 | Figure 1.
Représentation du modèle HAE (
human airway epithelium
) et de sa caractérisation par Pizzorno
et al.
Le modèle HAE repose sur la mise en culture de l’épithélium respiratoire bronchique ou nasal biopsié chez des sujets humains. Ce modèle inclut le mucus et les cellules épithéliales, caliciformes et basales, caractéristiques d’un épithélium respiratoire humain. Cet épithélium reconstitué
in vitro
, proche de la physiologie humaine, permet de tester différents types d’infections virales ainsi que l’efficacité de potentiels traitements médicamenteux sur l’intégrité de l’épithélium respiratoire.
|
|
Le modèle HAE permet de caractériser le processus d’infection des cellules respiratoires par le SARS-CoV-2
Dans leur article, Pizzorno A
et al.
ont utilisé une souche de SARS-CoV-2 isolée et séquencée en France et répertoriée dans la base de données GISAID EpiCoVT
M
, sous la référence BetaCoV/France/IDF0571/2020. Les auteurs se sont tout d’abord intéressés à la cinétique de l’infection, dans le modèle HAE, en titrant le virus produit dans ce système expérimental. La titration consiste ici à mesurer la production de particules virales infectieuses par des cellules infectées, en récupérant le surnageant des cellules à différents temps de leur infection, et en l’ajoutant au milieu de culture de cellules sensibles au virus. Le TCID50 (
tissue culture infectious dose 50
) est une mesure de la quantité de virus infectieux (et cytopathogènes
2
pour les cellules cibles) présents dans le surnageant. Dans l’épithélium bronchique, le titre viral atteint un plateau entre 24 heures et 72 h, puis diminue. Dans l’épithélium nasal, le titre viral contenu dans le surnageant augmente jusqu’à 96 h après infection, sans atteindre de plateau. Une différence de cinétique d’infection entre épithéliums nasal et bronchique est ainsi observée, même si cette différence n’est pas statistiquement significative. Les auteurs ont, en parallèle, réalisé une analyse de la charge virale, en utilisant des cellules Vero E6, par RT-qPCR (
reverse transcriptase-quantitative polymerase chain reaction
) grâce à des sondes élaborées par la
School of Public Health
de l’université de Hong-Kong. Une corrélation entre charge virale et titre infectieux a ainsi été mise en évidence.
Les auteurs ont alors comparé les titres viraux obtenus dans trois compartiments différents accessibles dans le modèle HAE : le compartiment apical, qui est la zone de contact entre les cellules épithéliales et le mucus ; le compartiment intracellulaire ; et le compartiment basal, qui se trouve entre les cellules épithéliales et la lame basale. Au niveau nasal apical, les titres viraux augmentent jusqu’à atteindre un pic après 48 h d’infection. Le virus est également détecté dans le milieu intracellulaire, atteignant un pic après 72 h d’infection. Il est aussi retrouvé dans le compartiment basal, avec une charge virale augmentant jusqu’à 96 heures, ce qui révèle, indirectement, la production de virus dans le compartiment basal et/ou la rupture de l’intégrité de l’épithélium nasal et bronchique.
Afin de caractériser l’intégrité de l’épithélium, la résistance électrique trans-épithéliale (TEER,
trans-epithelial electrical resistance
) a été évaluée à 24, 48 et 72 h après l’infection. Cette résistance est corrélée à l’intégrité physique de l’épithélium [
5
]. Une diminution importante de la résistance électrique des cellules, révélatrice d’une perte de l’intégrité de la barrière épithéliale, a été observée 48 h après infection, parallèlement à une augmentation de la charge virale apicale.
Les auteurs ont ensuite utilisé la microscopie électronique pour étudier les effets de l’infection par le SARS-Cov-2 sur les cellules du modèle HAE nasal ou bronchique. Les observations montrent que 48 h après l’inoculation du virus, les deux types d’épithélium présentent les signes d’une infection bien établie, avec une forte production de particules virales par les cellules de l’épithélium. Des vésicules à double membrane, caractéristiques des stades tardifs de l’infection, sont observées dans toutes les cellules de l’épithélium. Ainsi, le modèle HAE permet d’observer les caractéristiques de l’infection de l’épithélium respiratoire par le SARS-CoV-2. |
L’infection par le SARS-CoV-2 déclenche une réponse inflammatoire différente en fonction du type cellulaire infecté
Selon de précédentes études, l’infection par le SARS-Cov-2 est généralement associée à un taux élevé de certaines molécules pro-inflammatoires, notamment dans les formes les plus graves de l’infection. Les chercheurs ont donc étudié l’effet de l’infection sur le transcriptome des cellules de l’épithélium HAE nasal et bronchique. Les résultats du séquençage ARN montrent que, 24 h après l’infection, l’ensemble des cellules de l’épithélium présentent une surexpression de gènes de la réponse inflammatoire tels que ceux codant les interférons de type I ou de type III, ou la chimiokine CXCL2 (
C-X-C motif chemokine ligand 2
), et cela, indépendamment du type d’épithélium utilisé. Néanmoins, les résultats montrent que 48 h après l’infection, une distinction entre la signature transcriptomique des cellules d’épithélium nasal et bronchique est observée, même si celle-ci n’est pas significative. En effet, dans l’épithélium nasal, il existe une tendance à la surexpression des gènes codant les interférons de types I et II (IFNB1, IFNL2, etc.) et le TNF-α (
tumor necrosis factor alpha
), ainsi que d’autres gènes liés à l’immunité, alors que seuls un petit nombre de gènes impliqués dans l’immunité (Mx1, ILA, ZBP1, etc.) sont surexprimés dans l’épithélium bronchique. Ces observations suggèrent une potentielle différence entre la réponse innée des voies respiratoires inférieures et celles des voies supérieures.
|
La combinaison du diltiazem et du remdésivir permet de réduire l’infection et de protéger l’épithélium respiratoire dans le modèle HAE
Le remdésivir est une prodrogue nucléotidique (GS-5734) qui est actuellement en cours d’essai pour le traitement de l’infection par le virus Ebola, mais qui semble également pouvoir inhiber la réplication virale du SARS-CoV-2 et du MERS dans de nombreux modèles cellulaires et animaux [
6
]. Le diltiazem est un antagoniste des canaux ioniques Ca
2+
voltage-dépendants et il est utilisé comme anti-hypertenseur chez les patients atteints d’arythmie cardiaque [
7
]. Pizzorno
et al.
ont montré dans une précédente étude que cette molécule pourrait aussi avoir des effets antiviraux utiles pour traiter le virus de la grippe [
7
]. En effet, le diltiazem possède la capacité d’induire une réponse interféron antivirale, notamment via les interférons de type I et de type III, par un mécanisme qui n’est pas encore totalement élucidé. La stratégie de la combinaison du diltiazem et du remdésivir repose donc sur le ciblage à la fois de l’ARN du virus par le remdésivir et de l’hôte par le diltiazem.
Pour chaque expérience, le modèle est infecté par le Sars-CoV-2 au jour 0. En parallèle, le traitement est administré au jour 0, et répété toutes les 24 h après changement de milieu. Enfin, la charge virale est mesurée à 48 h et 72 h post-infection. Chaque expérience est répétée avec différentes concentrations afin de pouvoir déterminer l’IC50, correspondant à la concentration de traitement à partir de laquelle la charge virale est diminuée de plus de 50 %. Grâce à ces mesures de l’IC50, Pizzorno
et al.
ont pu comparer l’efficacité du remdésivir seul ou en association avec le dilitiazem dans les cellules Vero. L’association avec le diltiazem permet de réduire l’IC50 du remdésivir de 0,98 µM à 0,32 µM après 48 heures, et de 0,72 µM à 0,35 µM après 72 heures d’infection. Dans tous les cas, ces concentrations sont grandement inférieures aux concentrations toxiques pour les cellules, ce qui fait de cette combinaison thérapeutique une stratégie prometteuse.
Dans le modèle HAE, les deux molécules seules permettent de réduire significativement la charge virale, et l’association des deux molécules est plus efficace encore. Les auteurs ont également mesuré la résistance électrique au niveau nasal et bronchique à 48 h et 72 h avec différentes combinaisons de molécules thérapeutiques. À 72 h. Ils ont constaté une amélioration de l’intégrité de l’épithélium après traitement, avec une tendance à la relation dose/effet. |
L’étude de Pizzorno
et al.
montre qu’
in vitro
, en utilisant des cellules humaines primaires, l’infection de l’épithélium respiratoire par le SARS-CoV-2 provoque des dommages cellulaires et tissulaires. L’association diltiazem/remdesivir est une potentielle stratégie thérapeutique pour lutter contre la Covid-19 avec des effets montrés
in vitro
dans le modèle HAE. Ces résultats sont toutefois à mettre en relation avec les récents résultats de l’étude Discovery qui a montré qu’un traitement par remdésivir sans association au diltiazem ne diminue pas la mortalité des patients hospitalisés [
8
]. Cet article peut en outre être mis en perspective avec les avancées qui ont eu lieu depuis sa publication. Certains chercheurs se focalisent sur le développement de médicaments bloquant les voies d’entrée du virus dans les cellules, tel que le camostat mésylate, aujourd’hui testé en essai clinique. Il s’agit d’un inhibiteur de protéase à sérine qui bloque la protéase TMPRSS2, empêchant ainsi l’entrée virale [
9
,
10
]. D’autres thérapies tentent quant à elles de bloquer le cycle de réplication virale, comme avec le remdésivir que les auteurs étudient dans cet article [
6
]. Par ailleurs, le développement d’anticorps monoclonaux thérapeutiques dirigés contre la protéine Spike du SARS-CoV-2 est une autre approche explorée. Aujourd’hui, trois traitements majeurs ont obtenu des autorisations d’utilisation par la
Food and Drug Administration
(FDA) : deux bithérapies, casirivimab/imdévimab et bamlanivimab/étésévimab, et une monothérapie avec le bamlanivimab [
11
,
12
]. Ces approches thérapeutiques sont complémentaires de l’approche vaccinale, aujourd’hui en cours de déploiement autour du globe [
13
–
15
].
|
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
|
Footnotes |
1.
Amirfakhryan
H
,
Safari
F
.
Outbreak of SARS-CoV2: pathogenesis of infection and cardiovascular involvement.
.
Hellenic J Cardiol.
2021;
;
62
:
:13.
–
23
.
2.
Bonny
V
,
Maillard
A
,
Mousseaux
C
,
et al.
Covid-19 : physiopathologie d’une maladie à plusieurs visages.
.
Rev Med Interne.
2020;
;
41
:
:375.
–
89
.
3.
D’Arienzo
M
,
Coniglio
A
.
Assessment of the SARS-CoV-2 basic reproduction number, R0, based on the early phase of Covid-19 outbreak in Italy.
.
Biosafety Health.
2020;
;
2
:
:57.
–
9
.
4.
Pizzorno
A
,
Padey
B
,
Julien
T
,
et al.
Characterization and treatment of SARS-CoV-2 in nasal and bronchial human airway epithelia.
.
Cell Rep Med.
2020;
;
1
:
:100059.
.
5.
Chen
S
,
Einspanier
R
,
Schoen
J
.
Transepithelial electrical resistance (TEER): a functional parameter to monitor the quality of oviduct epithelial cells cultured on filter supports.
.
Histochem Cell Biol.
2015;
;
144
:
:509.
–
515
.
6.
Sheahan
TP
,
Sims
AC
,
Graham
RL
,
et al.
Broad-spectrum antiviral GS-5734 inhibits both epidemic and zoonotic coronaviruses.
.
Sci Transl Med.
2017;
;
9
:
:eaal3653.
.
7.
Pizzorno
A
,
Terrier
O
,
Nicolas de Lamballerie
C
,
et al.
Repurposing of drugs as novel influenza inhibitors from clinical gene expression infection signatures.
.
Front Immunol.
2019;
;
10
:
:60.
.
8.
WHO Solidarity Trial Consortium.
.
Repurposed antiviral drugs for Covid-19. Interim WHO solidarity trial results.
.
N Engl J Med.
2021;
;
384
:
:497.
–
511
.
9.
Hoffmann
M
,
Hofmann-Winkler
H
,
Smith
JC
,
et al.
Camostat mesylate inhibits SARS-CoV-2 activation by TMPRSS2-related proteases and its metabolite GBPA exerts antiviral activity.
.
EBioMed.
2021;
;
65
:
:103255.
.
10.
University of Aarhus.
.
The impact of camostat mesilate on Covid-19 infection: an investigator-initiated randomized, placebo-controlled, phase IIa trial.
.
Clinicaltrials.gov.
,
2021
.
11.
Hurt
AC
,
Wheatley
AK
.
Neutralizing antibody therapeutics for Covid-19.
.
Viruses.
2021;
;
13
:
:628.
.
12.
Falcone
M
,
Tiseo
G
,
Valoriani
B
,
et al.
Efficacy of bamlanivimab/etesevimab and casirivimab/imdevimab in preventing progression to severe Covid-19 and role of variants of concern.
.
Infect Dis Ther.
2021
; Aug 25, pp.
:1.
–
10
, doi:
10.1007/s40121-021-00525-4
.
13.
Meo
SA
,
Bukhari
IA
,
Akram
J
,
et al.
Covid-19 vaccines: comparison of biological, pharmacological characteristics and adverse effects of Pfizer/BioNTech and Moderna vaccines.
.
Eur Rev Med Pharmacol Sci.
2021;
;
25
:
:1663.
–
9
.
14.
Ramasamy
MN
,
Minassian
AM
,
Ewer
KJ
,
et al.
Safety and immunogenicity of ChAdOx1 nCoV-19 vaccine administered in a prime-boost regimen in young and old adults (COV002): a single-blind, randomised, controlled, phase 2/3 trial.
.
Lancet.
2021;
;
396
:
:1979.
–
93
.
15.
Voysey
M
,
Costa Clemens
SA
,
Madhi
SA
,
et al.
Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19 (AZD1222) vaccine: a pooled analysis of four randomised trials.
.
Lancet.
2021;
;
397
:
:881.
–
91
.
|