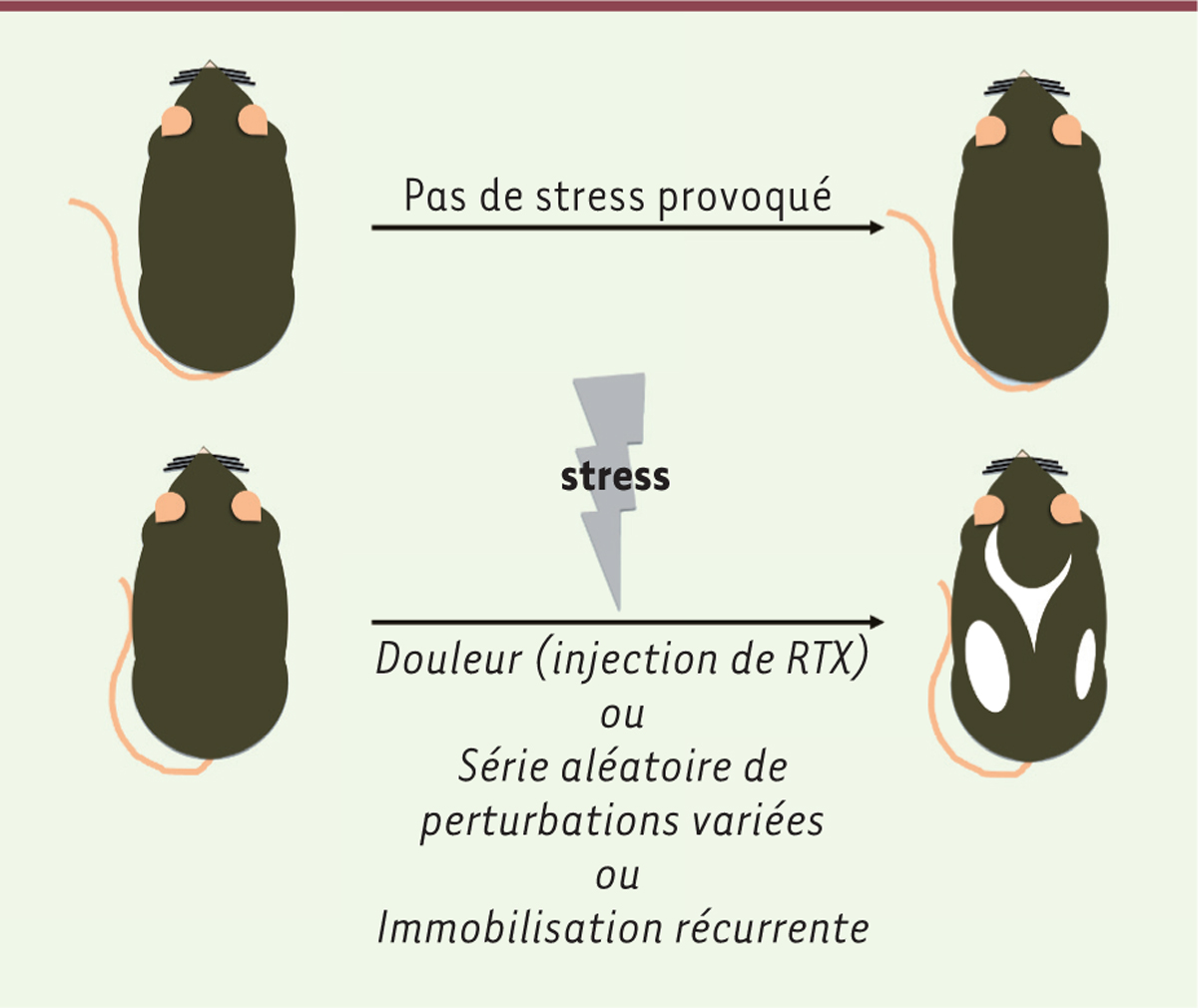
Nous pensons volontiers que les soucis font blanchir nos cheveux. Cependant, l’existence d’un lien causal entre le stress et le grisonnement précoce n’était pas, jusqu’à présent, clairement démontrée par des études scientifiques. L’existence d’un tel lien vient d’être testée chez la souris, dont les poils blanchissent avec l’âge [ 1 ].
Les souris ont été exposées à l’un des trois « stresseurs » (déclencheurs du stress) suivants : la douleur 1, par injection de résinifératoxine (RTX 2 [ 14 ] ( → ), l’exposition à une série aléatoire de perturbations variées 3 , ou l’immobilisation récurrente [ 2 , 3 ]. Dans les trois cas, le pelage des souris stressées a partiellement blanchi, alors que celui des souris témoins est resté noir ( Figure 1 ) [ 2 , 3 ]. La douleur est la plus efficace : l’injection de RTX lors de la première phase de repos du follicule pileux (phase télogène) ou lors de la première phase de régénération (phase anagène) (Figures 1 et 2) [ 2 , 3 ] provoque l’apparition de poils blancs dès la phase anagène suivante, alors que l’effet des deux autres stresseurs se manifeste après plusieurs cycles pilaires [ 2 ]. L’effet de RTX est bloqué par un analgésique (la buprénorphine), ce qui prouve que c’est bien la douleur, et non une autre action possible de RTX, qui est responsable du grisonnement 4, précoce [ 2 ].
(→) Voir la Synthèse de A. Danigo et al., m/s n° 6-7, juin-juillet 2013, page 597
| Figure 1.
Le stress accélère la survenue du grisonnement chez la souris.
Des souris ont été soumises à l’un des trois stresseurs suivants : 1) la douleur par injection de résinifératoxine (RTX) ; 2) une série aléatoire de perturbations variées ; 3) une immobilisation récurrente. Dans les trois cas, le pelage des souris stressées a partiellement blanchi, alors que celui des souris témoins est resté noir. RTX est injectée lors de la première phase télogène entre 20 et 25 jours après la naissance ou, plus souvent, vers la fin de la première phase anagène (
full anagen
[
2
,
8
]) (voir
Figure 2
), entre 31 et 36 jours après la naissance [
2
]. Dans les deux cas, des poils blancs apparaissent dès la phase anagène suivante. Les perturbations variées ont été réalisées deux fois par jour pendant plusieurs semaines consécutives. L’immobilisation récurrente est effectuée quatre heures par jour pendant 5 jours à partir de 28-30 jours après la naissance, en milieu de la première phase anagène (
mid anagen
[
2
,
8
]), puis pendant plusieurs phases anagènes successives, rapprochées par l’épilation dès que les follicules atteignent la phase télogène [
2
]. L’effet de ces deux autres stresseurs se manifeste après 3 à 5 cycles pilaires [
2
]. De larges taches de poils blancs apparaissent sur les souris traitées par RTX (comme celle représentée), alors que la dépigmentation du pelage des souris exposées aux deux autres stresseurs est plus diffuse [
2
].
|
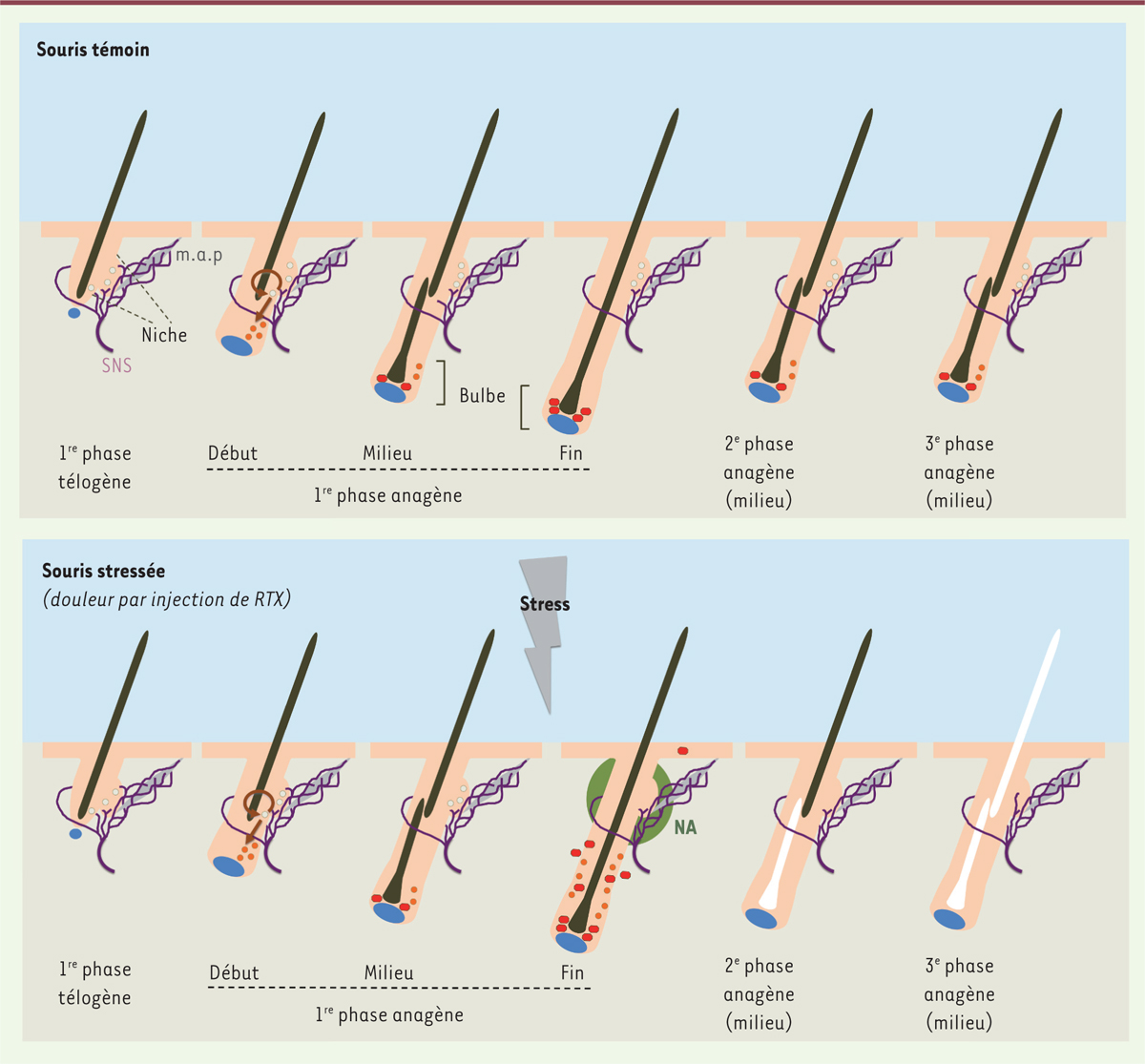
Les auteurs ont ensuite élucidé le mécanisme par lequel le stress accélère le grisonnement des souris. Chaque follicule pileux contient deux types de cellules souches dans une niche commune située au niveau d’un renflement ( bulge ) de la gaine épithéliale externe du follicule et dans la région juste en dessous ( hair germ 5, ) [ 2 ] : les MeSC ( melanocyte stem cells ), cellules souches des mélanocytes, et les HFSC ( hair follicle stem cells ), cellules souches épithéliales ( Figure 2 ) [ 1 – 5 ] ( → ).
(→) Voir la Synthèse de B.A. Bernard, m/s n° 2, février 2006, page 138
| Figure 2.
Le stress provoque la déplétion des cellules souches des mélanocytes des follicules pileux à cause d’une sécrétion accrue de noradrénaline par le système nerveux sympathique.
Le cycle pilaire se compose d’une phase de régénération (anagène), d’une phase de régression associée à des processus apoptotiques (phase catagène, non représentée) et d’une phase de repos (télogène) [
2
–
4
]. Pendant la phase anagène, le follicule pileux croît vers le bas et forme le bulbe englobant une structure stromale régulatrice, la papille dermique (en bleu), dont la position suit la croissance et la régression du follicule [
4
]. Les cellules souches des mélanocytes (MeSC, ronds blancs), dérivés de la crête neurale, résident sous la glande sébacée (non représentée) au sein d’une niche située dans un renflement de la gaine épithéliale externe du follicule pileux et juste en dessous (
bulge/secondary hair germ area
) [
1
–
5
,
7
]. Au début de chaque phase anagène, les MeSC sont activées et se divisent. Cette division assure leur auto-renouvellement dans la niche (flèche circulaire) et fournit des cellules filles qui migrent vers le bas (ronds orange), prolifèrent et se différencient en mélanocytes matures (en rouge) dans le bulbe pilaire [
1
,
2
,
4
,
7
]. Dans la matrice, structure du bulbe entourant la papille dermique, les mélanocytes matures produisent le pigment du poil, la mélanine, qui est transférée aux kératinocytes prolifératifs voisins (non représentés) dérivés des HFSC (non représentées) [
2
,
4
,
6
–
8
]. La multiplication/différenciation de ces kératinocytes construit le nouveau poil (pigmenté) et la gaine interne [
4
,
7
,
8
]. Les mélanocytes matures (et la plupart des cellules du bulbe) sont éliminés lors de la phase catagène [
2
,
4
,
7
,
13
]. Le moment de la chute du poil peut varier. Pour une discussion sur certains éléments présentés ici, voir [
13
]. Chez les souris témoins (en haut), les neurones du système nerveux sympathique (SNS, en violet), associés à la niche
via
le muscle arrecteur du poil (
map
, en gris) produisent une quantité modérée de noradrénaline (non représentée) [
2
,
8
]. Dans ce cas, la capacité d’auto-renouvellement des MeSC assure leur maintien pour les cycles suivants. Notons que cette sécrétion « basale » de noradrénaline joue un rôle important sur les HFSC [
8
]. Chez les souris stressées par l’injection de RTX (en bas), le système nerveux sympathique est suractivé : la quantité de noradrénaline (NA, en vert) libérée par les neurones sympathiques augmente donc fortement, ce qui stimule massivement la prolifération des MeSC, leur migration et leur différenciation [
2
,
3
]. Cela cause une déplétion des MeSC en quelques jours dans de nombreux follicules pileux et conduit à la présence ectopique de mélanine dans des sites qui en sont normalement dépourvus [
2
,
3
,
7
]. Une fois la niche vidée de ses MeSC, le follicule ne produira plus que des poils blancs [
2
]. L’injection de RTX n’a pas d’effet apparent sur les mélanocytes matures du bulbe [
2
]. Les deux autres stresseurs provoquent également la déplétion des MeSC [
2
] ; cependant, leur effet est moins rapide et moins bien caractérisé [
2
], c’est pourquoi le scénario représenté ici est celui qui suit l’injection de RTX.
|
Au début de chaque phase anagène, les MeSC, quiescentes pendant le reste du cycle pilaire, sont activées : elles se divisent et engendrent des cellules filles qui migrent vers le bas, prolifèrent et se différencient dans le bulbe pilaire en mélanocytes matures produisant le pigment du poil, la mélanine ( Figure 2 ) [ 2 , 4 , 6 ] ( → ).
(→) Voir la Synthèse de C. Delevoye et al., m/s n° 2, février 2011, page 153
Les HFSC, également activées en début de phase anagène, contrôlent la quiescence et la co-activation des MeSC, et sont responsables de la régénération du follicule pileux [ 2 , 4 , 5 , 7 ]. Le maintien des MeSC est nécessaire à la pigmentation des poils car la population de mélanocytes matures est entièrement renouvelée à chaque cycle pilaire ( Figure 2 ) [ 2 , 4 , 7 ]. Normalement, le déclin de la population de MeSC est lent car ces cellules s’auto-renouvellent dans la niche lors de leur activation au début de la phase anagène ( Figure 2 ) [ 1 , 2 ]. Le stress précipite ce déclin : quel que soit le stresseur utilisé, les MeSC disparaissent rapidement et irréversiblement de nombreux follicules pileux [ 2 , 3 ]. L’effet de la douleur est particulièrement brutal : cinq jours seulement après l’injection de RTX, la niche apparaît complètement « vidée » des MeSC dans de nombreux follicules pileux [ 2 ]. Dans toutes les phases anagènes suivantes, ces follicules donneront naissance à des poils blancs ( Figure 2 ) .
Il fallait ensuite comprendre comment le stress élimine les MeSC. L’injection de RTX ne semble induire ni nécrose, ni apoptose, ni dommages à l’ADN dans les MeSC [ 2 ]. En revanche, elle stimule rapidement et massivement la prolifération de ces cellules, leur sortie de la niche et leur différenciation [ 2 ]. Cet effet ne dépend pas de l’activation cyclique des MeSC en début de phase anagène puisque RTX est injectée en dehors de cette période (Figures 1 et 2) [ 2 ]. Quant aux médiateurs relayant l’effet du stress sur les MeSC, les « suspects » envisagés étaient les cellules immunitaires et deux molécules dont la sécrétion augmente, comme attendu, chez les souris stressées : la corticostérone et la noradrénaline (ou norépinéphrine) [ 2 , 3 ]. Des expériences réalisées sur des souris mutantes montrent que le stress induit un grisonnement prématuré en l’absence de différentes populations de cellules immunitaires ou du récepteur de la corticostérone dans les MeSC [ 2 , 3 ]. En revanche, l’invalidation, dans les MeSC, du gène Adrb2 codant le récepteur β2-adrénergique de la noradrénaline prévient le grisonnement induit par la douleur [ 2 , 3 ]. De plus, l’injection de noradrénaline provoque l’apparition de poils blancs au site d’injection chez les souris normales et chez les souris dont les HFSC sont déficientes pour Adrb2 , mais pas chez des souris dont les MeSC sont déficientes pour Adrb2 [ 2 ]. La signalisation induite par la noradrénaline dans les MeSC apparaît donc nécessaire et suffisante pour déclencher le grisonnement lié au stress [ 2 , 3 ].
La noradrénaline est sécrétée par les glandes surrénales et par le système nerveux sympathique. Le blocage de la fonction du système nerveux sympathique empêche la déplétion des MeSC et le grisonnement provoqués par la douleur, alors que l’ablation des glandes surrénales est sans effet [ 2 , 3 ]. Réciproquement, l’activation artificielle du système nerveux sympathique, à l’aide d’un dispositif combinant l’injection d’un ligand synthétique et l’expression ciblée de son récepteur dans le système nerveux sympathique, suffit pour induire le grisonnement [ 2 ]. Le stress provoque donc la déplétion des MeSC via l’activation du système nerveux sympathique [ 2 , 3 ]. Des arguments anatomiques confortent cette conclusion. La densité de l’innervation sympathique dans la peau est corrélée à la régionalisation du grisonnement sur le corps des souris stressées [ 2 ]. De plus, le muscle arrecteur du poil, qui s’arrime à la niche des MeSC, est innervé et contrôlé par le système nerveux sympathique et maintient, en retour, une étroite association entre ce système et la niche ( Figure 2 ) [ 2 , 8 ]. Cependant, la noradrénaline n’atteindrait les MeSC qu’en cas d’activité particulièrement élevée du système nerveux sympathique [ 2 , 8 ]. En résumé, ces résultats permettent de proposer le scénario suivant : le stress augmente fortement la libération de noradrénaline par les neurones sympathiques qui jouxtent la niche [ 2 , 8 ], ce qui déclenche directement l’activation massive et la déplétion des MeSC ; il s’ensuit l’absence de production de mélanocytes matures et de mélanine, causant la formation irréversible de poils blancs ( Figure 2 ) [ 2 , 3 ].
Cette étude indique donc que le stress induit le grisonnement des souris et renforce l’idée que le système nerveux sympathique promeut l’activation de certaines cellules souches [ 2 , 3 , 8 , 9 ]. De plus, au moyen d’outils génétiques ou pharmacologiques, cette étude montre que le blocage de la prolifération des MeSC chez les souris stressées contrecarre la déplétion de ces cellules et le grisonnement [ 2 , 3 ]. Elle confirme ainsi que la quiescence conditionne le maintien de diverses populations de cellules souches somatiques [ 2 , 3 , 5 , 10 ].
Les résultats de cette étude soulèvent de nombreuses questions. La douleur exerce-t-elle un effet spécifique expliquant sa plus grande efficacité pour induire le grisonnement en comparaison des deux autres stresseurs utilisés ? La cascade de signalisation par Wnt, importante pour la prolifération et la différenciation des MeSC [ 7 , 11 ], est-elle activée dans ces cellules par la noradrénaline ? Par quel mécanisme l’hyper-prolifération des MeSC après l’injection de RTX (ou de noradrénaline [ 2 ]) conduit-elle à leur différenciation massive ? La migration directe des MeSC (avant leur prolifération et leur différenciation [ 12 ]) contribue-t-elle à leur déplétion ?
On peut aussi se demander si le système nerveux sympathique contrôle directement le fonctionnement des MeSC en dehors des circonstances particulières de cette expérimentation sur le grisonnement. Le système nerveux sympathique joue un rôle direct dans l’activation cyclique des HFSC en début de phase anagène [ 8 ], mais ne semble pas directement impliqué dans celle, concomitante, des MeSC [ 2 ]. En revanche, les observations décrites ici suggèrent que le système nerveux sympathique, lorsqu’il est très fortement stimulé [ 2 , 8 ], pourrait participer directement à l’activation « non cyclique » (hors cycle pilaire) des MeSC en réponse à certaines situations [ 2 ].
On peut enfin se demander dans quelle mesure les mécanismes décrits ici chez la souris existent aussi chez l’homme. La noradrénaline augmente l’expression de marqueurs de prolifération et de différenciation dans des mélanocytes humains cultivés in vitro [ 2 ]. De plus, des patients ayant subi une sympathectomie partielle grisonnent moins, en vieillissant, sur le côté dénervé [ 2 ]. Enfin, chez l’homme (et la souris), le grisonnement lié à l’âge est associé à la disparition progressive des MeSC, à leur différenciation « ectopique » dans ou près de la niche, et à une distribution anormale de la mélanine [ 1 – 4 , 13 ]. Ces observations évoquent celles rapportées chez les souris stressées ( Figure 2 ) [ 2 , 3 , 13 ]. Cependant, le grisonnement des cheveux est un phénomène très complexe, qui implique aussi des dysfonctionnements des mélanocytes matures du bulbe pilaire [ 4 , 13 ]. L’influence du système nerveux sympathique sur l’ensemble de ces mécanismes reste à préciser.