L’utilisation de substances chimiques issues de l’activité humaine fait partie de la vie quotidienne, et entraîne une contamination massive de l’environnement. Certaines de ces substances sont capables d’altérer les systèmes endocriniens d’organismes vivants ou de leur descendance [ 1 ]. Parmi les perturbateurs endocriniens identifiés figurent les phtalates, des molécules organiques très utilisées, notamment dans l’industrie des matières plastiques. Le 2-éthylhexyle phtalate (DEHP) est le plus abondant dans l’environnement, mais d’autres phtalates sont également présents [ 2 ]. L’étude des effets des phtalates sur l’organisme comporte donc des enjeux à la fois sanitaires et environnementaux. Des études épidémiologiques ont établi une association entre la présence de métabolites des phtalates dans l’urine et la diminution de la distance ano-génitale chez les garçons [ 3 ] ou la puberté précoce chez les filles [ 4 ]. Des études expérimentales chez les rongeurs ont également montré les effets néfastes de l’exposition périnatale aux phtalates sur le développement et le fonctionnement du système reproducteur mâle, et plus récemment femelle [ 5 ]. En revanche, les effets potentiels de l’exposition des adultes aux phtalates sur le contrôle central de la reproduction restaient peu étudiés. Or, le cerveau des adultes conserve une plasticité, qui peut être affectée à long terme. De plus, la majorité des études expérimentales ont porté sur de fortes doses de phtalates, très éloignées de celles estimées pour l’exposition environnementale.
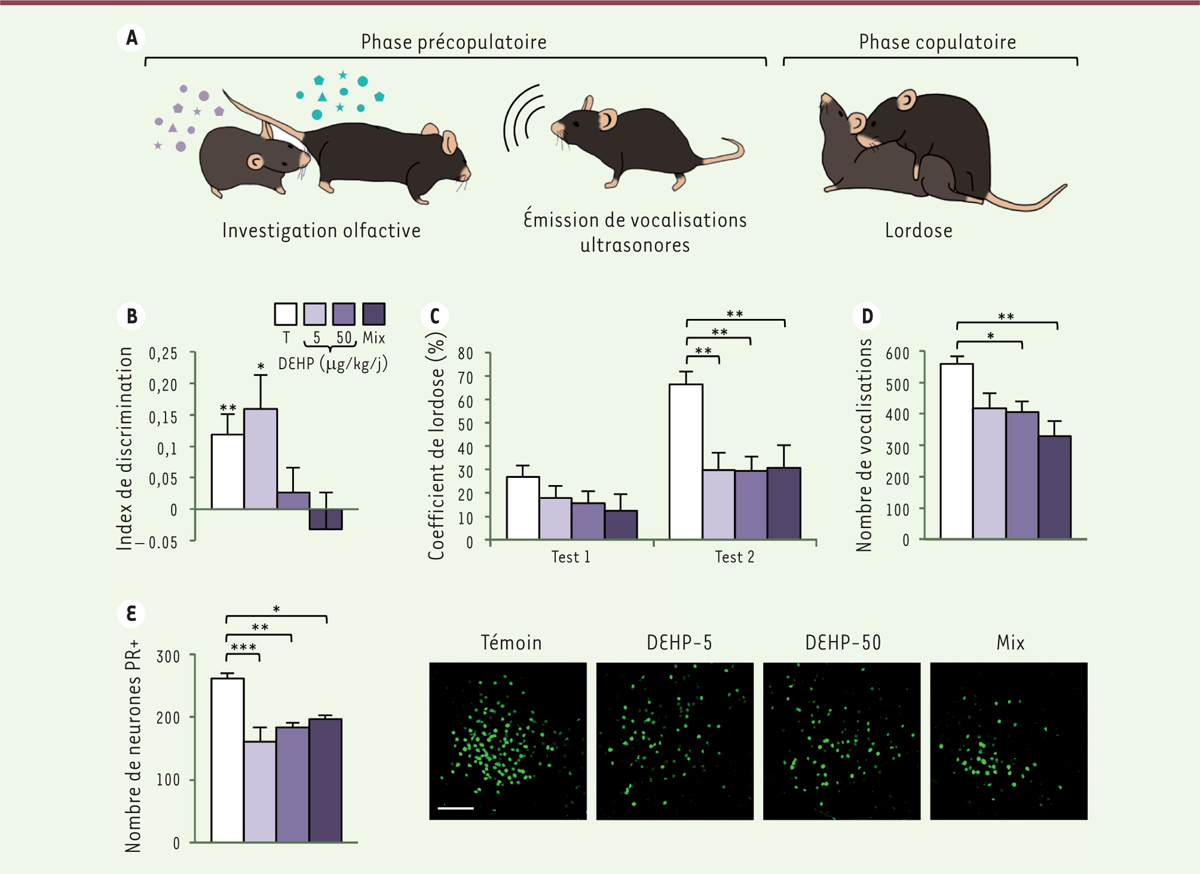
Chez les rongeurs, l’accouplement est restreint à la période de réceptivité de la femelle et coïncide avec l’ovulation. Durant la phase pré-copulatoire, les deux partenaires émettent des phéromones et se reniflent mutuellement ( Figure 1A ) . Cette stimulation olfactive est très importante pour l’induction des comportements de la reproduction, comme l’émission, par le mâle, des vocalisations ultrasonores nécessaires à l’attraction de la femelle et à son maintien à proximité. La phase copulatoire débute ensuite avec les montes par le mâle, auxquelles la femelle répond par une posture en lordose.
| Figure 1.
Effets de l’exposition de souris femelles adultes aux phtalates sur leur comportement sexuel. A.
Schéma de la séquence comportementale de la femelle lors de l’accouplement. La femelle renifle les phéromones du mâle, tandis que celui-ci renifle la femelle et émet des vocalisations ultrasonores. Durant l’accouplement, la femelle adopte une posture de lordose en réponse aux montes du mâle.
B-D.
Effet de l’exposition orale au DEHP seul aux doses de 5 µg/kg/j (DEHP-5) ou 50 µg/kg/j (DEHP-50), ou à un mélange de phtalates (Mix), sur l’index de discrimination (temps passé par les femelles à renifler le mâle, diminué du temps mis à investiguer la femelle, divisé par le temps total d’investigation). Le groupe témoin (T) regroupe les femelles ayant reçu une alimentation non contaminée par les phtalates. (
B
), le coefficient de lordose (
C
), et le nombre de vocalisations ultrasonores émises par les mâles en présence de femelles (
D
).
E.
Analyse quantitative du nombre de cellules exprimant le récepteur de la progestérone (PR
+
) dans l’hypothalamus ventro-médian (détecté par un anticorps) et photographies de microscopie de l’immunomarquage de cellules isolées de femelles témoins ou exposées aux phtalates. Les différences statistiquement significatives entre les groupes sont indiquées par * (p < 0,05), ** (p < 0,01), ou *** (p < 0,001). Barre d’échelle : 100 µm.
|
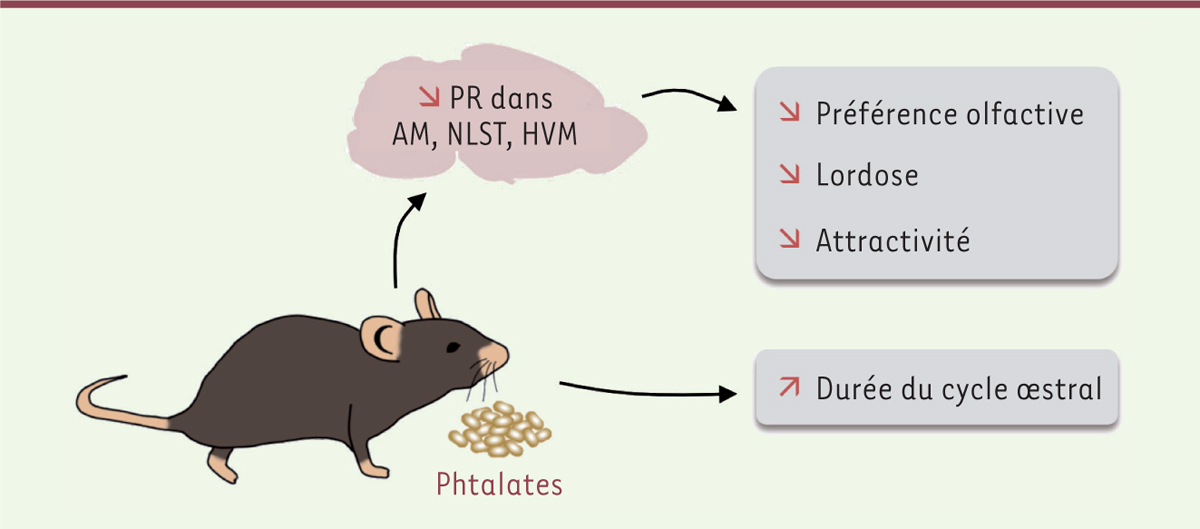
| Figure 2.
L’exposition de souris femelles à de faibles doses de phtalates induit une diminution de leur préférence olfactive envers les mâles, du coefficient de lordose et de l’attractivité sexuelle.
Ces perturbations du comportement de reproduction ont été associées à une diminution de l’expression du récepteur de la progestérone (PR) dans les cellules de l’amygdale médiane (AM), du noyau du lit de la strie terminale (NLST) et de l’hypothalamus ventro-médian (HVM). Les femelles exposées aux phtalates présentent également un allongement du cycle œstral.
|
L’ensemble de ces comportements est contrôlé par un circuit neural impliquant plusieurs régions cérébrales. Chez la femelle, les phéromones mâles stimulent les neurones du bulbe olfactif, qui transmettent ces informations chimiosensorielles à ceux de l’amygdale médiane, puis à ceux du noyau du lit de la strie terminale. Les neurones de ces deux régions projettent ensuite leurs axones vers l’hypothalamus ventro-médian. Ce circuit facilitateur de la posture de lordose est activé par une séquence hormonale impliquant le pic pré-ovulatoire d’œstradiol, qui induit une augmentation de l’expression du récepteur de la progestérone dans ces différentes régions cérébrales. La progestérone libérée en réponse à la décharge pré-ovulatoire de LH (hormone lutéinisante) agit sur ses récepteurs neuraux pour induire la réceptivité sexuelle de la femelle. Ces hormones agissent également pour freiner l’action du circuit inhibiteur de la lordose (région préoptique et noyau arqué de l’hypothalamus).
Nous avons récemment montré que l’exposition de souris mâles adultes à de faibles doses de DEHP induit une perturbation de leur comportement de cour et retarde le début de l’accouplement [ 6 , 7 ] ( → ).
(→) Voir la Nouvelle de D. Capela et S. Mhaouty-Kodja, m/s n° 3, mars 2018, page 211
Cela est dû, au moins en partie, à une sous-expression du récepteur des androgènes dans des régions du cerveau impliquées dans le comportement sexuel des mâles. Dans une nouvelle étude, nous avons recherché si cette sensibilité comportementale et neurale aux phtalates concernait également les femelles.
Nous avons exposé des souris femelles C57BL/6J adultes à une nourriture contaminée par les phtalates [ 8 ]. Les souris ont été alimentées avec de la nourriture sans phtalates (groupe témoin), ou contenant le DEHP seul, à la dose de 50 µg/kg de poids corporel/jour, correspondant à la dose journalière tolérable (DJT) 1, , ou à la dose de 5 µg/kg/jour, une valeur située dans la gamme de l’exposition environnementale. Un quatrième groupe a été exposé à un mélange de phtalates pertinent pour l’exposition environnementale et incluant le DEHP (DEHP à 5 µg/kg/j, DBP à 0,5 µg/kg/j, BBP à 0,5 µg/kg/j, DiBP à 0,5 µg/kg/j et DEP à 0,25 µg/kg/j) 2 . Ces traitements ont débuté 6 semaines avant les tests et ont été maintenus pendant toute la période des analyses.
Les analyses comportementales ont été réalisées sur des femelles dont les taux hormonaux ont été normalisés par une ovariectomie et une supplémentation en œstradiol et en progestérone. Chez les femelles exposées au DEHP seul à la dose de 50 µg/kg/j ou au mélange de phtalates, nous avons constaté une altération de la préférence olfactive puisqu’elles ont été incapables de discriminer les phéromones mâles et femelles ( Figure 1B ) . De plus, le comportement de lordose de ces femelles en présence d’un mâle sexuellement expérimenté était très affecté. En effet, alors que le coefficient de lordose 3 des femelles témoins a fortement augmenté entre le premier et le deuxième test, celui des femelles exposées aux phtalates, quel que soit leur groupe de traitement, est resté très faible ( Figure 1C ) . Enfin, nous avons observé, chez ces femelles, un comportement de rejet du mâle plus fréquent que chez celles du groupe témoin.
Les mâles, quant à eux, ont été moins attirés par les femelles exposées aux phtalates, dans plusieurs tests comportementaux [ 8 ]. Ils ont en effet passé moins de temps à renifler les femelles exposées au DEHP seul ou au mélange de phtalates ou à renifler leur urine, qu’à renifler les femelles du groupe témoin. Les vocalisations ultrasonores qu’ils ont émises ont également été moins nombreuses et de plus courte durée en présence des femelles exposées aux phtalates ( Figure 1D ) . Cette diminution de l’attractivité des femelles pourrait être due à une perturbation de leur émission de phéromones.
Ces altérations comportementales induites par l’exposition au DEHP seul ou au mélange de phtalates ont été observées chez des femelles ayant des taux hormonaux normalisés (après ovariectomie et supplémentation d’hormones), ce qui suggérait des modifications au niveau cérébral et non pas gonadique. La réceptivité sexuelle des femelles étant activée par l’œstradiol et la progestérone, nous avons donc effectué une analyse immunohistochimique des récepteurs de ces hormones dans le circuit neural du comportement sexuel. Nous avons observé une diminution du nombre de neurones exprimant le récepteur de la progestérone dans le circuit facilitateur de la posture de lordose (amygdale médiane, noyau du lit de la strie terminale, hypothalamus ventro-médian) pour les trois groupes de traitements ( Figure 1E ) . En revanche, aucune différence quant au nombre de neurones exprimant le récepteur alpha des œstrogènes (ERα) n’a été observée dans ces régions, ce qui suggère l’existence d’un effet sélectif des phtalates sur le récepteur de la progestérone. Des effets similaires montrant une diminution du nombre de neurones exprimant le récepteur de la progestérone ont été observés pour le circuit inhibiteur de la posture de lordose (région préoptique, noyau arqué). Les effets sur l’expression du récepteur de la progestérone dans les régions impliquées dans l’intégration des signaux olfactifs et le comportement de lordose pourrait être la cause, au moins en partie, des perturbations comportementales observées chez les femelles exposées aux phtalates. L’altération de l’expression neurale des récepteurs de la progestérone chez la femelle [ 8 ] et des récepteurs des androgènes chez le mâle [ 6 , 7 ] est un argument supplémentaire en faveur de l’appartenance des phtalates à la catégorie des perturbateurs endocriniens, avec un effet qui s’ajoute à celui précédemment décrit sur la production fœtale de testostérone. Les mécanismes moléculaires qui expliquent les effets des phtalates sur l’expression de ces récepteurs restent à explorer.
Par ailleurs, l’analyse de femelles non ovariectomisées a montré que l’exposition au DEHP seul ou à un mélange de phtalates perturbe la progression du cycle œstral 4 . En effet, le stade proœstrus était raccourci chez les femelles exposées aux trois groupes de traitement, tandis que les stades œstrus et diœstrus étaient allongés. Il en a résulté un allongement de la durée totale du cycle œstral, ce qui, associé à une augmentation du poids de l’utérus, suggère des perturbations hormonales, en accord avec les résultats d’une étude précédente chez le rat montrant que l’exposition au DEHP induit une perturbation du cycle œstral et des taux hormonaux [ 9 ].
Ces résultats montrent que l’exposition à de faibles doses de phtalates, de l’ordre de celles de l’exposition environnementale, altère le comportement sexuel de la souris femelle. Le récepteur de la progestérone semble être une cible des phtalates pour induire ces perturbations comportementales. Une étude épidémiologique chez des femmes avait d’ailleurs précédemment établi l’existence d’une association entre la présence de métabolites de DEHP dans les urines et un faible intérêt pour l’activité sexuelle [ 10 ]. Un autre aspect intéressant de cette étude chez les souris femelles est que l’exposition aux phtalates a également des effets sur l’axe hormonal gonadotrope [ 8 ]. En comparaison, notre étude précédente sur les mâles n’avait montré aucun effet sur les taux circulants de testostérone ou l’intégrité de l’axe gonadotrope [ 6 , 7 ]. Les souris femelles sont donc plus vulnérables que les mâles à l’exposition à de faibles doses de phtalates. À ce titre, il est important de rappeler que les phtalates sont surtout décrits comme des substances anti-androgéniques agissant sur la production fœtale de testostérone [ 11 ]. C’est sur la base de ce mode d’action, mis en évidence par des études expérimentales, que l’utilisation de DEHP, DBP, BBP et DiBP a été réglementée, avec une DJT de l’ordre de 50 µg/kg/j, une DJT confirmée récemment par l’Agence européenne de sécurité des aliments [ 11 ]. Or, nos résultats montrent que le système nerveux central est très sensible aux phtalates, puisque une exposition à des doses égales ou inférieures à la DJT induit, chez la souris, des altérations comportementales et neurales dans les deux sexes, et probablement aussi des effets endocriniens chez la femelle. L’évaluation du risque de l’exposition aux phtalates pour la santé humaine ne devrait donc pas reposer uniquement sur la constatation de leurs effets sur la production fœtale de testostérone, mais devrait également tenir compte de la mise en évidence de leur impact sur le système nerveux central.