Le microbiote intestinal, défini par l’ensemble des micro-organismes présents au sein de notre tube digestif, contribue à l’éducation du système immunitaire [ 1 ]. Un déséquilibre quantitatif ou qualitatif du microbiote, aussi appelé dysbiose, est impliqué dans la pathogenèse de diverses maladies, notamment certaines maladies inflammatoires ou métaboliques, ou certains cancers. De nombreuses études ont montré l’existence d’un lien entre le développement des cancers, l’immunité anti-tumorale, l’efficacité des immunothérapies, et la composition du microbiote intestinal [ 2 ]. Ce lien repose en partie sur le phénomène de mimétisme moléculaire [ 3 ]. Le cyclophosphamide, une molécule de chimiothérapie anti-tumorale dont l’effet repose en partie sur sa capacité à moduler le système immunitaire, induit une modification du microbiote intestinal, avec une translocation de bactéries à Gram positif vers les organes lymphoïdes secondaires, où elles sont capables de stimuler une réponse immunitaire Th17 et Th1 anti-bactérienne, mais aussi anti-tumorale. Un traitement préalable par antibiotiques a un impact négatif sur cet effet [ 4 ]. La bactérie Enterococcus hirae a la capacité de restaurer l’effet anti-tumoral du cyclophosphamide chez des souris préalablement traitées par antibiotiques, en induisant une réponse immunitaire adaptative : réponse Th17, augmentation du rapport lymphocytes T cytotoxiques / lymphocytes T régulateurs [ 5 ]. Le mécanisme par lequel un antigène d’un virus bactériophage 1 infectant certaines souches de E. hirae restaure l’effet immunomodulateur et anti-tumoral du cyclophosphamide et d’un anticorps anti-PD1 (un inhibiteur de point de contrôle immunitaire) vient d’être découvert [ 6 ]. Les travaux précliniques présentés dans l’article publié utilisent des souris de la souche C57BL/6. Des cellules tumorales MCA205 (sarcome), TC1 (cancer du poumon) ou MC38 (cancer du côlon) ont été inoculées à ces souris, qui ont ensuite été traitées par des antibiotiques à large spectre, et auxquelles ont été administrées différentes souches (13144, IGR11, ATCC9790, 13344, ou 708) de E. hirae par voie orale et le cyclophosphamide par voie intra-péritonéale. Les résultats indiquent que seules les souches 13144 et IGR11 de E. hirae induisent une diminution de la taille des tumeurs MCA205 [ 6 ].
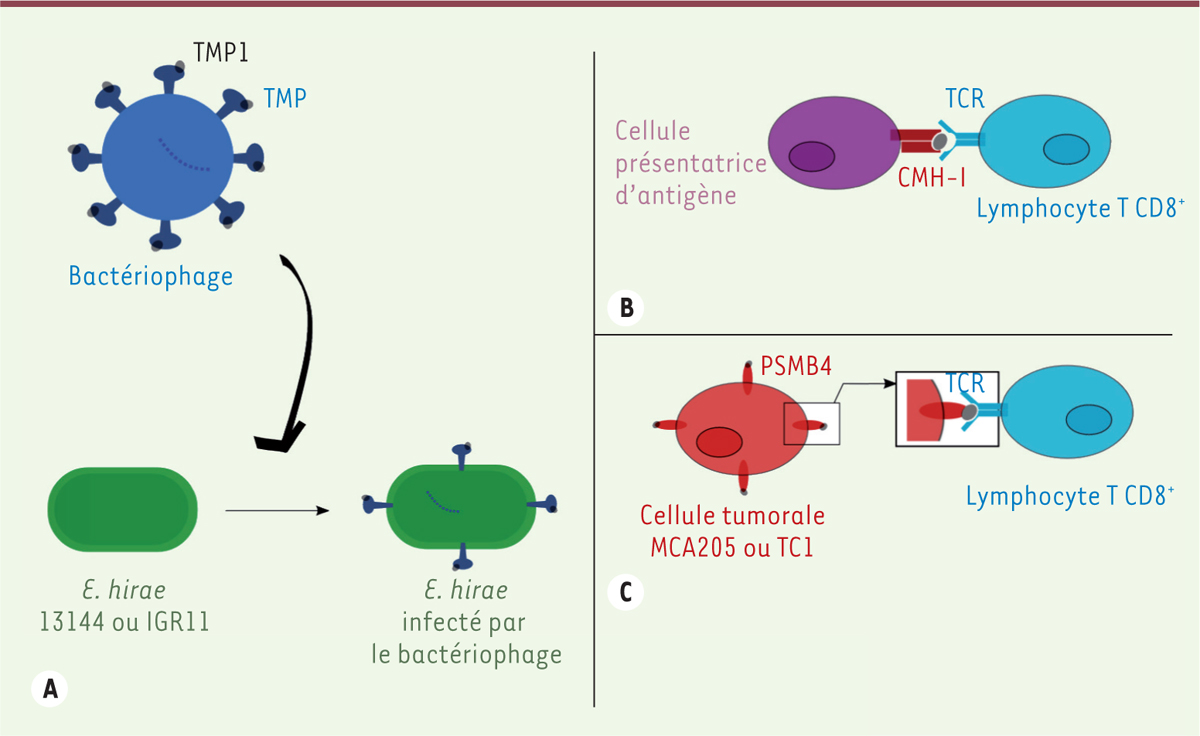
Afin d’identifier un épitope d’intérêt, les séquences des peptides d’une souche immunogène (13144) ou non immunogène (708) de E. hirae ont été comparées. Parmi les peptides spécifiques de E. hirae 13144, ont été sélectionnés ceux composés de 9 acides aminés (nonapeptides) et présentant une forte affinité pour le complexe majeur d’histocompatibilité de classe I (CMH-I). Lorsque ces peptides ont été présentés in vitro , par une cellule dendritique, aux lymphocytes T CD8 + des souris porteuses de tumeurs MCA205, traitées par des antibiotiques à large spectre et ayant reçu des bactéries E. hirae 13144 puis du cyclophosphamide, le peptide TSLARFANI ou TMP1 était le seul à restimuler ces lymphocytes et à induire la production d’interféron-γ. TMP1 est un antigène d’un bactériophage, et il est présent à la surface des bactéries E. hirae de la souche 13144 puisqu’il s’agit d’une partie de la protéine TMP ( tape measure protein ), composée de 1 506 acides aminés et codée par un gène du génome de ce bactériophage. Or l’épitope TMP1 des bactéries E. hirae de la souche IGR11 est identique à celui de la souche 13144, alors que les bactéries des souches 708 et 13344 n’expriment pas TMP1 et celles de la souche ATC9790 expriment un TMP1 muté, ce qui est concordant avec le fait que seules les souches 13144 et IGR11 de E. hirae ont un effet anti-tumoral. L’utilisation de tétramères H-2K b /TMP1 (équivalent chez la souris d’un tétramère CMH-I/TMP1 chez l’homme) a permis de confirmer l’augmentation du nombre de lymphocytes T CD8 + spécifiques de TMP1 après administration des bactéries E. hirae de la souche 13144 ou IGR11 aux souris par voie orale. Ces lymphocytes expriment CXCR3 ( C-X-C motif chemokine receptor 3 ) et CCR9 ( C-C motif chemokine receptor 9 ), ce qui témoigne de la mise en place d’une mémoire immunitaire [ 6 ].
Pour confirmer le rôle de TMP1, les souris ont ensuite été immunisées avec la bactérie E. hirae 13144 (témoin positif) ou avec des cellules dendritiques présentant le peptide TMP1 des souches 13144 et IGR11 de cette bactérie, ou le peptide TMP1 muté de la souche ATC9790 , ou d’autres peptides non immunogènes. L’efficacité anti-tumorale de l’immunisation par TMP1 seul s’est avérée similaire à celle du « gavage » des souris par E. hirae 13144. Enfin, l’administration aux souris, par voie orale, de la bactérie E. coli , qui n’a aucun effet anti-tumoral naturellement, montre, lorsque cette bactérie a préalablement été modifiée pour exprimer TMP1, la même efficacité anti-tumorale qu’avec la souche 13144 de E. hirae [ 6 ].
Pour comprendre les mécanismes impliqués dans l’effet anti-tumoral observé, un criblage moléculaire a été réalisé afin de rechercher des antigènes tumoraux présentant une homologie de séquence avec TMP1. Cela a permis d’identifier le peptide GSLARFRNI appartenant à la sous-unité β de type 4 du protéasome (PSMB4). La protéine PSMB4 est surexprimée dans les cellules tumorales MCA205 et TC1 relativement aux tissus sains correspondants, alors qu’elle ne l’est pas dans les cellules tumorales MC38. Or les souris porteuses d’une tumeur MCA205 ou TC1 répondent au traitement par le cyclophosphamide et E. hirae 13144, contrairement à celles porteuses de la tumeur MC38. Dans les tumeurs MCA205, une invalidation du gène codant PSMB4 perturbe la croissance tumorale, et affecte aussi l’efficacité de l’association cyclophosphamide et E. hirae 13144, mais pas celle du cyclophosphamide en monothérapie, chez les souris ayant subi une inoculation de ces cellules tumorales ainsi qu’une antibiothérapie à large spectre. Ces résultats renforcent l’hypothèse de l’existence d’une réaction immunitaire croisée entre un antigène de bactériophage et un antigène tumoral. Ainsi, les lymphocytes T CD8 + sélectionnés par un tétramère H-2K b /TMP1 sont capables d’induire une synthèse d’interféron-γ en réponse à une stimulation par TMP1, mais aussi, dans une moindre mesure, par PSMB4. De la même façon, les lymphocytes T CD8 + sélectionnés par un tétramère CMH-I/PSMB4 reconnaissent à la fois PSMB4 et TMP1. Par ailleurs, l’étude du récepteur des lymphocytes T ( T cell receptor , TCR) met en évidence qu’environ la moitié des lymphocytes T CD8 + sélectionnés par le tétramère H-2K b /PSMB4 ont le même clonotype TCR 2, que les lymphocytes T CD8 + sélectionnés par le tétramère H-2K b /TMP1, confirmant ainsi la réactivité croisée entre ces deux épitopes [ 6 ].
Chez l’Homme, en l’absence de maladie, le bactériophage infectant E. hirae 13144 peut être détecté dans des échantillons de selles, même en l’absence de l’intégralité du génome de cette bactérie, suggérant que plusieurs types de bactéries peuvent être infectées par ce phage, notamment parmi les entérocoques. Chez des patients atteints de cancer, TMP1 est détecté dans environ 34 % des échantillons de selles. Les patients présentant un cancer du rein ou du poumon à un stade avancé et chez lesquels TMP1 est détecté présentent une meilleure réponse thérapeutique à l’administration d’anticorps anti-PD1. Parmi les nonapeptides dérivés de TMP, seize sont susceptibles d’être reconnus par le CMH-I, six étant capables d’induire une synthèse d’interféron-γ et un seul présentant une homologie de séquence avec un antigène de tumeur : il s’agit du peptide de séquence KLAKFASVV, semblable à la séquence KLQKFASTV d’un peptide dérivé de la protéine GPD1-L ( glycerol-3-phosphate deshydrogénase 1-like ). Une forte expression de GPD1-L est associée à un meilleur pronostic dans les carcinomes rénaux à cellules claires et les carcinomes bronchiques « non à petites cellules ». De plus, l’expression de GPD1-L est associée à une meilleure réponse à une immunothérapie par anticorps anti-PD1, et n’est pas corrélée à l’expression de PD-L1 au sein de la tumeur. Ces données suggèrent donc l’existence d’une réaction immunitaire croisée entre peptides issus de TMP et de GPD1-L chez l’homme [ 6 ].
Ces travaux montrent qu’un peptide issu d’un virus infectant une bactérie commensale peut être présenté par le CMH-I et induire une réponse par des lymphocytes T CD8 + à mémoire. Ces lymphocytes peuvent aussi reconnaître des antigènes spécifiques de tumeurs par réactivité croisée / mimétisme moléculaire ( Figure 1 ) . Compte tenu de la grande diversité du microbiote intestinal, tant en termes de bactéries que de bactériophages, il est probable que notre organisme abrite de nombreux antigènes présentant une homologie de séquence peptidique avec des antigènes de tumeur, et qui constituent autant d’atouts thérapeutiques pour stimuler les défenses immunitaires et optimiser les immunothérapies anti-cancéreuses.
| Figure 1.
Réactivité croisée entre antigènes tumoraux et antigènes du microbiote intestinal. A.
Bactériophage et
E. hirae.
B.
Présentation du peptide TMP1 aux lymphocytes T CD8
+
par le CMH-I.
C.
L’antigène tumoral issu de PSMB4 est reconnu par les lymphocytes CD8
+
spécifiques de l’antigène TMP1 du bactériophage.
|